Введение
В промышленно развитых странах наблюдается выраженная тенденция к росту продолжительности жизни и увеличению числа пожилых людей в структуре населения, что приводит к определенным социально-экономическим трудностям. По прогнозам Age UK и Национальной статистической службы Великобритании, к 2034 г. практически каждый четвертый житель этой страны будет старше 65 лет, при этом 58% людей в возрасте старше 60 лет имеют хронические заболевания, а 25% — имеют два или более заболевания, что существенно снижает трудоспособность населения. Остеоартрит и боли в пояснице являются главными причинами утраты трудоспособности в возрастной группе старше 50 лет [1]. В комплексном анализе Hoy et al. (2010) по эпидемиологии болей в спине среди взрослого населения [2] было выявлено, что частота поясничных болей колеблется от 2% до 40% (в среднем 15%) и увеличивается в старших возрастных группах. Боли в спине у пожилых людей имеют ряд особенностей, связанных с такими морфологическими изменениями позвоночника, как остеопоротические переломы, метастазы, центральный или боковой стеноз позвоночника, дегенеративный спондилолистез и дегенеративный сколиоз [3].
Согласно современной классификации поясничные боли подразделяются на:
неспецифические (скелетно-мышечные);
связанные с заболеваниями (опухоли, травмы, инфекции и др.);
вызванные компрессионной радикулопатией.
В 85% случаев в клинической практике встречается неспецифическая (скелетно-мышечная, механическая) боль [3, 4].
Основной задачей при обследовании пациента является последовательное исключение специфических причин поражения позвоночника и заболеваний нервной системы. В основе диагностики лежит анализ жалоб пациента, данных анамнеза, стандартное неврологическое обследование [5]. «Красные флажки тревоги» — признаки, симптомы или характеристики пациента, которые указывают на необходимость в дополнительном обследовании для исключения потенциально опасных состояний. По данным Henschke et al. (2009), диагностическая ценность «красных флажков» различна. Наиболее опасными являются значимая травма позвоночника, выраженный или прогрессирующий неврологический дефицит, тазовые нарушения, анестезия в аногенитальной области, онкологическое заболевание в анамнезе [6]. При наблюдении когорты пожилых людей с болями в спине в 6% случаев была диагностирована серьезная патология, в основном перелом позвоночника. Многофакторный регрессионный анализ показал, что 4 «красных флажка» были связаны с наличием этой патологии: возраст ≥75 лет, травма, остеопороз, высокоинтенсивные (≥7 баллов по визуальной аналоговой шкале [ВАШ]) боли в поясничном или грудном отделе позвоночника [7].
Процесс старения сопровождается изменением структуры и снижением функциональной активности органов и тканей, в т. ч. костной, с развитием остеопороза [8, 9].
Методы диагностики
Методы выявления позвоночного остеопороза те же, что и при установлении общей патологии скелета.
- Рентгенография. Обычно информативен только при запущенных стадиях, когда костная масса «усыхает» на 15–30%.
- Костная денситометрия. Предполагает определение плотности костных тканей по количеству поглощенных рентгеновских лучей.
- Радиоизотопное сканирование. Проводится с использованием так называемых радиоактивных маркеров, которые оседают только в тканях скелета.
- Лабораторные исследования: биохимические анализы крови, мочи, проба на гормоны.
«Безмолвная» болезнь
Остеопороз — это состояние, при котором уменьшается костная масса, вызывая нарушение структуры и снижение прочности костей, в результате чего повышается риск переломов. Наиболее распространенным методом диагностики остеопороза является денситометрическая оценка. Для определения минеральной плотности костей (МПК) «золотым стандартом» является двухэнергетическая рентгеновская абсорбциометрия (dual-photon absorptiometry, DРA). Для оценки Т-критерия МПК пациента сравнивают с эталонным стандартом МПК нормативной когорты в возрасте от 20 до 30 лет. Согласно рекомендациям ВОЗ (1994) остеопорозом считается снижение МПК по Т-критерию ниже -2,5; тяжелым остеопорозом — снижение Т-критерия ниже -2,5 в сочетании с одним или более переломом [10].
К первичным формам остеопороза относят постменопаузальный и сенильный, которые составляют 80% от всех видов, а также ювенильный и идиопатический. Постменопаузальный остеопороз, или остеопороз 1-го типа, характеризуется преимущественным поражением трабекулярной костной ткани, преобладанием ускоренной костной резорбции, развивается у женщин от начала наступления менопаузы до 65–70 лет. Сенильный остеопороз, как правило, развивается у лиц старше 70 лет, в костях с кортикальным типом строения и в губчатой кости; отмечается преимущественно снижение костеобразования, но нередки варианты с повышенной костной резорбцией. Каждая третья женщина в климактерическом периоде и более половины всего населения в возрасте 75–80 лет страдают остеопорозом. Распространенность остеопороза и финансовые затраты на лечение связанных с ним переломов неуклонно увеличиваются, при этом в 40% случаев рост распространенности обусловлен старением населения [10, 11].
Вторичные формы остеопороза возникают на фоне соматических заболеваний или длительного приема препаратов, вызывающих нарушение кальциевого обмена.
При остеопорозе плотность кости и тел позвонков снижается до 70% и 50% соответственно. Снижение костной массы, как правило, протекает бессимптомно, даже при развитии деформации тела позвонка и уменьшении высоты диска. В то время как переломы конечностей обычно сопровождаются яркой клинической картиной, некоторые типы переломов позвонков, особенно клиновидные, могут не вызывать болевых ощущений. Остеопоротические переломы с болевым синдромом в пояснично-крестцовом отделе позвоночника чаще встречаются у женщин: 25% женщин в постменопаузе имеют компрессионные переломы позвоночника, а в возрасте старше 80 лет — 40%. Риск переломов позвонков при остеопорозе сильно варьирует в зависимости от наличия или отсутствия уже существующих переломов позвонков [12, 13].
Для оценки 10-летней вероятности переломов, связанных с изменением плотности и качества костной ткани (клинически значимого перелома позвоночника, перелома дистального отдела предплечья, перелома проксимального отдела бедра или перелома плеча), предложена шкала FRAX, разработанная ВОЗ. Алгоритм FRAX применяется у женщин в постменопаузе и мужчин 50 лет и старше. В модели оценки учитываются возраст, пол, наличие ревматоидного артрита и вторичных причин остеопороза: сахарного диабета 1 типа, несовершенного остеогенеза у взрослых, длительного гипертиреоза без лечения, гипогонадизма или преждевременной менопаузы (<40 лет), хронического недоедания или мальабсорбции, хронического заболевания печени, а также предшествующие остеопоротические переломы (включая клинические и бессимптомные переломы позвонков), переломы бедра у родителей, курение, низкий индекс массы тела, употребление алкоголя (≥3 доз в день), использование пероральных глюкокортикоидов ≥5 мг/сут преднизолона в течение >3 мес., снижение МПК (при возможности его оценки).
МПК коррелирует с прочностью кости и является лучшим предиктором риска переломов. Измерение в центральных (поясничный отдел позвоночника и зона Варда бедра) и периферических участках скелета (предплечье, пятка, пальцы) позволяет оценить риск переломов. У женщин в постменопаузе и у мужчин в возрасте старше 50 лет диагностический Т-критерий ВОЗ (норма, остеопения и остеопороз) определяется по измерению МПК методом DPA в поясничном отделе позвоночника и шейке бедра [14].
Согласно рекомендациям Американской ассоциации клинических эндокринологов (American Association of Clinical Endocrinologists, AACE) и Американской коллегии эндокринологов (American College of Endocrinology, ACE) оценка МПК показана:
Всем женщинам ≥ 65 лет.
Женщинам в постменопаузе:
с наличием переломов без серьезной травмы;
при остеопении, выявленной рентгенологически;
принимавшим глюкокортикоидную терапию (≥3 мес.)
Женщинам в пери- или постменопаузе с такими факторами риска развития остеопороза, как:
низкая масса тела (<57 кг или индекс массы тела <20 кг/м2);
долгосрочная системная глюкокортикоидная терапия (≥3 мес.);
семейный анамнез переломов на фоне ОП;
ранняя менопауза (<40 лет);
курение;
чрезмерное употребление алкоголя.
При вторичном остеопорозе [15].
Наличие остеопении не должно рассматриваться как самостоятельное заболевание, указание на остеопению предназначено исключительно для эпидемиологического описания. Дополнительные факторы риска переломов включают уменьшение роста (>4 см) и грудной кифоз. Костные маркеры — пропептид сывороточного проколлагена типа I (serum procollagen type I amino-terminal propeptide, s-PINP) и С-концевой сшивающий телопептид коллагена типа I (C-terminal telopeptide of type I collagen, s-CTX) в качестве индикаторов образования и резорбции кости соответственно имеют некоторое прогностическое значение для переломов в ситуациях, когда измерение МПК недоступно [16].
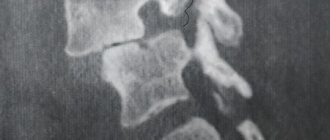
Рентгенологически подтвержденные переломы позвонков (даже бессимптомные) являются признаком нарушения качества и прочности кости и сильным предиктором новых переломов, независимо от МПК, возраста и других клинических факторов риска. Наличие одного перелома позвонка увеличивает риск последующих переломов в 5 раз, а риск перелома бедра и других переломов — в 2–3 раза. Перелом позвонков подтверждает диагноз остеопороза, даже при отсутствии выраженного снижения МПК, и является показанием для фармакологического лечения, снижения риска последующего перелома. Большинство переломов позвонков протекают бессимптомно, когда они появляются впервые, и часто не диагностируются в течение многих лет. Визуализация позвонков как единственный способ диагностировать эти переломы показана:
Всем женщинам в возрасте 70 лет и старше и всем мужчинам в возрасте 80 лет и старше, если Т-критерий МПК в области позвоночника, всего бедра или шейки бедра составляет ≤ -1,0.
Женщинам в возрасте от 65 до 69 лет и мужчинам в возрасте от 70 до 79 лет, если Т-критерий МПК в области позвоночника, всего бедра или шейки бедра составляет ≤ -1,5.
Женщинам в постменопаузе и мужчинам в возрасте 50 лет и старше со специфическими факторами риска: в виде травматического перелома в зрелом возрасте (50 лет и старше), при снижении роста на 4 см, лечении глюкокортикоидами.
Повторная визуализация показана только при продолжающейся потере роста, появлении болей или деформации позвоночника [14].
Особенности поясничных болей при остеопорозе
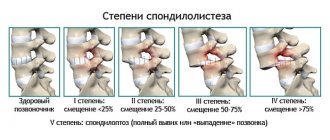
Остеопороз позвонков без переломов не служит источником болевого синдрома. Изменения конфигурации позвонков нередко являются случайной находкой при рентгенографии. Согласно литературным данным болевой синдром в поясничной области при остеопорозе не отличается от болей у пациентов без остеопороза, за исключением случаев острых болей при переломах [3]. Компрессионные переломы (уменьшение высоты тел позвонков более чем на 20%) чаще возникают в нижнегрудном и верхнепоясничном отделах. Для переломов типично возникновение острых локальных болей после незначительной травмы или даже привычного движения, боли усиливаются при движении, кашле [8]. Типична провокация боли при перкуссии остистых отростков пораженного позвонка. Сложными для диагностики являются случаи переломов крестца, как правило, небольшие. Для таких пациентов типичны боли в пояснично-крестцовой области, глубинные боли в ягодичной области, иногда с иррадиацией в ногу, без убедительной корешковой симптоматики, которые часто возникают после незначительных травм, неловких движений. Боли усиливаются при пальпации и перкуссии в проекции перелома, при стандартной рентгенографии небольшие переломы не видны, лучше они визуализируются на КТ или МРТ.
Особенностью корешковой симптоматики при остеопорозе является более частое поражение верхнепоясничных корешков с иррадиацией боли в живот, пах, по передней и внутренней поверхности бедер. Относительно редко выявляются парезы нижних конечностей, тазовые нарушения, проводниковые нарушения чувствительности. Имеются указания на возможность хронических болей, преимущественно мышечного характера, на фоне грубой деформации позвоночника, но уровень доказательности этих данных очень низкий [8, 10].
Собственный опыт изучения особенностей болей в пояснице при остеопорозе
На базе Клиники нервных болезней им. А.Я. Кожевникова мы провели пилотное исследование, целью которого являлось изучение особенностей болевого синдрома у пациентов с хронической вертеброгенной люмбоишиалгией, страдающих остеопорозом. Обследовано 20 пациентов, из которых у 10 пациентов (средний возраст 65,2±5,27 года) был диагностирован остеопороз, и 10 пациентов (средний возраст 63,9±5,67 года) без остеопороза, которые составили контрольную группу. В задачи исследования входили оценка болевого синдрома и нейроортопедическоrо статуса для выявления доминирующего источника боли, оценка нейропсихологического статуса и выраженности деформации позвоночника. Диагностика остеопороза проводилась методом количественной ультразвуковой денситометрии на аппарате Omnisense 7000S при уменьшении показателя Т-критерии-2,5SD
и ниже. Другие методы инструментального обследования включали: рентгенографию пояснично-крестцовоrо отдела позвоночника в прямой и боковой проекциях, КТ и МРТ поясничного отдела позвоночника. В рамках исследования проводилась оценка индекса нетрудоспособности по шкале Oswestry (Oswestry Low Back Pain Disability Questionnaire), оценка боли по ВАШ. С учетом влияния остеопороза на биомеханику позвоночника проводилось измерение угла кифоза, лордоза и сколиоза с использованием гибкого стержня по методике, предложенной М.А. Katbleen. Для оценки выраженности депрессии и тревоги использовались опросник депрессии Бека, госпитальная шкала тревоги и депрессии, тест Гамильтона.
При исследовании кривизны позвоночника было обнаружено статистически достоверное увеличение углов грудного кифоза, поясничного лордоза и пояснично-грудного сколиоза у пациентов, страдающих остеопорозом (p<0,001). Уровень боли по ВАШ достоверно не отличался в группах и составил у пациентов с остеопорозом и пациентов без остеопороза 6,2±1,8 и 5,9±1,4 мм соответственно (p>0,5). Боли, характерные для дисфункции крестцово-подвздошного сочленения, определялись у 8 пациентов с остеопорозом и у 7 пациентов в контрольной группе, болезненность фасеточных суставов на поясничном уровне — у 6 и 4 пациентов соответственно. Все 20 пациентов в обеих группах имели мышечно-тонический синдром различной степени выраженности, который проявлялся в напряжении и болезненности паравертебральных мышц, синдром грушевидной мыщцы — у 3 и 2 пациентов соответствующих групп. Корешковая симптоматика была выявлена у 1 пациентки с остеопорозом и у 2 в контрольной группе. При оценке тревоги и депрессии, степени нетрудоспособности в 2 группах статистически достоверных различий получено не было, однако имелась тенденция к преобладанию их в группе пациентов с остеопорозом.
Таким образом, в нашем пилотном исследовании было показано, что остеопороз сам по себе не является причиной хронических болей в нижней части спины у пожилых пациентов. Не было получено статистически значимых различий в источниках боли, интенсивности боли, степени тревожно-депрессивных расстройств и степени инвалидизации у пациентов с хроническим поясничным болевым синдромом, с наличием остеопороза и без такового.
Остеопоротическая деформация позвонков приводит в основном к выраженным нарушениям осанки, сопровождающимся увеличением грудного кифоза, сглаживанию поясничного лордоза и S-образному пояснично-грудному сколиозу, что также может быть причиной вторичного мышечного спазма. С учетом небольшого объема групп пациентов, включенных в исследование, данный вопрос требует дальнейшего изучения.
Виды
Остеопороз бывает первичным и вторичным. Первый развивается в силу возраста или гормональных сбоев в организме. Наибольший риск заболеть отмечается у женщин старше 55 лет.
Вторичный остеопороз развивается под влиянием развившихся дегенеративных процессов. Это могут быть:
- аутоиммунные болезни;
- генетическая предрасположенность;
- ревматизм;
- длительный прием лекарств.
Наиболее часто провокаторами выступают менопауза и старческий возраст.
Особенности ведения пациентов с болями в спине при наличии остеопороза
Лечение пациентов с болями в спине при наличии остеопороза проводят в соответствии с общими принципами ведения неспецифических болей в спине, разработанными в международных клинических руководствах. В целом в большинстве руководств по лечению неспецифических болей в спине рекомендованы образовательные программы для пациентов, сохранение активности, гимнастика и применение НПВП в качестве препаратов первой линии [15–17]. Лечение хронических поясничных болей должно включать упражнения, НПВП и мультимодальную реабилитацию (в виде комбинации физических и психологических методик лечения) [11]. Метаанализ нескольких рандомизированных контролируемых исследований (РКИ) показал, что ходьба является одним из наиболее эффективных, безопасных и доступных методов лечебной гимнастики [18].
Показано использование комплексного подхода, включающего физическую и психологическую реабилитацию, с применением когнитивно-поведенческой терапии, если существуют реальные психосоциальные аспекты, препятствующие восстановлению, а также при неэффективности лечения [15].
Пациенты с остеопорозом должны получать терапию основного заболевания, согласно международным и отечественным клиническим рекомендациям по ведению остеопороза, кроме того, лечение пациентов с поясничными болями на фоне остеопороза имеет ряд особенностей. Двумя ключевыми элементами в лечении остеопороза являются увеличение костной массы с помощью анаболической терапии и уменьшение резорбции кости с помощью антирезорбтивной терапии.
Согласно рекомендациям ESCEO, пациенткам в постменопаузе в связи с риском развития остеопороза рекомендуется более высокое потребление белка, продуктов, содержащих кальций, в сочетании с физическими упражнениями [17].
Физическая активность была предложена как нефармакологический метод для повышения плотности костей у молодых и предотвращения потери костной массы у пожилых людей [19]. Показано, что программы физических упражнений снижают риск развития переломов, т. к. способствуют увеличению плотности кости, уменьшают содержание воспалительных маркеров [20], улучшают силу и координацию у стареющих женщин с остеопорозом, уменьшая риск падений [21]. В то же время для ремоделирования костной ткани нужны достаточно интенсивные динамические упражнения, которые сложно выполнять пожилым женщинам [22].
Скелет содержит 99% запасов кальция в организме. Когда экзогенное поступление кальция недостаточно, костная ткань резорбируется, чтобы поддерживать постоянный уровень кальция в сыворотке крови. Сбалансированная диета, богатая нежирными молочными продуктами, фруктами и овощами, обеспечивает поступление кальция. Возможно назначение пищевых добавок кальция до рекомендуемой суточной дозы. Адекватное потребление кальция в течение всей жизни необходимо для приобретения пиковой костной массы и последующего поддержания здоровья костей. Согласно рекомендациям Института медицины (Institute of Medicine, IOM) США мужчины в возрасте 50–70 лет должны потреблять 1000 мг кальция в день; женщины в возрасте 51 года и старше, мужчины в возрасте 71 года и старше — 1200 мг кальция в день. Национальный фонд остеопороза рекомендует потребление не менее 1200 мг кальция в день и 800–1000 МЕ витамина D в день для женщин в постменопаузе [23, 24]. Нет доказательств того, что потребление кальция сверх этих количеств придает дополнительную прочность кости. Чрезмерное потребление кальция (более 2000 мг в день) может быть потенциально вредно. Повышенный риск сердечно-сосудистых событий, мочекаменной болезни и даже переломов был обнаружен в связи с чрезмерным потреблением кальция, но этот вопрос остается нерешенным [25].
Существует высокая распространенность дефицита витамина D у пациентов с остеопорозом, особенно с переломами бедра. Потребление витамина D, рекомендованное IOM, составляет 600 МЕ/сут для лиц в возрасте до 70 лет и 800 МЕ/сут для лиц в возрасте 71 года и старше. По данным метаанализа РКИ (Weaver et al., 2016), использование добавок кальция и витамина D снижает риск переломов на 15%, а переломов бедра — на 30% [22].
Остеогенон (активный компонент: соединение оссеин-гидроксиапатит [ОГС]) — препарат, влияющий на минерализацию костей (регулятор кальциево-фосфорного обмена), содержит необходимые для синтеза костной ткани компоненты и оказывает двоякое действие на метаболизм костной ткани: стимулирует остеобласты и ингибирует остеокласты. Кальций содержится в препарате в виде гидроксиапатита (в соотношении с фосфором 2:1), что способствует более полному его всасыванию из ЖКТ. Ингибирует выработку паратгормона (ПТГ) и предотвращает гормонально обусловленную резорбцию костной ткани. Замедленное высвобождение кальция из гидроксиапатита обусловливает отсутствие пика гиперкальциемии. Фосфор, участвующий в кристаллизации гидроксиапатита, способствует фиксации кальция в кости и тормозит его выведение почками.
Оссеин — органический компонент препарата, содержащий локальные регуляторы ремоделирования костной ткани (β-трансформирующий фактор роста, инсулиноподобные факторы роста I и II, остеокальцин, коллаген I типа), которые активизируют процесс костеобразования и угнетают резорбцию костной ткани. β-трансформирующий фактор роста стимулирует активность остеобластов, повышает их количество, способствует выработке коллагена, а также ингибирует образование предшественников остеокластов. Инсулиноподобные факторы роста I и II стимулируют синтез коллагена и остеокальцина. Остеокальцин способствует кристаллизации костной ткани путем связывания кальция. Коллаген I типа обеспечивает формирование костной матрицы. В проведенном С.С. Родионовой и соавт. (2006) исследовании при назначении ОГС пациенткам с постменопаузальным и сенильным остеопорозом, у которых потеря костной массы до лечения превышала 30–40% от возрастной нормы, переломы тел позвонков отмечались реже, чем у женщин из контрольной группы, не принимавших указанный препарат (6,7% против 40 %). Кроме того, у пациенток контрольной группы продолжалась потеря МПК в телах позвонков [26].
В рандомизированном открытом проспективном контролируемом исследовании с параллельными группами сравнивалось влияние ОГС (группа лечения) и карбоната кальция (контрольная группа) на метаболизм кости в группе женщин старше 65 лет с денситометрически подтвержденным остеопорозом. Уровни остеокальцина в сыворотке крови увеличились в большей степени у пациентов группы ОГС по сравнению с данным показателем у пациентов, получавших карбонат кальция. У пациентов группы ОГС уровень остеокальцина увеличивался на 0,84±3,13 нг/мл на 2-й год и на 1,86±2,22 нг/мл на 3-й год исследования, тогда как у пациенток, получавших карбонат кальция, данный показатель уменьшался на 0,39±1,39 нг/мл на 2-й год и увеличивался на 0,31±2,51 нг/мл на 3-й год исследования (данные представлены как среднее ± стандартное отклонение); различия между группами лечения были статистически значимыми (р<0,05 во всех случаях). Изменения во времени уровня остеокальцина в сыворотке также были статистически значимыми (р<0,05) в группе ОГС, но не в группе карбоната кальция. Изменения средней МПК в поясничном отделе позвоночника и шейке бедра между исходным уровнем и 3-м годом составили 1,1% и 2,5% для OГC; 2,3% и 1,2% для карбоната кальция соответственно. Сделан вывод о большем анаболическом эффекте ОГС [27]. Кроме того, был выявлен выраженный обезболивающий эффект в группе ОГС при болях в спине и колене, а также улучшение показателей качества жизни [28].
Согласно клиническим рекомендациям Министерства здравоохранения РФ по лечению патологических переломов, осложняющих остеопороз, в первый год после перелома в качестве препарата кальция рекомендуется принимать ОГС комплекс (уровень убедительности рекомендации B, уровень достоверности доказательств 3) [29], преимущества применения которого перед применением карбоната кальция описаны выше [27, 28]. Применение ОГС нормализует сроки сращения перелома на фоне остеопороза или остеопении и сокращает сроки сращения кости при псевдоартрозе [30, 31].
Специфическое лечение рекомендуется для женщин в постменопаузе, у которых показатель МПК составляет Т=-2,5 или менее, в анамнезе перелом позвоночника или бедра, или повышенный риск перелома по шкале FRAX. Одобренные FDA фармакологические варианты для профилактики и/или лечения постменопаузального остеопороза включают: бисфосфонаты (алендроновая кислота, ибандроновая кислота, золедроновая кислота), кальцитонин, эстрогены, агонист/антагонист эстрогеновых рецепторов (ралоксифен), ткане-селективный комплекс эстрогенов (конъюгированные эстрогены/базедоксифен), ПТГ и деносумаб — полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к RANKL (лиганд к рецептору RANK), тем самым препятствующее активации рецепторов RANK на поверхности остеокластов и их предшественников. Преимущества лекарственных средств, одобренных FDA, для предотвращения переломов в основном показаны у женщин с постменопаузальным остеопорозом. Имеются ограниченные данные о переломах при остеопорозе, вызванном глюкокортикоидами, и у мужчин. Было показано, что одобренное FDA лечение остеопороза снижает риск переломов у пациентов с переломами и/или остеопорозом, подтвержденным DРA. Фармакотерапия может также уменьшить риск переломов позвонков у пациентов с низкой костной массой (остеопения) без переломов, уровень этих доказательств низкий [14, 32].
В 2021 г. эксперты Американского колледжа терапевтов (American College of Physicians) выпустили обновленные Клинические рекомендации для предотвращения переломов при остеопорозе и остеопении, согласно которым:
Для снижения риска переломов бедра и позвоночника у женщин с доказанным остеопорозом показано назначение алендроновой кислоты, ризедроновой кислоты, золедроновой кислоты или деносумаба (сильная рекомендация, высокий уровень доказательности).
Продолжительность терапии должна составлять 5 лет (слабая рекомендация; низкое качество доказательств).
Для мужчин с клинически доказанным остеопорозом рекомендовано назначение бисфосфонатов (слабая рекомендация; низкое качество доказательств).
В период проведения фармакотерапии пациенты не нуждаются в контроле денситометрии (слабая рекомендация; низкое качество доказательств).
Не рекомендовано использование гормон-заместительной терапии или ралоксифена для лечения остеопороза у женщин (сильная рекомендация; умеренное качество доказательств).
Принятие решения о лечении женщин с наличием остеопении в возрасте старше 65 лет, с высоким риском переломов должно основываться на анализе предпочтений пациентов, характера переломов, потенциальной опасности и стоимости лечения (слабая рекомендация; низкое качество доказательств) [33].
Бисфосфонаты и деносумаб снижают риск переломов бедра и позвонков. Бисфосфонаты обычно используются в качестве первой линии лечения у женщин, не имеющих противопоказаний. У женщин, не переносящих пероральные бисфосфонаты (или у тех, кому они противопоказаны), внутривенные бисфосфонаты или деносумаб являются наиболее подходящей альтернативой, с ралоксифеном или гормональной терапией менопаузы в качестве дополнительных вариантов. ПТГ снижает риск развития невертебральных и вертебральных переломов. Остеонекроз челюсти и атипичные переломы бедра были зарегистрированы при лечении, но встречаются редко. Соотношение пользы и риска для лечения остеопороза является положительным для большинства женщин с остеопорозом. Поскольку преимущества сохраняются после отмены алендроновой кислоты или золедроновой кислоты, применение препарата после 5 лет терапии алендроновой кислотой или 3 лет терапии золедроновой кислотой может быть рассмотрено для пациентов с более низким риском перелома. Лечение следует пересмотреть после 3–5 лет лечения бисфосфонатом. Риск перелома должен быть переоценен после нового перелома, независимо от того, когда он произошел. Риск новых клинических и позвоночных переломов увеличивается у пациентов, которые прекращают лечение. Отмена терапии деносумабом связана с восстановлением частоты переломов позвонков. Терапия бисфосфонатом может рассматриваться после прекращения приема деносумаба. Существует мало доказательств, чтобы руководствоваться принятием решений после 10 лет лечения, и варианты лечения у таких пациентов должны рассматриваться на индивидуальной основе [14–16].
Группа экспертов Global Spine Care Initiative (2017) опубликовала рекомендации по использованию неинвазивных методов лечения острых компрессионных переломов тел позвонков на фоне остеопороза. Этим пациентам помимо постельного режима и обезболивания рекомендовано ношение корсетов, использование кальцитонина в связи с его обезболивающим эффектом. Показана ранняя мобилизация, а при достижении достаточного уровня обезболивания эффективно проведение гимнастики для улучшения функционального статуса и улучшения качества жизни [34].
В систематическом обзоре Parreira et al. (2017) различных рекомендаций по ведению пациентов с компрессионными переломами тел позвонков подчеркивается отсутствие единой доказанной позиции. В большинстве рекомендаций показано использование рентгенографии и DPA для диагностики, а для лечения — вертебропластики и кифопластики. В различных рекомендациях имеются противоречивые данные относительно назначения постельного режима, корсетов, электростимуляции, гимнастики [35].
Пациенты с остеопорозом и высоким риском переломов не должны выполнять упражнения на сгибание туловища в связи с тем, что такие нагрузки увеличивают риск перелома позвоночника (IIA класс рекомендаций); следует избегать интенсивных скручивающих движений туловища и упражнений на максимальное растяжение позвоночника (III С). Безопасными считаются разгибательные и стабилизирующие упражнения на мышцы брюшного пресса (IIA), различные аэробные физические нагрузки или тренировки с отягощениями. Советуют начинать с легких нагрузок (по 15–30 мин), с постепенным увеличением интенсивности, учитывая индивидуальную переносимость (IIA) [36, 37].
При недостаточной эффективности обычного лечения возможно применение блокад местных анестетиков и глюкокортикоидов, в зависимости от основного источника боли, а при острых переломах возможно внутрикостное введение; при кратковременном эффекте блокад возможно проведение радиочастотной денервации [3]. Использование короткого курса блокад с глюкокортикоидами безопасно у женщин в постменопаузе с остеопорозом и не оказывает влияния на риск остеопоротических переломов [38].
Как возникает остеопороз
Костная ткань человека постоянно обновляется. В этом процессе участвует два типа клеток: остеокласты и остеобласты. Остеокласты разрушают костную массу, а остеобласты воссоздают. При остеопорозе остеокласты активизируются, костная ткань быстрее разрушается, чем формируется. Кости становятся пористыми и хрупкими, легко возникают переломы. Болезнь чаще всего поражает позвонки, кости таза, запястья и предплечий.
Больше всего костной ткани образуется в 16 лет, когда формирование костной массы преобладает над разрушением. В 30-50 лет разрушение и восстановление костной ткани происходит одинаковыми темпами. После 50 лет ускоряются процессы разрушения костной ткани. Ежегодно пожилой человек теряет 2–5% костной массы. Таким образом остеопороз костей возникает из-за старения организма. Болезнь развивается постепенно в течение нескольких лет.
Осложнения
Согласно статистическим данным, остеопороз занимает одно из лидирующих мест среди причин инвалидности и смертности. Основными осложнениями патологии считаются переломы:
- шейки бедра;
- лучевых костей;
- позвонков.
Перелом костей вынуждает пациентов длительно соблюдать постельный режим. В результате возрастает риск образования пролежней и пневмонии. Тяжелые стадии остеопороза приводят к внешним физическим дефектам, которые способствуют нарушению самообслуживания. Поэтому важно вовремя диагностировать патологию и проводить корректное лечение. В случае выявления остеопороза необходимо строго следовать рекомендациям врача.
Записаться на приём