Воспаления мягких тканей ноги могут протекать в различных формах и локализоваться в самых разных местах. Клиническая картина, однако, имеет общие проявления. Курс лечения должен назначаться врачом, одним из этапов является ударно-волновая терапия.
При небольшой глубине процесса развивается болезненный отек с покраснением и повышенной температурой кожи. Если воспаление пошло глубже, больной испытывает приступы лихорадки, проявляются признаки интоксикации. Это свидетельствует о начале гнойно-некротической стадии.
При любых подозрениях на воспаление мягких тканей ноги следует немедленно обращаться к врачу, поскольку бурно развивающийся воспалительный процесс может в итоге привести к необходимости ампутации.
Типы воспалений ноги
Воспаление получить очень просто даже в быту. Разбитые колени, ссадины, царапины – типичные причины развития различных воспалений ноги. Проникновение микробов в мягкие ткани ног может также происходить:
- при кожных расчесах – например, при аллергии на укусы насекомых;
- при грибковых заболеваниях, сопровождающихся трещинами на коже;
- при диабетических язвах;
- при варикозном расширении вен;
- при инъекциях в антисанитарных условиях – например, в случаях наркозависимости;
- при травмах и ранениях – например, у спортсменов или военных;
- при заносе микрофлоры из первичных воспалительных очагов с кровью или лимфой.
Возбудителями гнойного воспаления мягких тканей служат гноеродные бактерии, в основном стафилококковые. На начальной стадии нарушается микроциркуляция крови, что связано с повреждением тканевой структуры. Если сразу не приступить к лечению воспаления мягких тканей ноги, начинается отек, уже вызывающий боль, когда мышечные ткани распирает от накопившейся жидкости, и они сигнализируют об этом через нервно-мышечное соединение. В подавляющем большинстве ситуаций больной принимает обезболивающее и забывает о проблеме. Тем временем, воспаление переходит в гнойную стадию, когда нервно-мышечная связь теряется, боли уже нет, но накапливается гной. Известны два варианта гнойного воспаления:
- Абсцесс. В просторечье – нарыв. Развивается в мышцах и подкожной клетчатке, имеет четко очерченные границы в рамках гнойной капсулы, которая формируется как защитная реакция организма на инфекцию.
- Флегмона. Острое разлитое воспаление подкожной клетчатки, не имеет четких границ, легко распространяется на всю конечность.
Для ног большую опасность также представляют анаэробные инфекции. Самые распространенные воспаления мягких тканей ноги, связанные с этим видом инфекций:
- Рожистое воспаление. Проявляется в виде образования пузырей на коже, покраснения, кровоизлияний. Возбудитель – стрептококк, воспаление может развиться при контакте с человеком, пораженным стрептококковой инфекцией, например, ангиной. Этот вид воспаления в редких случаях проходит самостоятельно, однако рассчитывать на это не стоит. Запущенные случаи рожистого воспаления придется лечить несколько месяцев.
- Гангрена – омертвение тканей. Возбудитель – бактерии семейства клостридий, «живущие» в почве и пыли. Гангрена лечится только путем ампутации, поэтому очень важно при травмах дезинфицировать раны и сразу обращаться к врачу.
Причины парапроктита
В большинстве случаев воспаление вызывают условно-патогенные бактерии и грибы, которые в норме присутствуют в кишечнике человека; однако, если им удаётся преодолеть слизистую оболочку и попасть в ткань, окружающую прямую кишку, в условиях отсутствия кислорода они начинают стремительно размножаться и вызывают острый воспалительный процесс. Как правило, парапроктит вызывается сразу комплексом возбудителей, в число которых может входить стрептококки, стафилококки, кишечная палочка.
Спусковым механизмом развития парапроктита может быть любое повреждение слизистой прямой кишки. Поэтому в число факторов риска парапроктита входят:
- анальные трещины;
- проктит (воспаление слизистой оболочки прямой кишки);
- запоры (плотные каловые массы могут травмировать слизистую);
- диарея (длительное расстройство стула приводит к повреждению слизистой оболочки);
- геморрой (лопнувшие геморроидальные узлы образуют открытые ранки).
Часто инфекция проникает через анальные железы. Данные железы предназначены для выделения ферментов, способствующих перевариванию пищи, и слизи, облегчающей прохождение каловых масс. Анальные железы выходят в прямую кишку в криптах – тканевых карманах, открытых навстречу движения каловых масс. В случае нарушения процесса опорожнения прямой кишки или при травме крипты (даже незначительной), крипта может закупориться. В результате в железе развивается воспалительный процесс, и инфекция по её протоку попадает в клетчаточные пространства.
Иногда инфекция может попасть в околопрямокишечные ткани с током крови. В этом случае источником инфекции могут быть воспалительные процессы в других органах.
Методы лечения воспалений ноги
Воспалительные процессы лечатся в несколько этапов. Если болезнь перешла в гнойную стадию, необходимы хирургическое удаление гноя и обработка раны. Далее и на более легких стадиях назначается противовоспалительная медикаментозная терапия – курс антибиотиков в виде таблеток или инъекций, в зависимости от происхождения и серьезности инфекции. Очень важно правильно подобрать препараты, для этого делается бактериальный посев. Больному прописывается обильное питье для скорейшего выведения токсинов из организма.
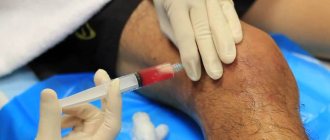
На восстановительной стадии назначается физиотерапия, направленная на регенерацию системы кровообращения и лимфотока. С этим успешно справляется курс ударно-волновой терапии, способствующий скорейшему восстановлению мягких тканей. Вы можете пройти его в нашей клинике «Медцентр-Плюс».
Симптомы парапроктита
Начало воспалительного процесса может отмечаться незначительным повышением температуры (до 37°C). При переходе воспаления в клетчаточное пространство, т.е. развитии собственно острого парапроктита, одномоментно проявляется комплекс симптомов. В первую очередь, это:
- повышение температуры до 38°C (и выше);
- озноб;
- боль в области прямой кишки, не связанная с дефекацией.
Подкожный парапроктит свои ярко выраженные симптомы: область воспаления, находящаяся рядом с анальным отверстием выделяется покраснением, отеком и уплотнением тканей. При ощупывании испытывается резкая боль.
При других видах парапроктита могут наблюдаться расстройство мочеиспускания, задержка стула, ложные позывы к дефекации.
Воспаление приводит к расплавлению клетчаточной ткани и накоплению гноя. При отсутствии своевременного лечения возникший гнойник прорывается и образуется свищевое отверстие – или наружу (в области промежности, на передней брюшной стенке или бедре), или в просвет кишки. У женщин гнойник может вскрываться, образовав свищевое отверстие во влагалище. Самый опасный вариант – открытие свищевого отверстия в брюшную полость.
После образования свища основная масса гноя выходит, и острота симптомов снижается. Однако гнойные процессы продолжаются, болезнь переходит в хроническую форму.
Симптомы хронического парапроктита
При хроническом парапроктите боль и дискомфорт ощущаются лишь в том случае, если выход гноя через свищ по какой-либо из причин затруднён. Обычно боли наблюдаются только при внутреннем свище. Боль усиливается во время дефекации, а потом затихает, поскольку растяжение кишечника во время прохождения каловых масс способствует выходу гноя. Гной или сукровица выделяются постоянно. При прямокишечном свище, имеющем наружное отверстие в области промежности, выделения раздражают кожу, вызывая зуд.
Для хронического парапроктита характерно волнообразное течение болезни. Свищевой канал время от времени перекрывается грануляциями, забивается отмершими тканями, в результате в очаге воспаления опять начинает накапливаться гной и возвращаются симптомы острого парапроктита. Потом гнойник снова прорывается и острота симптомов исчезает.
Виды и формы некроза
Есть 2 основные формы патологии:
- Сухой некроз. В медицине также называют коагуляционный. При нем происходит свертывание белка, который в скором времени становится похож на творожную массу. Кожа в проблемных местах станет желто-серой. При этой форме в месте, где происходит отторжение отмершей ткани, появляются язвочки, которые быстро превращаются в гнойники. После их вскрытия образуется свищ. На начальных этапах развития заболевания могут отмечаться следующие симптомы: повышенная температура тела, проблемы с функционированием проблемного органа.
- Влажный некроз. Медицинский термин – колликвационный некроз. Проявляется активным увеличением мягких тканей. В местах погибших тканей происходит их разжижение, формируется гнилостная среда для распространения вредоносных микроорганизмов. В добавок появляется запах гнили, с которым невозможно ничего сделать, даже в случае проведения лечения. Такая форма болезни чаще затрагивает кожу, головной мозг и другие органы, в которых собирается много жидкости. При активном развитии болезни могут появиться осложнения. Если некроз поразил головной мозг, то не исключено, что пациент может потерять память.
Помимо форм есть и несколько видов:
- пролежни – появляются у пациентов с лежачим образом жизни, которым не оказывают должного ухода;
- гангрена – появляется после активно развивающегося некроза. Сопровождается омертвением кожи, слизистых оболочек, тканей мышц;
- инфаркт – выявляется тогда, когда внезапно перестает поступать кровь к определенному органу;
- асептический – появляется при травме головки бедренной кости. Его симптомы – нестерпимые болевые ощущения в пораженном месте, невозможность самостоятельно передвигаться. Проявляются на 2-3 день после начала болезни;
- фибриноидный – выявляется в стенках кровеносных сосудов.
Введение
Саркомы мягких тканей составляют 15% всех злокачественных новообразований у детей и лишь 1-2,5% у взрослых. Они возникают с одинаковой частотой у лиц обоего пола с преимущественным поражением людей в возрасте от 20 до 40 лет. У 50% больных опухоли локализуются в области конечностей, у 40% — на туловище и у 10% — в области головы и шеи [1, 2, 10].
В России на 2008 г. заболеваемость саркомами мягких тканей составила 1,2 на 100 000 населения в год [3].
Согласно международной морфологической классификации сарком мягких тканей, насчитывают более 40 гистологических форм злокачественных опухолей мягких тканей [3]. Развиваясь из различных зародышевых листков, группа сарком мягких тканей представляется чрезвычайно гетерогенной по клиническому течению, прогнозу, подходам к лечению и ответу на него. По данным авторов, 42% составляют опухоли мезенхимального гистогенеза, 32% — опухоли эктодермального гистогенеза, 22% — опухоли мезодермального гистогенеза, 4% — опухоли эндодермального и неясного гистогенеза. По частоте морфологических форм злокачественные опухоли мягких тканей распределяются следующим образом: злокачественные фиброзные гистиоцитомы, липосаркомы, лейомиосаркомы, неклассифицируемые саркомы, синовиальные саркомы, рабдомиосаркомы и злокачественные опухоли из оболочек периферических нервов, фибросаркомы, ангиосаркомы [3, 4, 8, 12].
Саркомы мягких тканей на современном этапе развития онкологии представляют собой плохо изученную группу злокачественных новообразований человека. Несмотря на то что эти опухоли чаще имеют «наружную» локализацию, в их диагностике и лечении допускается значительное количество ошибок [3, 6, 7].
Ранняя диагностика сарком мягких тканей относится к ряду довольно сложных вопросов онкологической практики. Имеются объективные факторы, способствующие этому. Возникая в виде безболезненного, округлой или овальной формы узла в толще мышц, особенно в проксимальных отделах конечностей, злокачественные новообразования мягких тканей в ранних стадиях клинически не проявляются. Отсутствие болевого синдрома и нарушения функции пораженного сегмента приводит к тому, что пациент не придает значения самостоятельно выявленной опухоли, расценивая ее как доброкачественный или воспалительный процесс, часто прибегая к самолечению. Поводами для обращения за медицинской помощью являются большой размер новообразования, деформация контуров или нарушение функции близлежащего сустава, болевой синдром, развивающийся при сдавлении опухолью нервных стволов. При поражении дистальных отделов конечностей, где физиологически объем мягких тканей небольшой, опухоль проявляется даже при небольших размерах. Часто присоединяется боль. В этих ситуациях имеет место раннее обращение пациента за медицинской помощью.
Редкость заболевания, отсутствие онкологической настороженности со стороны как больного, так и врачей, небольшие размеры образования, безболезненность и кажущаяся доброкачественность процесса приводят к тому, что в 90% наблюдений ставятся такие диагнозы, как киста, липома, оссифицирующий миозит, гематома, фиброматоз, абсцесс, травматические повреждения мягких тканей, остеохондроз и др. При этом диагноз базируется только на анамнестических данных и локальном статусе, а инструментальные методы обследования не используются. Иногда выполняется стандартная рентгенография области опухоли, которая, как правило, неинформативна. Это приводит к тому, что лишь единичные больные направляются на консультацию к онкологу.
Неправильно установленный диагноз является причиной неправильного лечения: физиотерапии, массажа, противовоспалительной терапии. Производят вскрытие «абсцесса» или «гематомы» часто без морфологического исследования. Все перечисленные манипуляции стимулируют рост опухоли и отодвигают сроки проведения специальной терапии.
Для клинического течения сарком мягких тканей характерны ранняя гематогенная (до 60%) и в меньшей степени лимфогенная (5-15%) диссеминации, высокая частота локорегионарных рецидивов (10-30%), мультицентричный рост опухоли (15-25%). Все это определяет неблагоприятное развитие и течение заболевания. Адекватно планировать лечение можно только после тщательного обследования больного с определением полной клинической картины и степени распространенности опухолевого процесса. Поэтому во всех наблюдениях, кроме использования локальных методов исследования (УЗИ, КТ, МРТ пораженной области), необходимо проведение рентгенографии (предпочтительнее КТ) органов грудной клетки, УЗИ органов брюшной полости и регионарных лимфатических узлов, остеосцинтиграфии [1, 8, 9].
Материал для морфологической диагностики получают путем пункционной биопсии (аспирационной или трепанобиопсии), а также путем изготовления мазков-отпечатков с изъязвленной поверхности опухоли. Точность цитологической диагностики при саркомах мягких тканей достигает 83-85% [7]. Однако, учитывая гетерогенность структуры опухоли, наличие зон с различной степенью дифференцировки и большое разнообразие морфологических типов опухоли, предпочтительной является открытая биопсия. Она позволяет получить достаточный объем материала для исследования, более точно установить гистологическую принадлежность новообразования, определить степень ее дифференцировки и адекватно планировать дальнейшую тактику лечения больного. Выбор доступа для проведения открытой биопсии должен соответствовать дальнейшим планам ведения конкретного больного и выполняться онкологом, так как зона биопсии должна располагаться в месте последующего оперативного вмешательства и удаляться единым блоком с опухолью.
Тактика, объем лечения и прогноз заболевания при саркомах мягких тканей определяются стадией процесса, степенью дифференцировки опухоли, гистологической формой, локализацией, возрастом больного, наличием сопутствующих заболеваний. Так, применение только хирургического метода считается адекватным при высокодиффepeнциpoвaнных опухолях. У больных с умеренно- и низкодифференцированными саркомами должен применяться комбинированный подход (хирургический, лекарственный и лучевой методы лечения и их комбинации). Это позволяет достоверно уменьшить частоту локальных рецидивов и метастазирования опухоли и тем самым увеличить процент благоприятных исходов. С учетом перечисленного выше, тактика ведения больного должна обсуждаться в каждом конкретном наблюдении на консилиуме с участием хирургов-онкологов, химиотерапевтов и радиологов [5, 10].
Материал и методы
В отделении онкологической ортопедии МНИОИ им. П.А. Герцена за период с 1995 по 2010 г. находились на лечении 120 больных первичными или рецидивными саркомами мягких тканей. Анализ этого клинического материала позволил нам выделить наиболее часто встречающиеся ошибки в диагностике и лечении, которые были допущены у 52 (43%) больных.
Результаты и обсуждение
Ошибки на этапе активного выявления больных.
Большинство таких ошибок имело место на этапе обращения больных в учреждения общей лечебной сети. Это может быть обусловлено рядом объективных причин. Относительная редкость заболевания обусловливает отсутствие достаточного опыта в диагностике сарком мягких тканей врачами поликлинического звена здравоохранения. Большинство больных саркомами мягких тканей впервые обращаются к травматологам, хирургам, терапевтам, педиатрам, неврологам и врачам других специальностей, которые назначают перечисленные выше варианты лечения. Проходит много времени, прежде чем больного направляют к онкологу. Приводим клиническое наблюдение.
Больная Б.,
21 года, поступила в отделение онкологической ортопедии МНИОИ им. П.А. Герцена в октябре 2007 г. В марте 2007 г. отметила появление болей в правой подвздошной области с иррадиацией в правую половину паховой области и в правое бедро, к врачу не обращалась. В дальнейшем болевой синдром усиливался, помимо этого, пациентка обратила внимание на уменьшение объема тканей правого бедра (атрофия мышц), слабость в правой нижней конечности. Обратилась к врачам по месту жительства в мае 2007 г. По данным рентгенологического исследования поясничного отдела позвоночника установлен диагноз: остеохондроз с выраженной корешковой неврологической симптоматикой. Направлена в городскую больницу, где проводилось консервативное лечение (массаж, противовоспалительная, обезболивающая терапия) без эффекта. В дальнейшем направлена на лечение во Всероссийский миастенический центр, где по поводу изолированной миастении мышц правого бедра проводились лечение глюкокортикостероидами и электростимуляция мышц без эффекта. В связи с ухудшением состояния и резким нарастанием болевого синдрома, прогрессированием правого нижнего монопареза в сентябре 2007 г. выполнено компьютерное томографическое исследование поясничного отдела позвоночника и брюшной полости, заподозрена опухоль мягких тканей правой подвздошной области. Больная направлена в МНИОИ, где при обследовании по данным ультразвукового исследования брюшной полости и магнитно-резонансной томографии установлено, что всю правую подвздошную область занимает объемное образование размером 10,5×9,8 см, протяженностью 12,6 см, неоднородное по структуре, с бугристыми контурами. Верхняя граница новообразования на уровне L3, опухоль распространяется на паранефральную клетчатку, пролабирует в полость малого таза. Выполнена открытая биопсия опухоли. Морфологическое заключение: злокачественная параганглиома. После установления диагноза и определения степени распространенности процесса начато специальное лечение.
Диагностические ошибки.
К объективным причинам диагностических ошибок следует отнести трудности правильного распознавания процесса, обусловленные тем, что на ранних стадиях клинические симптомы имеют сходство с проявлениями других заболеваний опорно-двигательного аппарата (как в предыдущем примере).
Недооценка жалоб больного и трактовка симптомов заболевания как не относящихся к опухоли являются наиболее частой ошибкой. Дезориентирует врача стремление пациента связать заболевание с травмой или другой ранее перенесенной болезнью. По указанным причинам в большинстве наблюдений недооцениваются и клинические признаки, которые трактуют как воспалительные или посттравматические изменения. Так, на основании анамнестических данных и анализа медицинской документации установлено, что наиболее частыми направительными диагнозами из лечебных учреждений общей лечебной сети в специализированные (онкологические) диспансеры и больницы были абсцесс мягких тканей (45%), посттравматическая гематома (35%), миозит (12%).
К диагностическим ошибкам следует отнести неадекватное выполнение онкологического поиска, направленного на выявление отдаленных метастазов, так как диссеминация опухоли является одним из наиболее неблагоприятных прогностических факторов и кардинально меняет тактику лечения больного. Так, по данным МНИОИ им. П.А. Герцена, приблизительно у 30% больных имело место недостаточное обследование и занижение стадии исходного опухолевого процесса. Это наглядно иллюстрируется следующим клиническим примером.
Больная В.,
25 лет, поступила в отделение онкологической ортопедии МНИОИ им. П.А. Герцена в июне 2006 г. В мае отметила появление быстро растущего объемного образования в области верхней трети правого бедра. Обратилась в поликлинику по месту жительства. После проведения аспирационной биопсии диагностировано злокачественное новообразование мягких тканей. Без выполнения дополнительных методов исследования (УЗИ, КТ, МРТ, рентгенографии органов грудной клетки, гистологической верификации) рекомендовано хирургическое лечение, от которого пациентка воздержалась и самостоятельно обратилась в МНИОИ им. П.А. Герцена. В клинике после открытой биопсии установлен гистологический диагноз: низкодифференцированная рабдомиосаркома. При полном диагностическом обследовании, помимо местного процесса, выявлены множественные метастазы в легких. В связи с этим больной в условиях МНИОИ им. П.А. Герцена проведены комплексное лечение: пред- и послеоперационная многокурсовая полихимиотерапия с подтвержденным клиническим и морфологическим эффектом, оперативное удаление опухоли правой нижней конечности и послеоперационная лучевая терапия суммарной очаговой дозой 60 Гр. Далее выполнена торакоскопическая атипичная резекция правого легкого по поводу оставшихся метастазов. Лечение закончено в сентябре 2008 г. В настоящее время пациентка находится под динамическим наблюдением. Данных, свидетельствующих о рецидиве и прогрессировании заболевания, нет.
Стадия процесса определяет тактику лечения и должна быть установлена до начала специальной терапии. Без выявления морфологической принадлежности и степени злокачественности опухоли стадирование невозможно. Определение гистологического типа саркомы мягких тканей является одним из самых сложных разделов современной онкологии. Иммуногистохимические и морфогенетические исследования помогают в решении этих задач, но большинство онкологических диспансеров и больниц не проводят эти исследования или не имеют такой возможности, а редкость заболевания и многообразие форм не позволяют морфологу иметь достаточный опыт в правильной трактовке результатов исследования. Так, по данным отделения патоморфологии МНИОИ им. П.А. Герцена, у 30% больных саркомами мягких тканей при пересмотре гистологических препаратов диагноз и стадия меняются, а в большинстве заключений из других учреждений не указывается степень злокачественности опухоли, чем объясняется неадекватный подход к лечению. Это подтверждается следующим клиническим примером.
Больной К.,
37 лет, поступил в отделение онкологической ортопедии МНИОИ им. П.А. Герцена в феврале 2009 г. В ноябре 2008 г. отметил появление опухолевого образования в лопаточной области. Обратился в онкологический диспансер по месту жительства. По данным комплексного обследования (УЗИ, КТ) выявлено новообразование, располагающееся в толще мышц лопаточной области, размером 8×7×6 см. После проведения открытой биопсии диагностирована липосаркома без уточнения гистологического типа и степени дифференцировки опухоли. В декабре 2008 г. произведено удаление опухоли мягких тканей. Морфологическое исследование операционного материала подтвердило диагноз миксоидной липосаркомы. Через 3 нед после операции больной отметил появление узла в области послеоперационного рубца. В январе 2009 г. выполнено повторное удаление образования с иссечением послеоперационного рубца. Морфологическое исследование: миксоидная липосаркома. В начале февраля 2009 г. в связи с продолженным ростом опухоли самостоятельно обратился в МНИОИ им. П.А. Герцена. На основании данных обследования (УЗИ, КТ, МРТ), аспирационной биопсии опухоли и пересмотра морфологических блоков предыдущих операций диагностирован продолженный рост липосаркомы высокой степени злокачественности (G3). С учетом анамнеза, клинической картины и степени дифференцировки опухоли пациенту начато специальное лечение. После проведения 3 курсов полихимиотерапии отмечен регресс опухолевого узла на 30%. В мае 2009 г. произведено удаление опухоли с сеансом интраоперационной лучевой терапии РОД 15 Гр. Морфологическое исследование операционного материала: липосаркома G3 с явлениями лечебного патоморфоза III степени. На консилиуме с участием радиолога, химиотерапевта и хирурга-онколога с учетом клинического течения заболевания, а также проведенного комбинированного лечения по радикальной программе рекомендовано оставить пациента под динамическим наблюдением. В настоящее время данных, свидетельствующих о рецидиве и прогрессировании заболевания, нет.
Таким образом, при наличии у больных сарком мягких тканей необходимо выполнение детального диагностического обследования. Это позволяет определить стадию процесса и степень распространенности заболевания, планировать тактику и объем предстоящей терапии.
Лечебно-тактические ошибки.
Анализ лечебно-тактических ошибок показывает прямую взаимосвязь неправильной или неполной диагностики, недооценки данных объективных обследований или их полное отсутствие. Также сказывается недостаток знаний основных особенностей течения опухолевого процесса, современных подходов и последовательности применения специальных методов (с учетом биологических свойств сарком мягких тканей) в лечении этой категории больных.
Так, по данным МНИОИ им. П.А. Герцена, 60% больных поступают на лечение в профильное учреждение с продолженным ростом опухоли после неадекватного лечения, проведенного по месту жительства. Это в значительной мере обусловлено тем, что врачи, удаляя первичную опухоль, не учитывают клинико-морфологические особенности сарком мягких тканей, к которым относятся: отсутствие истинной капсулы, склонность к инфильтративному росту, мультицентричность зачатков опухоли, нарушение межклеточных связей. А выполнение хирургического вмешательства в объеме экстракапсулярного удаления («вылущивание») опухоли без соблюдения основных принципов онкологии (абластика, футлярность, блочность и зональность) в еще большей степени увеличивает процент как местного рецидива, так и диссеминации процесса и, как следствие, ухудшает прогноз течения заболевания. При этом интервалы между рецидивами уменьшаются, а опухоль приобретает черты большего атипизма и агрессивного течения [4, 9, 11, 12]. Это хорошо иллюстрирует следующее наблюдение.
Больному И.,
52 лет, в 2007 г. по поводу опухоли мягких тканей левой локтевой области по месту жительства в районной клинической больнице под местной анестезией проведено ее иссечение. Морфологическое заключение: фибросаркома G1. В 2008 г. по поводу рецидива по месту жительства повторно проведено хирургическое лечение. Через 3 мес после операции диагностирован продолженный рост. Больной направлен в МНИОИ им. П.А. Герцена. Пересмотр морфологических препаратов подтвердил наличие фибросаркомы. При сравнении представленного операционного материала отмечено увеличение количества митозов и клеточного полиморфизма опухоли после проведения хирургического лечения по поводу рецидива новообразования. При этом в обоих случаях опухоли были удалены в пределах их капсулы («нерадикально»). При обследовании в клинике подтвержден продолженный рост фибросаркомы в области послеоперационного рубца, кроме того, выявлено 12 опухолевых образований в мягких тканях нижней и средней трети плеча и предплечья размером до 15 мм.
Адекватное хирургическое удаление сарком мягких тканей подразумевает соблюдение перечисленных выше принципов. После удаления опухоли могут возникать обширные дефекты, требующие выполнения реконструктивно-пластических операций, которыми владеют лишь хирурги-онкологи, постоянно занимающиеся этой проблемой [3].
Больная М.,
30 лет, поступила в отделение онкологической ортопедии МНИОИ им. П.А. Герцена в феврале 2009 г. В ноябре 2008 г. отметила появление образования в правой подколенной ямке. Обратилась в клинику по месту жительства. С диагнозом опухоли мягких тканей подколенной области больная направлена в областной онкологический диспансер. В январе 2009 г. выполнено удаление образования (при описываемом диаметре опухоли 5 см, послеоперационный рубец имел протяженность 7 см и был поперечным). Морфологическое исследование: умеренно дифференцированная саркома. Врачами принято решение: «с учетом гистологического заключения и радикального объема оперативного вмешательства оставить пациентку под динамическим наблюдением». В марте 2009 г. больная отметила повторный рост новообразования в области послеоперационного рубца. Обратилась в МНИОИ им. П.А. Герцена. Выполнена пункционная биопсия и пересмотрены блоки морфологических препаратов операционного материала. Диагностирован продолженный рост низкодифференцированной синовиальной саркомы, а также выявлены единичные метастазы в правом легком. Начато комбинированное лечение в условиях клиники. На фоне проведения 8 курсов химиотерапии по схеме VAC отмечена положительная нарастающая динамика во время всего периода лекарственного лечения в виде регресса рецидивного опухолевого узла на 50%, а также стабильная клиническая картина метастазов в легких. На консилиуме с участием химиотерапевта, радиолога и хирурга-онколога принято решение о выполнении хирургического симультанного удаления всех опухолевых очагов. В сентябре 2009 г. произведено удаление опухоли правой подколенной области с пластикой дефекта мягких тканей перемещенной медиальной порцией икроножной мышцы и торакоскопическая атипичная резекция нижней и средней долей правого легкого. Морфологическое исследование операционного материала: синовиальная саркома G3 с явлениями лечебного патоморфоза III степени. В тканях легкого метастазы злокачественной опухоли идентичного строения со слабовыраженными явлениями патоморфоза I-II степени. Пациентка повторно обсуждена на консилиуме, с учетом клинического течения заболевания, а также проведенного лечения рекомендовано продолжение химиотерапии в количестве 6 курсов с коррекцией схемы (IE — этопозид, ифосфамид). В настоящее время данных о рецидиве и прогрессировании заболевания нет.
В этом клиническом наблюдении допущено несколько диагностических и тактических ошибок. Неадекватное удаление первичной опухоли (несоответствие размеров и расположения послеоперационного рубца объему образования) и недиагностированный гистологический тип саркомы, а также неправильно определенная степень злокачественности опухоли явились причиной ряда последовательных ошибок в лечении больной.
Как видно, игнорирование современных подходов в диагностике и лечении больных с саркомами мягких тканей неизбежно приводит к выбору неадекватной тактики лечения, ухудшая прогноз течения основного заболевания, усложняя и удорожая лечение.
Еще одной грубейшей тактической ошибкой является выполнение операции по поводу какого-либо новообразования мягких тканей без последующего планового морфологического исследования удаленного материала.
Лечебно-методические ошибки.
Большинство ошибок методического характера при саркомах мягких тканей заключается в несоблюдении сроков начала и интервалов лечения. Так, в среднем продолжительность периода между окончанием предоперационной терапии (химиотерапия, лучевое лечение) и операцией не должна превышать 14-28 дней, удлинение этого периода до 5 нед и более приводит к возобновлению роста опухоли и увеличению ее злокачественного потенциала.
Ошибки возникают и в дозировках применяемых лекарственных препаратов при лечении сарком мягких тканей. Как правило, преднамеренное занижение рекомендуемых доз химиопрепаратов с целью уменьшения возможного риска осложнений и побочных гастроинтестинальных проявлений (тошнота, рвота, диарея) приводит к отсутствию эффекта от лечения и развитию резистентности (нечувствительности) опухоли к химиотерапии. По данным МНИОИ им. П.А. Герцена, у 15% больных саркомами мягких тканей, обратившихся по поводу прогрессирования заболевания, имело место занижение дозы лекарственных препаратов на 30%, а у ряда пациентов — на 60%. Несоблюдение интервалов между курсами полихимиотерапии, неадекватные дозы химиопрепаратов, продолжение лечения по прежним схемам при отрицательной динамике являются причинами дальнейшего прогрессирования опухолевого процесса, ухудшая и без того неблагоприятный прогноз течения заболевания. Приводим клиническое наблюдение.
Больная К.,
36 лет, поступила в отделение онкологической ортопедии МНИОИ им. П.А. Герцена в марте 2008 г. В августе 2007 г. по месту жительства диагностирована синовиальная саркома G3 мягких тканей левого бедра. Больная направлена в областной онкологический диспансер. При обследовании подтверждено наличие злокачественной опухоли размером 50×74×24 мм в мягких тканях левой нижней конечности. По данным компьютерной томографии выявлено множественное метастатическое поражение легочной ткани, диаметр метастазов от 3 до 7 мм. Начато специальное лечение. С октября 2007 г. по февраль 2008 г. было проведено 4 курса полихимиотерапии по схеме VAC. При этом интервалы между курсами беспричинно варьировали от 24 до 38 дней, а суммарные курсовые дозы вводимых препаратов с учетом ростовесовых показателей (S=1,8 м2), по данным официальной медицинской документации (выписной эпикриз из истории болезни), были следующими: доксорубицин 50 мг, винкристин 2 мг, циклофосфан 1000 мг. На фоне проведения химиотерапии отмечена отрицательная динамика в виде дальнейшего роста опухоли. Больная направлена в МНИОИ им. П.А. Герцена. При обследовании в поликлинике института по данным УЗИ, МРТ и КТ у пациентки в мягких тканях левого плеча по заднелатеральной поверхности определяется несколько опухолевых узлов, сливающихся между собой, общим размером 105×90×38 мм. В легких диаметр определявшихся метастатических очагов увеличился до 15-22 мм.
Необходимо отметить, что основными действующими специальными химиотерапевтическими агентами в лечении сарком мягких тканей, даже при назначении их в монорежиме, являются препараты антрациклинового ряда, которые дают достоверно выраженный эффект при максимально допустимых терапевтических дозах. По нашим расчетам, минимальная суммарная курсовая доза доксорубицина в схеме VAC для этой больной должна была составлять не менее 90 мг. В данной ситуации на первом этапе с целью циторедукции лечение целесообразнее было начать с хирургического, для достижения локального контроля дополнив его интраоперационной лучевой терапией. Через 10-14 дней после операции подключить системную химиотерапию.
Еще одной распространенной ошибкой является окончание лечения после удаления опухоли. Отсутствие опухолевого узла и возможное достижение локального контроля не исключают наличия микрометастазов и локорегиональных зачатков. Даже при соблюдении всех принципов адекватного удаления опухоли частота местного рецидивирования достигает 10-20% [9, 12]. В ряде наблюдений это диктует необходимость проведения послеоперационной терапии. При планировании этого лечения на первое место выходит плановое морфологическое исследование удаленного материала, которое должно ответить на ряд принципиальных вопросов: определение достоверной степени злокачественности опухоли (индекс G), состояние края резекции после хирургического лечения (индекс R) и оценка степени лечебного патоморфоза. На основании анализа этих данных коллегиально вырабатываются тактика и методические аспекты необходимой дополнительной терапии (химиотерапия, лучевая терапия, повторное хирургическое вмешательство).
Таким образом, кажущаяся простота и доступность для хирургического лечения (особенно небольших опухолевых образований) без предварительного, тщательного обследования, точной диагностики и стадирования процесса, незнание принципов онкологической хирургии сарком мягких тканей, нарушение последовательности и этапности лечения приводят к прогрессированию течения заболевания и ухудшению прогноза. Высокая частота ошибок, связанных с редкостью заболевания, отсутствием опыта, сложностью в диагностике, выработке адекватной тактики лечения и допустимых не только в лечебной сети, но и в региональных онкологических учреждениях, диктует необходимость концентрации этих больных в учреждениях, целенаправленно, а не эпизодически занимающихся лечением больных саркомами мягких тканей.
В Российской Федерации создана Восточно-Европейская группа по изучению сарком костей и мягких тканей. Проводимая аналитическая, клиническая и консультативная работа должна определить приоритетные варианты в решении существующих проблем практической онкологии.