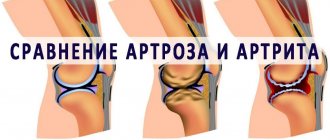
Причины развития аутоиммунных заболеваний
Причинами развития аутоиммунных заболеваний становятся:
- Инфицирование микроорганизмом, антигенные детерминанты (эпитопы) важнейших белков которого напоминают антигенные детерминанты нормальных тканей организма хозяина. По такому механизму развивается аутоиммунный гломерулонефрит после стрептококковой инфекции или аутоиммунные реактивные артриты после гонореи.
- Деструкция или некроз тканей или изменение их антигенной структуры, так что измененная ткань становится иммуногенной для организма хозяина. По такому механизму развивается аутоиммунный хронический активный гепатит после перенесенного гепатита В.
- Нарушение целостности тканевых (гистогематических) барьеров, в норме отделяющих некоторые органы и ткани от крови и соответственно от иммунной агрессии лимфоцитов хозяина. При этом, поскольку в норме антигены этих тканей в кровь вообще не попадают, тимус не производит уничтожения аутоагрессивных лимфоцитов против этих тканей. По такому механизму развивается аутоиммунный тиреоидит.
- Гипериммунное состояние (патологически усиленный иммунитет) или иммунологический дисбаланс с нарушением «селекторной», подавляющей аутоиммунитет, функции тимуса или снижением активности Т-супрессорной субпопуляции клеток.
Механизм развития многих аутоиммунных заболеваний (системной склеродермии, узелкового периартериита, приобретенной гемолитической анемии и др.) не выяснен. Большинство их развивается по типу аллергических реакций замедленного типа с участием иммунных лимфоцитов. При аутоиммунных поражениях крови первостепенное значение имеют циркулирующие в крови антитела.
В качестве аутоантигенов могут вступать белки, нуклеиновые кислоты, фосфолипиды, сахара, сами иммуноглобулины (ревматоидный фактор — это аутоантитела к IgG). Находящиеся в крови в норме в небольшом количестве естественные аутоантитела, обычно IgM-класса, не вызывают патологических процессов, а стимулируют регенерацию тканей.
Аутоиммунные заболевания можно разделить на:
- Органоспецифические (с поражением щитовидной железы, надпочечников, желудка, поджелудочной железы — тиреоидит Хасимото (Хашимото), первичная микседема, тиреотоксикоз, пернициозная анемия, болезнь Аддисона, сахарный диабет I типа и др.).
- Органонеспецифические (с поражением кожи, почек, суставов, мышц — дерматомиозит, системная красная волчанка, склеродермия, ревматоидный артрит и др.).
Обнаружение в сыворотке крови различных аутоантител имеет порой решающее диагностическое значение для подтверждения того или иного заболевания, тесно связано с активностью болезни или может определять прогноз. Применяемые лабораторные тесты являются важным инструментом при выборе метода лечения и мониторинга эффективности проводимой терапии.
Прогностическое значение имеет изменение уровня аутоантител как в сторону повышения титров, так и их снижения. Большинство аутоантител не являются специфичными для какого-либо заболевания, они обнаруживаются в различных комбинациях.
«Существует два направления, по которым может развиваться патология иммунной системы:
- Иммунодефицит – неспособность одного или нескольких компонентов иммунной системы реагировать на патоген по защитному механизму
- Аутоиммунное заболевание – ошибочное реагирование на структуры организма-хозяина, или, можно сказать, утрата к ним иммунной толерантности
Традиционно аутоиммунные болезни считаются редкими и, согласно эпидемиологическим исследованиям, встречаются у 3-5% людей, при этом самыми распространенными из них являются хронический аутоиммунный тиреоидит (цель – щитовидная железа) и сахарный диабет 1-го типа. Существует приблизительно 100 различных аутоиммунных заболеваний, как локально поражающих орган-мишень (например, аутоиммунный гепатит), так и носящих системный характер с множественными поражениями (типичный вариант – системная красная волчанка). Описано однозначное повышение рисков развития аутоиммунных заболеваний при наличии таковых у родственников первой линии, а также у монозиготных близнецов. В целом практически все подобные болезни чаще встречаются у женщин (в соотношении от 1:1 до 10:1) , за исключением одного из воспалительных заболеваний кишечника – болезни Крона, которая распространена у мужчин примерно в 1,2 раза больше. Данные также меняются в зависимости от географического региона. Так, аутоиммунное заболевание центральной нервной системы – рассеянный склероз – в десятки раз чаще регистрируется в Азии, чем в Европе, а сахарный диабет 1-го типа наиболее распространен в США и практически не отмечается в Китае.
До настоящего времени причинный фактор возникновения аутоиммунных заболеваний известен лишь в единичных случаях. Наиболее активно обсуждается роль кишечной микробиоты, инфекционных агентов, продуктов горения табака, лекарственных препаратов, гормонов, воздействия ультрафиолета, тяжелых металлов и коллагеновых/силиконовых имплантов. Классическим примером является давно известный феномен молекулярной мимикрии (подражания антигенной структуре собственного компонента клетки) М-белка пиогенного стрептококка (частого возбудителя острого тонзиллита) и «человеческих» лизоганглиозида и миозина, в результате чего происходит появление кардиотоксичных Т-лимфоцитов.
На сегодняшний день, несмотря на то, что для большинства аутоиммунных заболеваний ключевой триггерный причинный фактор не установлен, мы знаем, за счет каких именно звеньев иммунной системы реализуется механизм прогрессирования атаки иммунитета против собственного организма (патогенез). В основном в этом процессе задействован не какой-то отдельно взятый компонент иммунной системы, а группа таких компонентов, причем для каждой конкретной болезни (или хотя бы «подкласса» болезней) механизм может отличаться. Этот аспект определяет исключительную значимость корректной верификации диагноза на максимально возможно раннем этапе. По крайней мере, необходимо понять, какой общий характер патогенеза лежит в основе совокупности симптомов пациента, и начать универсальное лечение, действующее на ключевые «точки» механизма заболевания.
Процесс подтверждения диагноза аутоиммунного заболевания в современных реалиях представляет собой оценку наличия у пациента комбинации клинических симптомов, лабораторных сдвигов (в том числе определение аутоиммунных антител различных типов), сопоставление их с данными морфологического исследования биопсийного материала (важнейший диагностический шаг при многих аутоиммунных клинических ситуациях) и с результатами проводимого пробного лечения, если таковое имело место. Далее происходит сопоставление этой комплексной информации с наборами диагностических критериев, которые разработаны экспертными сообществами практически для каждого заболевания, и если количество необходимых критериев набирается, это позволяет подтвердить (верифицировать) точный диагноз. Верификация диагноза, в свою очередь, уже делает возможным применение терапии, которая воздействует прицельно на некорректно функционирующие звенья иммунной системы.
В последние десятилетия, благодаря успехам фармакологии в лечении аутоиммунных заболеваний, без лишнего преувеличения можно утверждать о прорыве, связанном с появлением так называемых генно-инженерных биологических препаратов. В отличие от традиционных синтетических лекарственных средств, такие препараты представляют собой биологические субстанции (в основном – тоже антитела), целью которых становится «точечное» блокирование именно тех компонентов иммунитета, которые наиболее задействованы в механизме развития того или иного заболевания. Тем самым, во-первых, не происходит «выключения» сразу нескольких линий иммунной защиты и обеспечивается высокая эффективность лечения при значительно меньшей частоте специфических и неспецифических нежелательных явлений, хотя, безусловно, в виде нюансов они присутствуют и для таких лекарственных агентов. Стоит также отметить, что в настоящее время генно-инженерная биологическая терапия с успехом используется и в онкологии, онкогематологии, аллергологии, кардиологии, и даже в лечении инфекционных заболеваний (здесь, собственно, следует упомянуть эффективные подходы к блокированию цитокинового шторма при тяжелом течении коронавирусной инфекции с помощью антител к интерлейкину-6 – одному из основных медиаторов иммунитета, запускающему системное воспаление).
Резюмируя, следует сказать, что аутоиммунные заболевания остаются одной из самых сложных областей медицины внутренних болезней, и работа с ними требует от врача исключительного внимания к индивидуальности каждого пациента, тщательного анализа и синтеза диагностической концепции, применения принципов доказательной медицины и глубоких фактических знаний, постоянно обновляемых терапевтических подходов к лечению таких болезней».
Основные системные и «локализованные» аутоиммунные заболевания
- Сосуды и система крови: локальные лейкоцитокластические васкулиты, идиопатическая тромбоцитопеническая пурпура, антифосфолипидный синдром
- Кожа: псориаз, витилиго, пузырчатка
- Поджелудочная железа: сахарный диабет 1-го типа, аутоиммунный панкреатит
- Нервная система: острый рассеянный энцефаломиелит, острая и хроническая воспалительная демиелинизирующая полинейропатия, рассеянный склероз, миастении
- Щитовидная и паращитовидные железы: болезнь Грейвса, аутоиммунный гипопаратиреоз, аутоиммунный тиреоидит Хашимото
- Орган слуха: аутоиммунная болезнь внутреннего уха
- Сердце: ревматическая лихорадка
- Печень: аутоиммунный гепатит, первичный склерозирующий холангит, первичный билиарный холангит (первичный билиарный цирроз)
- Желудочно-кишечный тракт: язвенный колит, болезнь Крона, целиакия, аутоиммунный атрофический гастрит
- Надпочечники: болезнь Аддисона
- Репродуктивная система: аутоиммунный орхит и оофорит
- Соединительная ткань и суставы: ревматоидный артрит, системная красная волчанка, болезнь Шегрена, системная склеродермия, смешанные заболевания соединительной ткани, анкилозирующий спондилит, псориатический артрит, дермато- и полимиозит
Ревматические заболевания
К ревматическим заболеваниям соединительной ткани относят:
- системную красную волчанку (СКВ)
- системную склеродермию
- синдром Шегрена
- смешанное заболевание соединительной ткани
- полимиозит (миозит) или дерматомиозит
- ревматоидный артрит (РА)
- миастения Гравис
- рассеянный склероз (РС)
- иногда антифосфолипидный синдром и узелковый периартериит, хотя в большинстве последних публикаций это заболевание «открывает» группу системных васкулитов
Лабораторная диагностика ревматических заболеваний
Лабораторная диагностика ревматических заболеваний включает определение:
- аутоантител
- иммуноглобулинов
- циркулирующих иммунных комплексов
- компонентов системы комплемента
- белков острой фазы воспаления
- показателей дисфункции/повреждения эндотелия
- генетических маркеров
- маркеров костного метаболизма
Ревматоидный фактор (РФ)
Ревматоидный фактор (РФ) — это антитела против Fc-фрагмента IgG. Чаще эти антитела относятся к IgM, но встречаются и IgG-, IgA-, IgE-антитела. Ревматоидный фактор (РФ) имеют 75-80% больных ревматоидным артритом, его также обнаруживают при синдроме Шегрена, склеродермии, дерматомиозите, гиперглобулинемиях, В-клеточных лимфопролиферативных заболеваниях. Наличие ревматоидного фактора считается важным прогностическим признаком быстропрогрессирующего деструктивного поражения суставов и системных проявлений при ревматоидном артрите.
Антитела к циклическому цитруллинированному пептиду (анти-ССР)
Антитела к циклическому цитруллинированному пептиду (анти-ССР) относятся к гетерогенной группе аутоантител, которые распознают антигенные детерминанты филагрина и других белков, содержащих атипичную аминокислоту цитруллин. Эти антитела присутствуют в 79% сывороток от больных ревматоидным артритом. Анти-ССР обнаруживаются на очень ранней стадии РА. Кроме того, тест позволяет дифференцировать эрозивную (анти-ССР-положительные пациенты) и неэрозивную (анти-ССР-отрицательные пациенты) формы РА.
Антитела к модифицированному цитруллинированному виментину (anti-MCV)
Виментин является белком цитоскелета различных типов клеток, таких, как клетки мезенхимы и эндотелия, фибробласты, хондроциты и остеоциты. Он используется в качестве маркера опухолей мягких тканей. Виментин синтезируется и модифицируется макрофагами под регуляцией провоспалительных и противовоспалительных цитокинов и встречается в синовиальной жидкости пациентов с ревматоидным артритом. Около половины РФ-негативных пациентов выявляются с помощью анти-MCV.
Циркулирующие иммунные комплексы (ЦИК)
Формирование циркулирующих иммунных комплексов (ЦИК) представляет собой физиологический механизм защиты, приводящий к быстрому устранению через ретикулоэндотелиальную систему либо эндогенных, либо экзогенных антигенов (микроорганизмов, вирусов, паразитов, растительных антигенов, антигенов грибов, пыльцы или пищевых продуктов).
Высокий уровень циркулирующих иммунных комплексов (ЦИК) в сыворотке и/или в других биологических жидкостях наблюдается при многих воспалительных и злокачественных заболеваниях, что может стать причиной развития патологии.
Определение циркулирующих иммунных комплексов (ЦИК) в сыворотке — это важный маркер для оценки активности заболевания, особенно при аутоиммунных болезнях.
Частота нахождения антител (%) при аутоиммунных заболеваниях
Заболевание | анти-дсДНК | анти-осДНК | анти-гистон | анти-SS-A (Ro) | анти-SS-B (LA) |
| Системная красная волчанка (СКВ) | >90 | >90 | 30-50 | 10-30 | 30-50 |
| Лекарственная красная волчанка (ЛКВ) | — | 30-50 | 50-90 | — | — |
| Синдром Шарпа / смешанные заболевания соединительной ткани | 10-30 | 10-30 | — | — | — |
| Ревматоидный артрит | — | 30-50 | 30-50 | 10-30 | — |
| Синдром Шегрена | 10-30 | 10-30 | — | >90 | >90 |
| Склеродермия | 10-30 | 10-30 | — | 10-30 | — |
| Светочувствительные дерматиты, дерматомиозиты | 10-30 | 10-30 | — | — | — |
Заболевание | анти-Sm | анти-RNP/Sm | анти-Scl-70 | анти-Jo-1 |
| Системная красная волчанка (СКВ) | 10-30 | 10-30 | — | — |
| Лекарственная красная волчанка (ЛКВ) | — | — | — | — |
| Синдром Шарпа / смешанные заболевания соединительной ткани | — | >90 | — | — |
| Ревматоидный артрит | — | — | — | — |
| Синдром Шегрена | — | — | — | — |
| Склеродермия | — | — | >90 | — |
| Светочувствительные дерматиты, дерматомиозиты | — | — | — | 50-90 |
Новые алгоритмы диагностики аутоиммунных поражений позвоночника и суставов
Серонегативные спондилоартриты или спондилоартропатии (ССА) — это группа взаимосвязанных между собой воспалительных заболеваний, имеющих сходные клинические признаки, как и общие факторы генетической предрасположенности. В эту группу входят анкилозирующий спондилит (АС) (болезнь Бехтерева, болезнь Мари—Штрюмпелля), спондилоартрит, ассоциированный с неспецифическим язвенным колитом, или болезнью Крона, реактивный артрит, связанный с кишечной или урогенитальной инфекцией, псориатический артрит, ювенильный спондилоартрит, «недифференцированный спондилоартрит», а также, вероятно, болезнь Бехчета и болезнь Уиппла. АС был описан в конце XVII века, хотя есть основания полагать, что его посмертные признаки присутствуют в некоторых египетских мумиях.
Симптомы обозначаются годами
Дифференциальная диагностика ССА на ранних стадиях возможна далеко не всегда. Это связано с медленным прогрессированием процесса и постепенным, иногда на протяжении нескольких лет, манифестированием симптомов. Исторически ССА дифференцируют прежде всего с ревматоидным артритом (РА). В отличие от последнего все они характеризуются сакроилеитом с развитием боли в спине, асимметричным периферическим артритом, отсутствием ревматоидного фактора, подкожных узелков, энтезитами (воспалением в местах прикрепления связок или сухожилий к костям), а также внесуставными проявлениями в виде воспалительных поражений глаз, сердца, легких и кожи.
Энтезит при ССА, особенно в месте прикрепления ахиллова сухожилия к пяточной кости, считается столь же патогномоничным ранним симптомом, как и синовит при РА. Давно описаны факты семейной предрасположенности к ССА, а также ассоциация ССА с антигеном HLA-B27. Сходство клинической картины и генетическая предрасположенность позволяют предположить общность патогенеза всей этой группы болезней.
Встречаемость АС в общей популяции составляет 0,3—0,8%, тогда как общая встречаемость ССА сопоставима с встречаемостью ревматоидного артрита. Так же, как и РА, серонегативные артриты характеризуются суставными и внесуставными проявлениями. Распознавание поражений опорно-двигательного аппарата является наиболее важным в клинической практике.
Самый распространенный признак — боль в спине
Боль в спине — самый распространенный симптом ССА. В отличие от дегенеративно-дистрофических поражений позвоночника боль при ССА не бывает острой, возникает в утренние часы, прогрессирует исподволь, сопровождается утренней скованностью не менее 30 минут, иррадиирует в обе ягодицы. Эти симптомы уменьшаются после умеренной физической нагрузки. При манифестации заболевания они могут сопровождаться лихорадкой и потерей веса.
Современные критерии боли при ССА включают в себя: 1) сопутствующую утреннюю скованность более 30 мин; 2) улучшение самочувствия после физических упражнений, но не после отдыха; 3) ночные боли в спине; 3) перемежающие боли в ягодицах.
Заболевание начинается с пояснично-крестцового отдела позвоночника, распространяясь на другие его отделы. Поражение связок и суставов патогномонично для ССА и встречается у 30—50% больных. Энтезит — воспаление в местах прикрепления сухожилий, связок, капсулы сустава к костям, часто начинается с эрозий и заканчивается оссификацией связок. Наиболее типичная локализация энтезитов при ССА — прикрепление ахиллова сухожилия к пяточной кости, прикрепление подошвенной фасции к пяточной кости или к головкам плюсневых костей, основание пятой плюсневой кости. «Тuberositas tibiae» — бугристость большеберцовой кости, места прикрепления связок к верхнему и нижнему полюсу надколенника, область седалищного бугра, а также реберные хрящи, надмыщелки локтевой кости.
Энтезиты могут сопровождаться достаточно интенсивной болью в месте воспаления, особенно по утрам, после подъема с постели. Для ССА также характерны артриты крупных суставов — тазобедренных, коленных, акромиально-ключичного и на первом месте — крестцово-подвздошного сочленения.
Назрела необходимость в новых алгоритмах
В случаях, когда манифестация симптомов типична, распознавание ССА не представляет трудности. В 1991 году Европейская группа по изучению ССА (ESSG) разработала критерии их дифференциальной диагностики.
Однако на ранних стадиях развития болезни с анамнезом 1 год и менее чувствительность этих критериев оставляет желать лучшего.
В связи с тем, что в последние годы в практику лечения ССА (как и других аутоиммунных болезней) внедряются иммунотропные биопрепараты, в первую очередь ингибиторы фактора некроза опухолей, эффективность и безопасность которых выражена именно на ранних стадиях аутоиммунного воспаления, назрела необходимость новых диагностических алгоритмов ССА, которые повышают достоверность диагностики на ранних стадиях.
В диагностике спондилоартритов (ССА) все больше внимания уделяется поиску субклинических признаков воспаления в крестцово-подвздошном сочленении, которые могут быть выявлены при магнитно-резонансной томографии, что ранее не входило в критерии диагностики ССА. Данная совокупность признаков позволяет оптимизировать диагностику ССА, что важно для своевременного раннего назначения терапии с помощью ингибиторов провоспалительных цитокинов.
В связи с этим группа экспертов Международного сообщества по оценке спондилоартритов (ASAS) в 2010 году выработала новые критерии, пригодные для использования в дебюте заболевания, а также в случае так называемого недифференцированного спондилоартрита, при котором внесуставные проявления и позитивность по антигену HLA-B27 выявляются значительно реже.
Учитывая, что дифференцирование отдельных форм ССА на ранних стадиях практически не влияет на тактику лечения, эти алгоритмы направлены на установление достоверности диагнозов ССА как таковых с подразделением их на центральную (осевую, связанную с поражением позвоночника) и периферическую формы. Алгоритмы диагностики центральной и периферической форм ССА, которые в 2010 году обсуждались на конгрессах Европейской (Рим, июнь 2010 г.) и Азиатско-Тихоокеанской (август 2010 г.) Лиг антиревматических обществ, представлены на рис. 1 и 2.
Как из них видно, в диагностике ССА все больше внимания уделяется поиску субклинических признаков воспаления в крестцово-подвздошном сочленении, которые могут быть выявлены при магнитно-резонансной томографии, что ранее не входило в критерии диагностики ССА. Данная совокупность признаков позволяет оптимизировать диагностику ССА, что важно для своевременного раннего назначения терапии с помощью ингибиторов провоспалительных цитокинов.