Магнитотерапия (16) Инфракрасная и фототерапия (10) Виброакустическая терапия (6) Лазерная терапия (4) Квантовая терапия (2) Термотерапия (3) Электрофорез и Гальванизация (5) Электростимуляция (3)
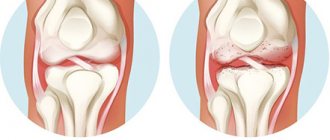
Магнитотерапия подагры помогает ослабить ее болезненные симптомы и сделать приступы менее частыми и интенсивными. При подагре нарушается обмен веществ, мочевая кислота плохо выводится из организма, а кристаллы ее солей откладываются в суставах. В результате возникает воспаление, резкая боль, в тяжелых случаях — разрушение сустава и нарушение его подвижности.
Магнитная терапия при подагре показана в сочетании с диетой и лекарственными препаратами.
Магнитотерапия подагры дает следующие результаты:
- облегчает как резкую, так и ноющую боль;
- улучшает кровоснабжение суставов;
- ускоряет утилизацию солей мочевой кислоты;
- налаживает обменные процессы в клетках;
- уменьшает воспалительную реакцию;
- способствует восстановлению разрушенных тканей.
Регулярные процедуры магнитной физиотерапии помогут остановить прогрессирование подагры, предотвратить необратимые изменения и сохранить суставы. Магнитотерапия при подагре ног уменьшит боли при ходьбе и поможет восстановить подвижность.
Аппараты для магнитотерапии универсальны и могут пригодиться для лечения разнообразных болезней. Домашние приборы разработаны специально для применения людьми без медицинского образования, они доступны и просты в управлении. Подагра — хроническое заболевание, поэтому в случае подагры удобно иметь собственный магнитотерапевтический прибор.
Аппараты для магнитотерапии подагры
[td]
Три стадии подагры
Первая стадия: Высокий уровень мочевой кислоты в крови
- Уровень мочевой кислоты в крови может быть повышен, но нет клинических проявлений.
- Высокий уровень мочевой кислоты в крови (гиперурикемия), возможно, не прогрессирует, и симптомы подагры могут не появиться вообще.
- У некоторых людей может быть первичным проявлением появление камней в почках, а не приступа подагры.
Вторая стадия: Эпизоды острого подагрического артрита чередуются с периодами без симптомов.
- Эту стадию также называют межприступной.
- Кристаллы мочевой кислоты начинают формироваться в синовиальной жидкости, как правило, в одном суставе (большой палец ноги) – и организм реагирует на это воспалительной реакцией и возникает эпизод атаки.
- И хотя наиболее часто происходит поражение большого пальца не исключено, что могут быть вовлечены и другие суставы. Хотя большой палец ноги — наиболее распространенное место для приступа подагры, подагра может развиться в других суставах .
- После того, как приступ подагры заканчивается поврежденный сустава быстро приходит в норму в течение 2-3 дней до следующего приступа (как правило, приступ обязательно повторяется в течение 1-2 лет).
- Со временем интервалы между приступами становятся короче и интенсивность симптоматики более выраженная. Кроме того, в процесс вовлекаются и другие суставы.
Третья стадия: Хроническая тофусная подагра
- Если симптомы подагры эпизодически проявляются и лечение не проводится в течение нескольких лет, то возникает хронический процесс и вовлекаются другие суставы. Между приступами исчезают интервалы. Эта стадия подагры нередко напоминает другие виды артрита (чаще остеоартрит).
- К этому времени, происходит достаточное накопление кристаллов мочевой кислоты для формирования узелков (тофусов) в различных участках тела. Тофусы, плотные на ощупь ,подвижные и располагаются под кожей. Подлежащая кожа может быть красной и истонченной (цвет тофусов может быть желтым или кремовым).
- Как правило, тофусы локализируются около локтя или около пальцев ног, рук, ушной раковины. При прогрессировании возможно развитие тофусов около суставов или в хрящевой ткани ушной раковины. Тофусы, расположенные в хрящевой ткани, могут приводить к разрушению хряща.
Симптомы
Подагра обычно развивается после многих лет накопления кристаллов мочевой кислоты в суставах и окружающих тканях. Симптомы включают:
- Повышение местной температуры, боль, набухание, и выраженная болезненность в суставе, обычно в суставе большого пальца ноги. Это классическое проявление подагры. Иногда аналогичная картина может развиваться в другом суставе, таком как лодыжка или колено.
- Возможно изменение цвета вокруг поврежденного сустава (ярко-красный или багрянистый)
- Боль, как правило, начинается в течение ночи и настолько интенсивна, что даже легкое прикосновение очень болезненно.
- Быстрое нарастание дискомфорта, в течение нескольких часов и затем постепенный регресс в течение следующих нескольких дней.
- Ограниченное движение в поврежденном суставе.
- После стихания приступа подагры кожа вокруг поврежденного сустава приходит в норму и может сохраниться зуд.
- У некоторых людей, возможно, течение подагры без приступов так называемая хроническая подагра. Хроническая подагра в старшей возрастной группе может быть не очень болезненной и часто ее путают с другими видами артритов.
- Подагра может сначала проявиться узелками (тофусы) на руках, локтях, или ушах. В таких случаях может не быть классических симптомов приступа подагры.
ОРИОН СТЕП
- Розничная цена:
16 700 руб.
Гарантия от 1 года Подробнее об условиях гарантии
Сейчас этот товар просматривают 20 человек
Сравнить аппараты Быстрый заказ В корзину
Основные характеристики
| Тип излучателя: | полупроводниковый инжекционный AsGa |
| Режим лазерного излучения: | импульсный |
| Длина волны: | 880 — 910 нм |
| Импульсная мощность лазера: | постоянная 9 Вт |
| Частота модуляции импульса: | постоянная 1 500 Гц |
| Наработка на отказ: | 2 000 часов |
| Время воздействия: | от 1 до 5 мин (электронный таймер с обратным отсчетом) |
| Встроенный фотодиод: | для визуализации и контроля излучения |
ВСЕ ХАРАКТЕРИСТИКИ
Характеристики
| Тип излучателя: | полупроводниковый инжекционный AsGa |
| Режим лазерного излучения: | импульсный |
| Длина волны: | 880 — 910 нм |
| Импульсная мощность лазера: | постоянная 9 Вт |
| Частота модуляции импульса: | постоянная 1 500 Гц |
| Наработка на отказ: | 2 000 часов |
| Время воздействия: | от 1 до 5 мин (электронный таймер с обратным отсчетом) |
| Встроенный фотодиод: | для визуализации и контроля излучения |
| Лазерная безопасность по ГОСТ Р. 50723-94: | класс 1 (высший) |
| Лазерная безопасность по САНиПИН 5804-91 (излучение безопасно для глаз): | класс 1 (высший) |
| Электробезопасность: | класс II защита BF (класс безопасности для бытовой техники) |
| Питание аппарата: | от встроенного аккумулятора, зарядка от сети 220В, 50Гц |
| Потребляемая мощность: | не более 5 Вт |
| Входное напряжение (аккумулятора): | 3 В |
| Вес аппарата: | 200 грамм |
| Габаритные размеры аппарата: | 187х60х39 мм |
| Размеры упаковки: | 240х170х80 мм |
ЛАЗЕРНАЯ ТОЧНОСТЬ ЛЕЧЕНИЯ
- Инфракрасный луч лазера проникает прямо в очаг поражения
- Останавливает процесс разрушения сустава
- Снимает воспаление, боль и отек
- Курс лечения — 10-14 дней
Смотреть подробнее
ОПТИМАЛЬНОЕ РЕШЕНИЕ
- В 2-3 раза сокращает срок выздоровления
- Не имеет возрастных ограничений
- Увеличивает периоды ремиссии
- Не вызывает эффекта привыкания
- Не вызывает аллергических реакций и побочных действий
Смотреть подробнее
КЛИНИЧЕСКИ ДОКАЗАННЫЙ ЭФФЕКТ
- Лечебный эффект — 87-93%
- Центральный военный клинический госпиталь № 2 им. П.В. Мандрыка
- ГБУЗ «Московский областной научно-исследовательский клинический институт (МОНИКИ) им. М.Ф. Владимирского»
Смотреть полный список учреждений
МАКСМИМУМ ПОКАЗАНИЙ
К лечению показано 200 заболеваний, в т.ч.:
- К лечению показано 200 заболеваний:
- Сердечно-сосудистые
- Неврологические
- Урологические
- Лор- и бронхо-легочные
- Заболевания вен и артерий
Полный перечень
СДЕЛАНО В РОССИИ
- Одобрено в Европе — Золотая медаль на выставке в Брюсселе «BRUSSELS EUREKA 97
- Рекомендован Минздравом РФ с 1993г.
- Аппарат ОРИОН разрешен Минздравом РФ с 1993 года
- Разработан по жестким стандартам советской военной промышленности. Гарантийное и постгарантийное обслуживание.
Бесплатная консультации врача
МИНИМУМ ПРОТИВОПОКАЗАНИЙ
- I класс лазерной безопасности
- Злокачественные новообразования
- Заболевания крови
- Активный туберкулез
- Лихорадочные состояния неясной этиологии
Смотреть подробнее
Диагностика
Наиболее достоверным подтверждением подагры является анализ синовиальной жидкости полученной путем артроцентеза. Но при наличии воспалительного в области сустава (покраснение, болезненность) делать пункцию не желательно. В таких случаях диагноз выставляется на основании анализа крови на мочевую кислоту
Диагноз подагры ставится на основании истории заболевания, анализа крови и мочи на мочевую кислоту.
Рентгенография информативна только в поздних стадиях подагры и необходима для дифференциальной диагностики с другими видами артрита.
Трудности при ведении больных подагрой
Для цитирования. Башкова И.Б., Мадянов И.В. Трудности при ведении больных подагрой // РМЖ. 2015. No 25. С. 1508–1514.
Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных тканях и развивающимся в связи с этим воспалением у лиц с гиперурикемией (ГУ), обусловленной факторами внешней среды и/или генетическими факторами [1]. В последние два десятилетия наблюдается устойчивый рост заболеваемости подагрой, вероятно, связанный как с характерологическими особенностями пациентов (повышение уровня жизни, изменение характера питания, излишняя алкоголизация) [2], так и с распространением в популяции метаболических заболеваний (ожирение, метаболический синдром, сахарный диабет (СД), артериальная гипертензия (АГ)), часто сопутствующих подагре [3–5]. Несмотря на успехи в диагностике, понимании патогенеза и разработке эффективных лекарственных средств для лечения подагры, ведение этой категории пациентов может представлять для интернистов определенные трудности. Диагноз «подагра» устанавливается в первый год заболевания только в 1/4 случаев, в среднем же проходит 7–8 лет до постановки правильного диагноза [1]. Причиной поздней диагностики может явиться естественное течение заболевания – чередование редких, к тому же кратковременных приступов моноартрита, с более длительными «светлыми промежутками» болезни вследствие присущего подагрическому артриту самолимитирующего характера. Другим объяснением поздней диагностики подагры может служить и то, что врачом «первого контакта» при этом заболевании нередко становится хирург или травматолог, который, видя перед собой пациента с острым, крайне болезненным артритом, направляет его на рентгеновское исследование пораженного сустава, с помощью которого диагностировать дебют подагры зачастую не представляется возможным, поскольку крупные кисты в субхондральной зоне кости (так называемый симптом «пробойника» или рентгенонегативные внутрикостные тофусы) появляются значительно позже – в среднем через 7–8 лет от момента первого приступа подагры [6, 7]. В отсутствие костно-деструктивных изменений на рентгенограммах дистального отдела стопы состояние расценивается как «ушиб мягких тканей», что обычно сопровождается рекомендациями по приему нестероидных противовоспалительных препаратов (НПВП), которые в силу своей эффективности в данной ситуации убеждают врача и пациента в правомочности неверного диагноза. В ряде случаев можно предсказать сценарий дальнейшего развития заболевания: каждый последующий приступ моноартрита пациент будет стараться купировать самостоятельно, принимая «понравившийся с первого раза» НПВП, до тех пор, пока либо не проявится неблагоприятная реакция на препарат, либо НПВП перестанут оказывать ожидаемый эффект. Среди типичных ошибок, которые допускаются врачами при ведении пациентов с острым подагрическим артритом, выделяют: назначение физиотерапевтических процедур, анальгетиков, мазей/гелей, наносимых локально в области пораженного сустава, назначение аллопуринола в момент приступа, промедление с назначением эффективной анальгетической и противовоспалительной терапии [8]. Несвоевременное и неэффективное лечение подагры способствует не только усугублению коморбидной патологии, которая свойственна этой категории больных, в частности ишемической болезни сердца (ИБС) [9], но и развитию фатальных осложнений. Приводим собственное наблюдение, когда сочетание подагры, ГУ, нарушений углеводного и липидного обменов, АГ, а также невнимательное отношение пациента к своему здоровью стали причиной летального исхода у молодого мужчины.
Больной С., 42 года,
был госпитализирован в ревматологическое отделение РКБ (Чебоксары) 29.04.2014 г. с жалобами на постоянные интенсивные боли в левом коленном, голеностопных, плюснефаланговых суставах 1-х пальцев обеих стоп, ряде проксимальных межфаланговых суставов кистей, усиливающиеся в ночное время. Из анамнеза заболевания: впервые приступ острого артрита плюснефалангового сустава 1-го пальца правой стопы развился 10 лет назад, в последующем артриты рецидивировали, суставной процесс постепенно принял полиартритический характер, наблюдалось закономерное сокращение интервалов между приступами до 2–3 мес. К врачам пациент не обращался, самостоятельно эпизодически принимал нимесулид. В 2009 г. перенес острый передне-перегородочно-верхушечный инфаркт миокарда с зубцом Q, в том же году впервые выявлена гипергликемия (уровень сахара крови натощак 13,6 ммоль/л) и ГУ (сывороточный уровень мочевой кислоты 572 мкмоль/л). Назначенные дезагрегантные (ацетилсалициловая кислота 100 мг/сут, клопидогрел 75 мг/сут), пероральные сахароснижающие (метформин 1000 мг/сут), гиполипидемические (аторвастатин 20 мг/сут), урикодепрессорные (аллопуринол 100 мг/сут) препараты, β-адреноблокаторы (бисопролол 5 мг/сут) пациент после выписки из стационара не принимал. С 2010 г. наблюдался стремительный рост тофусов с локализацией на ушных раковинах, в области суставов кистей, стоп, обострение подагрического артрита с кратностью до 5–6 р./год. В апреле 2014 г. после алкогольного эксцесса (злоупотребление алкоголем в течение 7 дней) развилось тяжелое обострение хронического подагрического артрита: боль, припухлость, локальная гиперемия и гипертермия левого коленного сустава, голеностопных, плюснефаланговых суставов 1-х пальцев стоп, ряда пястно-фаланговых и проксимальных межфаланговых суставов обеих кистей. Внутримышечное введение диклофенака по 75 мг 2 р./сут и пероральный прием нимесулида 400 мг/сут – без эффекта. В левой пяточной области рана размером 1,5×1,0 см (изъязвленный тофус) с белым творожистым отделяемым. Пациент самостоятельно обратился к хирургу, в амбулаторных условиях выявлено повышение уровня сахара крови до 27,8 ммоль/л и уровня мочевой кислоты до 686 мкмоль/л, в связи с чем пациент был направлен в ревматологический стационар 29.04.2014 г. При поступлении состояние больного тяжелое, вынужденное положение из-за болей в левом коленном суставе, дефигурация коленных (больше левого), голеностопных суставов, множественные неизъязвленные тофусы с локализацией на ушных раковинах, в области суставов кистей (рис. 1) и стоп (рис. 2), изъязвленный тофус в левой пяточной области. Периферических отеков нет. Индекс массы тела – 25,6 кг/м2. Перкуторно по всем легочным полям ясный легочный звук. В легких дыхание везикулярное, хрипов на момент осмотра нет. Границы относительной тупости сердца: правая – по правому краю грудины, верхняя – в третьем межреберье, левая – на 1,0 см кнаружи от срединно-ключичной линии. Артериальное давление (АД) – 160/100 мм рт. ст. Тоны сердца ритмичные, систолический шум по левому краю грудины. Живот мягкий, чувствительный при пальпации в правом подреберье. Печень – по краю реберной дуги. Симптом поколачивания отрицательный с обеих сторон.
В общем анализе крови: эритроциты – 4,93×1012/л, гемоглобин – 149 г/л, тромбоциты – 61×109/л, лейкоциты – 4,2×109/л, сдвиг лейкоформулы влево (юные нейтрофилы – 2%, палочкоядерные нейтрофилы – 35%), абсолютная лимфопения (0,38×109/л), СОЭ по методу Панченкова – 36 мм/ч. В общем анализе мочи: протеинурия (0,36 г/л), при микроскопии мочевого осадка выявлены: лейкоцитурия (10–12 в поле зрения), микрогематурия (6–8 эритроцитов в поле зрения), цилиндурия (гиалиновые и зернистые), ураты в большом количестве. В биохимическом анализе крови: общий билирубин – 21 мкмоль/л, АлАТ – 89 Ед/л (при верхней границе нормы до 40 Ед/л), АсАТ – 135 Ед/л (при верхней границе нормы до 40 Ед/л), мочевина – 14,4 ммоль/л, креатинин – 215 мкмоль/л, общий белок – 62 г/л, общий холестерин – 3,64 ммоль/л, глюкоза – 15,0 ммоль/л, мочевая кислота – 761 мкмоль/л, высокочувствительный С-реактивный белок (СРБ) – 426 мг/л (при верхней границе нормы до 5 мг/л). На рентгенограмме суставов стоп в прямой проекции (от 28.04.2014 г.): крупные кисты в субхондральной зоне плюсневых и проксимальных фаланг 1-х пальцев стоп и мелкие эрозии на суставных поверхностях, значительное уплотнение околосуставных мягких тканей в области плюснефалангового сустава 1-го пальца правой стопы (рис. 3).
Был выставлен диагноз «Первичная хроническая тофусная подагра преимущественно метаболического типа тяжелого течения. Хронический подагрический полиартрит, активность 3-й степени, II рентгенологической стадии. Функциональная недостаточность суставов 3-й степени. ГУ (761 мкмоль/л). Множественные крупные неизъязвленные тофусы с локализацией на ушных раковинах, в области суставов кистей и стоп, изъязвленный тофус в левой пяточной области. Хроническая подагрическая нефропатия, азотемическая стадия, ХБП 3Б стадии. СД 2 типа, диабетическая нефропатия, диабетическая макроангиопатия, целевой уровень гликозилированного гемоглобина менее 7%. Категория риска развития синдрома диабетической стопы 2. ИБС: постинфарктный кардиосклероз (острый инфаркт миокарда с зубцом Q от 2009 г.). Гипертоническая болезнь III стадии. Степень АГ 2. Риск 4 (очень высокий). Хроническая сердечная недостаточность (ХСН) IIA стадии (ФК3)». С учетом снижения экскреторной функции почек вследствие наличия у больного почечной недостаточности (скорость клубочковой фильтрации по EPI – 35 мл/мин), СД 2 типа применение НПВП и глюкокортикоидов (ГК) для купирования обострения хронического подагрического полиартрита было противопоказано. С анальгетической целью были назначены в/м инъекции трамадола 200 мг/сут, начата терапия инсулинами короткого действия (по 10 Ед каждые 4 ч). 30.04.2014 г. в 20.30 пациент почувствовал выраженную общую слабость, усилились жажда, сухость во рту, появился холодный пот. АД – 85/40 мм рт. ст. Экстренно выполнен анализ крови на сахар – выявлена небольшая гипергликемия (9,3 ммоль/л), пациенту были введены 5% раствор глюкозы, преднизолон 90 мг, после чего состояние больного несколько улучшилось, но уже через 1 ч вновь резкое нарастание общей слабости, профузное потоотделение. При попытке встать пациент упал, потерял сознание, появился цианоз лица и плечевого пояса, АД – 40/15 мм рт. ст. На электрокардиограмме зарегистрированы признаки перегрузки правых отделов сердца (отклонение электрической оси сердца вправо, P-pulmonale, глубокий зубец S в I отведении, отрицательный зубец Т в III отведении, блокада правой ножки пучка Гиса). Для исключения острого инфаркта миокарда исследован сывороточный уровень тропонина I, который составил 0,148 мкг/л (в норме менее 0,5 мкг/л). В то же время концентрация D-димера в сыворотке крови оказалась повышенной в несколько раз и составила 2021 мкг/л (при норме до 500 мкг/л). Начаты реанимационные мероприятия, которые оказались безуспешными – при нарастающих явлениях острой сердечно-легочной недостаточности через 80 мин была констатирована биологическая смерть. Причиной смерти явилась тромбоэмболия легочной артерии.
Подагра часто сопровождается коморбидными заболеваниями [10–12], которые могут влиять на ее течение и прогноз. АГ и ИБС осложняются развитием хронической сердечной недостаточности (ХСН), которая, бесспорно, требует от врача назначения диуретических препаратов. В этой ситуации важно помнить, что все диуретики способствуют повышению уровня мочевой кислоты. В популяционном исследовании, включившим 4249 жителей Великобритании в возрасте старше 30 лет, клинически верифицированный диагноз подагры был установлен у 164 пациентов, при этом у 25 (15%) больных подагра была индуцирована приемом диуретиков, 16 (64%) из них по-прежнему продолжали принимать мочегонные препараты [13]. ГУ, возникающая в период лечения диуретиками, может быть обусловлена повышением обратной реабсорбции и снижением секреции уратов в канальцах почек, что на фоне пониженного почечного кровообращения приводит к увеличению выработки ангиотензина, еще больше угнетающего выделение мочевой кислоты [14]. Кроме того, фуросемид приводит к повышению уровня молочной кислоты, которая в свою очередь ингибирует экскрецию уратов [15]. Существует непреложное правило – диуретики, назначенные по жизненным показаниям (ХСН) больным подагрой, необходимо обязательно компенсировать приемом аллопуринола с титрованием дозы под контролем врача-ревматолога [7]. Необходимо учитывать участившиеся факты злоупотребления диуретиками молодыми женщинами по косметическим соображениям (с целью улучшения фигуры и т. п.) [14, 16]. Приводим собственное наблюдение – случай аутоятрогении – развитие у молодой женщины вторичной подагры, индуцированной длительным приемом фуросемида.
Больная А., 34 года
, поступила в ревматологическое отделение РКБ (Чебоксары) 05.10.2014 г. с жалобами на постоянные интенсивные боли, припухлость и покраснение в области плюснефалангового сустава 1-го пальца левой стопы, сохраняющиеся на протяжении недели. Из анамнеза заболевания: в 2000 г. (в возрасте 20 лет) пациентка с косметической целью за короткий период времени, придерживаясь жесткой диеты с ограничением животного белка, снизила массу тела на 20 кг. В последующем для поддержания «идеальной» массы тела самостоятельно начала принимать фуросемид по ½ таблетки 1 р./2–4 нед. Без приема диуретика пациентка стала субъективно ощущать одышку, тяжесть в области сердца, связывая эти явления с задержкой жидкости, она увеличила дозу препарата до 10–12 таблеток на один прием. В 2005 г. (5 лет постоянного приема фуросемида) впервые отметила появление болей, припухлости и локальной гиперемии в области правого голеностопного сустава, которые купировались самостоятельно через 3 дня, но, несмотря на это, она продолжала принимать фуросемид в прежней дозе. В 2010 г. боли и припухлость в области правого голеностопного сустава возникли вновь и в последующем повторялись с периодичностью каждые 2–3 мес., присоединился артрит плюснефалангового сустава 1-го пальца левой стопы. Для купирования суставных болей пациентка все чаще стала прибегать к в/м введениям кеторолака. В связи с отсутствием эффекта от применения НПВП в 2014 г. обратилась к ревматологу РКБ. При обследовании у пациентки были исключены ревматоидный артрит, урогенитальная форма реактивного артрита, спондилоартриты, системная красная волчанка. В биохимическом анализе крови обращало на себя внимание повышение сывороточных уровней мочевины (25,5 ммоль/л), креатинина (128 мкмоль/л), общего холестерина (9,4 ммоль/л), мочевой кислоты (495 мкмоль/л). Для уточнения диагноза пациентка была госпитализирована в ревматологическое отделение. Из физикального осмотра: индекс массы тела – 18,2 кг/м2; по органам и системам – без особенностей; болезненность при пальпации и дефигурация плюснефалангового сустава 1-го пальца левой стопы с локальной гиперемией и гипертермией (рис. 4). При проведении дополнительного лабораторного исследования выявлены повышение СОЭ до 54 мм/ч, гипоизостенурия, никтурия, гипер-альфа-2-глобулинемия (14%), гиперлипопротеинемия IIb типа по Фредриксону, ГУ (654 мкмоль/л), снижение суточной экскреции мочевой кислоты до 0,8 ммоль/сут (при норме 1,5–4,5 ммоль/сут). По данным эзофагогастродуоденоскопии в полости желудка определялись слизь, прозрачная желчь, слизистая желудка была диффузно гиперемирована и отечна. На рентгенограмме суставов стоп в прямой проекции (от 12.10.2014 г.) отмечены незначительное сужение суставных щелей плюснефаланговых суставов 1-х пальцев стоп, единичные кистовидные просветления в головке 1-й плюсневой кости слева (рис. 5).
Был выставлен диагноз «Вторичная подагра, индуцированная длительным приемом фуросемида, почечный (гипоэкскреторный) тип. Хронический подагрический артрит правого голеностопного сустава, плюснефалангового сустава 1-го пальца левой стопы, активность 3-й степени, рентгенологическая стадия I. ГУ (654 мкмоль/л). Хронический интерстициальный нефрит, латентное течение. ХБП 2 стадии. Гиперлипопротеинемия IIb типа. Химическая гастропатия, обусловленная рефлюксом желчи». Был немедленно отменен фуросемид, расширен питьевой режим до 1,5–2 л/сут (раньше пила не более 300–500 мл). Уровень мочевой кислоты за 14 дней снизился до 631 мкмоль/л. Для купирования артрита пациентке был назначен амтолметин гуацил (АМГ) в дозе 1200 мг/сут в 2 приема. Переносимость препарата была удовлетворительной. После полного купирования воспалительных явлений в суставе (через 7 дней) на фоне продолжающегося приема АМГ в стационаре инициирована терапия аллопуринолом в начальной дозе 100 мг/сут с рекомендациями титрования дозы последнего до достижения нормоурикемии (целевой уровень мочевой кислоты в сыворотке крови – менее 360 мкмоль/л) в амбулаторных условиях.
Достаточно распространенными являются и ошибки, допускаемые в ведении пациентов с хроническим подагрическим артритом. Среди них: 1) назначение аллопуринола в острый период болезни; 2) в ряде случаев не проводится титрование дозы аллопуринола до максимально эффективной, позволяющей достичь целевого значения уровня мочевой кислоты; 3) прекращение приема аллопуринола при достижении нормоурикемии; 4) необоснованное назначение глюкокортикоидов (ГК) для купирования обострения хронического подагрического артрита, которые в свою очередь могут привести к усугублению сопутствующих подагре метаболических расстройств (АГ, СД 2 типа, дислипидемии), развитию вторичной надпочечниковой недостаточности при отмене лечения, стремительному росту интрадермальных тофусов при длительном применении, снижению эффективности ГК через 1 год терапии (по силе своего действия ГК становятся сопоставимыми с НПВП) [8, 17, 18]; 5) резекция подкожных тофусов без достижения нормоурикемии, что создает угрозу для инфицирования длительно незаживающих кожных дефектов [19]. На аналогичные терапевтические ошибки, допускаемые врачами первичного звена здравоохранения в ведении пациентов с подагрическим артритом, указывают М.В. Склянова и А.Н. Калягин. При проведенном ими анонимном анкетировании 50 участковых терапевтов Иркутска выяснилось, что 56% врачей допускают возможность назначения аллопуринола в острый период болезни, каждый четвертый (26%) указал на необходимую отмену приема аллопуринола после достижения нормоурикемии, 10% врачей в своей клинической практике никогда не назначали пациентам с подагрой аллопуринол, в то время как 44% опрошенных указали на целесообразность применения аллопуринола у лиц с бессимптомной ГУ [20]. Приводим собственное наблюдение, когда бесконтрольное применение ГК в отсутствие достижения нормоурикемии послужило поводом для хирургического удаления подкожных депозитов солей мочевой кислоты, что неминуемо сопровождалось обострением хронического подагрического артрита и привело к длительному незаживлению раневой поверхности.
Больной А., 60 лет,
поступил в ревматологическое отделение РКБ (Чебоксары) 19.10.2015 г. с жалобами на постоянные интенсивные боли, припухлость и покраснение в области правого голеностопного сустава, ряде плюснефаланговых суставов правой стопы, незаживающую в течение 1 года рану в области 2-го пальца правой стопы после ампутации, выполненной 08.09.2014 г. Из анамнеза заболевания: в возрасте 45 лет впервые развился острый артрит плюснефалангового сустава 1-го пальца правой стопы, который купировался самостоятельно через 7 дней. Первое обращение к врачу-терапевту – спустя несколько лет после череды рецидивирующих артритов одного и того же плюснефалангового сустава. При обследовании выявлена ГУ (сывороточный уровень мочевой кислоты на тот момент составил 456 мкмоль/л). Выставлен диагноз «подагра, хронический подагрический артрит», после купирования подагрической атаки НПВП (диклофенак 150 мг/сут в течение 10 дней) начата терапия аллопуринолом в дозе 100 мг/сут. Доза последнего препарата на протяжении 12 лет не пересматривалась. На этом фоне пациент отмечает присоединение артритов одноименного сустава левой стопы, голеностопных, локтевых, лучезапястных суставов, пястно-фалангового сустава 2-го пальца правой кисти. Обострение заболевания – более 5 р./год, в области суставов кистей и стоп в последние 7–8 лет появились подкожные образования (тофусы) с нарастанием их размеров и количества. Приступы артритов, по рекомендации врача-терапевта, купировал внутримышечными инъекциями кеторолака, реже – диклофенака или приемом нимесулида. Постоянно использовал мази/гели на область пораженных суставов в момент суставных атак, принимал широко рекламируемые в средствах массовой информации биологически активные добавки с целью снижения уровня мочевой кислоты в крови. Ретроспективный анализ амбулаторной медицинской карты выявил постоянную ГУ с минимальным значением мочевой кислоты 571 мкмоль/л. В сентябре 2014 г. обратился к хирургу в связи с появлением интенсивных болей, припухлости, покраснения в области 2-го пальца правой стопы с распространением отека и гиперемии на тыл стопы, а также повышением температуры тела. В анализах крови выявлены нейтрофильный лейкоцитоз без сдвига влево (11,0×109/л), повышение СОЭ (46 мм/ч) и уровня СРБ (85,8 мг/л). На рентгенограмме суставов правой стопы в прямой проекции (от 08.09.2014 г.): множественные кисты эпифизов плюсневых костей и фаланг пальцев и эрозии на суставных поверхностях, уплотнение околосуставных мягких тканей в области плюснефаланговых суставов правой стопы (рис. 6). Состояние было расценено как «острый гнойный артрит», вследствие чего 08.0.2014 г. выполнена ампутация 2-го пальца правой стопы (рис. 7) с последующим назначением антибактериальной терапии. В момент оперативного вмешательства получено большое количество творожистого белого отделяемого в отсутствие гнойного экссудата. Рана заживала вторичным натяжением, по настоящее время сохраняется кожный дефект в основании 2-го пальца правой стопы с периодическим отхождением из раны тофусных масс. В последние 2 года пациент отмечал частые рецидивы артрита правого лучезапястного, коленных и голеностопных суставов, применение НПВП (диклофенак, кеторолак, нимесулид, мелоксикам) стало неэффективным, вследствие чего для купирования хронического подагрического артрита в последующие месяцы использовались внутримышечные инъекции пролонгированного бетаметазона. Наблюдался стремительный рост тофусов (рис. 8). В марте 2015 г. в связи с повышением температуры тела до 39°С, появлением болей в поясничной области, нарастанием общей слабости был госпитализирован в нефрологическое отделение ГКБ № 1 (Тольятти). При лабораторном исследовании выявлены лейкоцитоз (13,0×109/л) со сдвигом лейкоформулы влево (палочкоядерные нейтрофилы – 8%), повышение СОЭ до 55 мм/ч; в анализе мочи – протеинурия (1,19 г/л), лейкоцитурия и бактериурия при микроскопии мочевого осадка. Наблюдалось снижение скорости клубочковой фильтрации по EPI до 61 мл/мин на фоне гиперкреатининемии (125 мкмоль/л) и концентрационной функции почек (суточные колебания относительной плотности мочи от 1004 до 1009, никтурия – ночной диурез против дневного – 1,49 л против 0,8 л). При проведении ультразвукового исследования почек обнаружены уменьшение толщины паренхимы с повышением ее эхоплотности с множественными очагами фиброза до 4–5 мм, бугристость контура почки, расширение чашечно-лоханочной системы почки, что указывало на наличие у пациента хронического пиелонефрита, носящего, вероятно, вторичный характер. Был выставлен диагноз «Хроническая подагрическая нефропатия с поражением почек по типу хронического интерстициального нефрита. Вторичный хронический пиелонефрит, обострение. ХБП 2 стадии». На фоне проведенной антибактериальной (цефтриаксон 2 г/сут) и антигипертензивной (амлодипин 10 мг/сут и лозартан 100 мг/сут) терапии наблюдались улучшение показателей общего анализа крови и мочи, нормализация АД, снижение уровня креатинина в сыворотке крови до 102 мкмоль/л (СКФ по EPI – 79 мл/мин). При выписке пациенту рекомендовано обратиться к ревматологу для подбора дозы аллопуринола, однако больной продолжал принимать препарат в дозе 100 мг/сут, с последующей чередой обострений хронического подагрического артрита, для купирования которых неоднократно были использованы ГК. Из анамнеза жизни известно, что пациент страдает язвенной болезнью желудка с редким рецивированием язв. Злоупотребление алкоголем отрицает. При проведении физикального осмотра в момент госпитализации в ревматологическое отделение: индекс массы тела – 23,2 кг/м2; по органам и системам – без особенностей; болезненность при пальпации и дефигурация правых лучезапястного и голеностопного суставов с локальной гиперемией и гипертермией, отек тыла правой стопы, преимущественно у основания пальцев, множественные тофусы с локализацией на кистях и стопах. При проведении дополнительного лабораторного исследования выявлены повышение СОЭ (по методу Панченкова) до 21 мм/ч и СРБ до 18,9 мг/л, гипоизостенурия, ГУ (551 мкмоль/л) при снижении суточной экскреции мочевой кислоты до 1,0 ммоль/сут (при норме 1,5–4,5 ммоль/сут). На рентгенограмме суставов кистей в прямой проекции: кистовидные просветления в эпифизах костей, мелкие эрозии на суставных поверхностях, сужение суставных щелей ряда пястно-фаланговых и межфаланговых суставов, значительное уплотнение околосуставных мягких тканей в проекции плюснефаланговых суставов 3-х пальцев обеих кистей (рис. 9).
Был выставлен диагноз «Первичная хроническая тофусная подагра преимущественно метаболического типа тяжелого течения. Хронический подагрический полиартрит, активность 2-й степени, II рентгенологической стадии. Функциональная недостаточность суставов 2 степени. ГУ (551 мкмоль/л). Множественные крупные неизъязвленные тофусы с локализацией в области суставов кистей и стоп. Хроническая подагрическая нефропатия по типу хронического интерстициального нефрита, азотемическая стадия, ХБП 2 стадии. Состояние после экзартикуляции 2-го пальца правой стопы. Гипертоническая болезнь II стадии. Достигнутая степень АГ 1. Риск 3 (высокий)». Для купирования артрита пациенту был назначен АМГ по 600 мг 2 р./сут (с рекомендациями приема препарата строго натощак). На фоне продолжающегося приема АМГ была повышена доза аллопуринола до 200 мг/сут, через 1 нед. повторно был определен уровень мочевой кислоты в сыворотке крови, который составил 370 мкмоль/л, что требовало дальнейшего титрования дозы аллопуринола до достижения нормоурикемии (целевой уровень мочевой кислоты – менее 360 мкмоль/л) при продолжении превентивной противовоспалительной терапии АМГ.
В момент обострения хронического подагрического артрита перед врачом стоит задача максимально быстро, эффективно и безопасно купировать артрит. В этом случае препаратами первой линии становятся НПВП. По мнению М.С. Елисеева и В.Г. Барсковой, это может быть как неселективный, так и селективный ингибитор циклооксигеназы-2 при условии максимально быстрой реализации его противовоспалительного и анальгетического эффекта с минимальной частотой развития неблагоприятных реакций [18]. В последние годы в арсенале отечественных врачей появился принципиально новый неселективный НПВП – амтолметин гуацил (Найзилат®, Dr. Reddy’s Lab), обладающий наряду с выраженным анальгетическим и противовоспалительным действием гастропротективным эффектом. Последнее стало возможным благодаря модификации молекулы толметина путем введения аминокислоты ванилина, что позволило достичь реализации защитного действия АМГ по отношению к слизистой оболочке желудочно-кишечного тракта (ЖКТ) при сохранении класс-специфических положительных эффектов НПВП. Гастропротективные свойства препарата связаны со стимуляцией рецепторов капсаицина (так называемые ваниллоидные рецепторы, название которых происходит от наличия ванилиновой группы в молекуле АМГ), находящихся в стенках ЖКТ. Возбуждение капсаициновых рецепторов приводит к высвобождению пептида, кодируемого геном кальцитонина, что в свою очередь приводит к локальному повышению продукции оксида азота (NO) именно в слизистой оболочке желудка, а не в других органах и тканях [21, 22]. Как известно, NO является одним из важных компонентов эндогенной системы защиты слизистой оболочки верхних отделов ЖКТ от повреждений, он сохраняет целостность структуры путем увеличения образования слизи и секреции бикарбонатов, усиления кровотока и репарации эпителиальных клеток, снижения хемотаксиса нейтрофилов и перекисного окисления липидов. Эффективность и безопасность АМГ продемонстрированы в ряде клинических исследований. Так, A. Tavella и G. Ursini показали большую эффективность 4-недельной терапии АМГ по сравнению с диклофенаком у больных с мышечно-скелетной болью по влиянию на снижение выраженности боли в покое, при движении, а также нарушения функции [23]. Метаанализ 18 клинических исследований, проведенный R. Marcolongo et al. по оценке безопасности применения АМГ у пациентов с остеоартрозом и ревматоидным артритом по сравнению с другими неселективными НПВП, такими как диклофенак, толметин, индометацин, напроксен, пироксикам и ибупрофен, показал, что частота побочных эффектов и случаев преждевременного прекращения терапии была более низкой в группе АМГ. Отношение шансов (ОШ) неблагоприятных реакций АМГ по сравнению с таковыми других НПВП, оцененных вместе, составило 0,2 (95% ДИ 0,1–0,3). При эндоскопической оценке частота и выраженность повреждений слизистой оболочки верхних отделов ЖКТ в группе пациентов, принимавших АМГ, оказались значимо ниже, чем в группах контроля, – ОШ умеренных и тяжелых эрозивно-язвенных изменений составило 0,1 (95% ДИ 0,1–04) [24]. Еще одно исследование безопасности и эффективности АМГ у больных ревматоидным артритом было проведено группой хорватских ученых. В 24-недельное рандомизированное плацебо-контролируемое исследование было включено 180 пациентов с ревматоидным артритом, из них 85 больных получали АМГ в дозе 1200 мг/сут и 95 – целекоксиб 200 мг/сут. Оба НПВП продемонстрировали одинаковую клиническую эффективность (по ACR-20) при ее оценке на 4-й, 12-й и 24-й нед. терапии. При анализе эндоскопических данных не было выявлено статистически значимой разницы в группах, применявших АМГ или целекоксиб, какие-либо гастроинтестинальные изменения по данным эзофагогастродуоденоскопии были отмечены у 24,8% и 22,3% больных соответственно. В то время как клинические проявления симптома диспепсии (боль и дискомфорт в эпигастральной области) через 4 нед. терапии встречались реже на фоне приема АМГ [25]. Рекомендуемая доза АМГ составляет 600 мг 2 р./сут (максимальная суточная доза – 1800 мг), поддерживающая доза – 600 мг 1 р./сут, для сохранения гастропротективного действия препарата АМГ следует принимать натощак. Как показали исследования, АМГ хорошо переносился пациентами и при длительном применении (в течение 6 мес.). Среди зарегистрированных ревматологических показаний для применения АМГ значатся не только ревматоидный артрит, остеоартроз, анкилозирующий спондилит, поражение околосуставных мягких тканей (бурсит, тендовагинит), но и суставной синдром при обострении подагры. И хотя в настоящее время нет исследований, посвященных применению АМГ у больных подагрой, наш позитивный опыт использования нового эффективного неселективного НПВП с собственным гастропротективным эффектом в купировании обострения хронического подагрического артрита дает право надеяться на успешное применение препарата в борьбе с острой и хронической болью.
Лечение подагры
Задача лечения подагры — уменьшение болевых проявлений и профилактика повторных приступов и осложнений (повреждение суставов и мочекаменной болезни). Применяются следующие методы лечения:
Диета. При наличии лишнего веса необходимо снизить калорийность питания. Кроме того, значительно сократить наличие в рационе мясных продуктов и морепродуктов. Сократить употребление алкоголя и особенно пива.
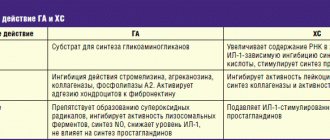
Медикаментозное лечение. Существуют препараты увеличивающие выделение мочевой кислоты( урикозурические средства – например бенемид), снижающие выработку мочевой кислоты (урикодепрессивные средства – например аллопуринол), препараты снимающие острый приступ – колхицин, НПВС, кортикостероиды.