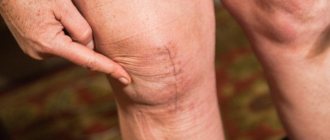
Гной в послеоперационной ране говорит о развитии инфекционных осложнений. В ортопедии и травматологии они тяжело поддаются лечению и приводят к инвалидизации пациентов. Парапротезные инфекции обусловливают увеличение срока пребывания в стационаре и требуют затрат на борьбу с ними.
Выделения из ТБС.
Инфекции после эндопротезирования бывают поверхностными или глубокими, острыми или хроническими, развиваться в раннем или позднем послеоперационном периоде. Воспалительный процесс может затрагивать только мягкие ткани нижней конечности или распространяться на прооперированный сустав.
Если после эндопротезирования у вас появился гной в шраме, повысилась температура и возникли боли в ноге – немедленно идите к врачу. Тот осмотрит вас, назначит нужные исследования и выяснит, насколько тяжелое у вас состояние. Вам придется лечь в стационар и пройти курс лечения.
Актуальность проблемы
По разным данным, частота развития ранней парапротезной инфекции после первичной замены крупных суставов составляет 0,3-0,5%, после ревизионной – 9%. Воспалительные процессы выявляют в течение первых трех недель после хирургического вмешательства.
Пример «спокойного» шва.
Если говорить о частоте развития поздних инфекционных осложнений, то чаще всего они возникают в первые два года после эндопротезирования (1,63% пациентов). Реже (у 0,59% прооперированных) глубокие парапротезные инфекции развиваются в последующие 8 лет после операции.
Частота инфекционных осложнений на протяжении нескольких десятилетий остается неизменной. Однако заметно увеличилось общее количество артропластик, выросло и общее число осложнений. Поэтому становится все более актуальной их профилактика, ранняя диагностика и лечение.
Факт! Как показали научные исследования, риск развития инфекционных осложнений зависит от вида эндопротеза. Выяснилось, что в общей сумме имплантация отечественных моделей приводит к воспалению чаще (3-10% случаев), чем установка импортных (0,3-4,8%).
Симптомы
Проявления парапротезной инфекции во многом напоминают клинику классического инфекционного процесса независимо от места его возникновения. В целом симптомы зависят от таких факторов, как:
- период возникновения инфекции:
- глубина распространения процесса.
Поверхностный тип инфекции возникает в период восстановления после операции. При этом наблюдается воспалительный процесс со стороны мягких тканей без втягивания в него имплантированного сустава. Проявлениями являются:
- гиперемия (покраснение) кожных покровов в области сустава;
- локальная (местная) припухлость;
- повышение местной температуры;
- боли;
- нарушения со стороны раны.
Характеристики болей:
по локализации – в области эндопротеза;- по распространению – иррадиация ограничена соседними тканями;
- по характеру – ноющие, при присоединении гнойного процесса – дергающие;
- по выраженности – средней интенсивности, при нагноении усиливаются;
- по возникновению – наблюдаются практически сразу с момента развития инфекционного процесса.
Характеристики раны:
- может медленно заживать;
- края нередко расходятся;
- при абсцедировании (нагноении) появляется гнойное отделяемое;
- в ряде случаев наблюдается формирование участков поверхностного некроза (омертвения).
Глубокая форма парапротезной инфекции может развиваться и в раннем послеоперационном периоде, и через довольно длительное время после хирургического вмешательства. При ней поражаются мышцы и фасции в области имплантированного сустава. Помимо местных признаков, которые перекликаются с признаками при поверхностной форме патологии, наблюдается нарушение функции конечности. Также отмечается ухудшение общего состояния из-за интоксикационного синдрома, который развивается по причине втягивания в процесс достаточно большого массива тканей. Его признаками являются:
- гипертермия (повышение температуры тела). Зачастую она достигает 38 градусов по Цельсию, иногда выше;
- озноб. Его сочетание с повышением температуры тела называется лихорадкой;
- общая слабость;
- чувство разбитости;
- ухудшение работоспособности.
Глубокий и поверхностный процессы могут развиваться одновременно.
Обратите внимание
Парапротезная инфекция способна протекать со сглаженной симптоматикой.
Что такое инфекция в области хирургического вмешательства
ИОХВ – это острое или хроническое воспаление, развивающееся в месте разреза или в области, которая подвергалась ятрогенному воздействию в ходе хирургического вмешательства. В 67% случаев инфекция затрагивает только зону операционного разреза, в 33% – распространяется на имплантированный сустав.
Факторы развития ИОХВ:
- длительность операции более 3 часов;
- технические трудности во время хирургического вмешательства;
- интраоперационная кровопотеря более 1 литра;
- нестабильность установленного эндопротеза;
- использование дополнительных синтетических и биологических материалов в ходе операции;
- наличие тяжелых хронических заболеваний.
Воспалительные процессы, которые не распространяются на прооперированный сустав, можно победить без ревизионного эндопротезирования. Если же инфекция затрагивает костную ткань, компоненты эндопротеза, остатки суставной капсулы или другие части коленного или тазобедренного сустава – лечить ее будет крайне тяжело. В этом случае больному скорее всего потребуется повторное эндопротезирование.
Существует ряд факторов, которые отягощают состояние пациента, замедляют выздоровление и ухудшают прогноз: снижение иммунитета, перенесенные операции, частое лечение антибиотиками. Стойкость обнаруженной микрофлоры к антибактериальным средствам, плохое кровообращение в области сустава, массивные гнойные очаги тоже осложняют терапию.
Эндопротезирование колен в Чехии: гарантии, цены, реабилитация, отзывы и статистика.
Узнать подробнее
Малоинвазивное эндопротезирование в Чехии: врачи, реабилитация, сроки и цены.
Узнать подробнее
Причины
Непосредственная причина описываемой патологии – это патогенные микроорганизмы (как правило, бактерии). Чаще всего при данной патологии выявляются:
- стафилококки (в том числе золотистый стафилококк);
- стрептококки;
- кишечная палочка
и некоторые другие.
Выявлено, что имеется связь между разновидностью возбудителя и видом протеза. Это объясняется биологической склонностью патогенных (и не только) микроорганизмов к адгезии (прилипанию) к инородным материалам, которые находятся в тканях пациента. Вот несколько примеров:
- в области металлических имплантов или их отдельных частей чаще всего развивается инфекционный процесс, спровоцированный золотистым стафилококком;
- в зоне полимерных имплантов активизируется эпидермальный стафилококк
и так далее.
Помимо этого, выделены факторы, которые способствуют возникновению парапротезной инфекции:
- общие особенности оперативного вмешательства;
частные особенности имплантирования эндопротеза;- пожилой возраст;
- ряд тяжелых соматических заболеваний;
- нарушение микроциркуляции;
- иммунодефициты;
- особенности лекарственной терапии перед операцией;
- человеческий фактор.
Наиболее значимыми в возникновении парапротезной инфекции являются следующие общие особенности хирургического вмешательства:
- длительность операции более 3 часов – из-за увеличения времени контакта тканей с инфицированной внешней средой увеличивается вероятность их заражения;
- общая реакция организма на стресс, которым является любое хирургическое вмешательство;
- интраоперационные осложнения – например, кровотечение из поврежденных сосудов;
- технические трудности из-за особенностей конкретного организма.
К частным особенностям имплантирования эндопротеза, способствующим развитию парапротезной инфекции, относятся следующие:
- организм реагирует на чужеродный элемент, которым является суставной протез;
- имплант может травмировать мягкие ткани, а это способствует проникновению в них патогенной микрофлоры.
Обратите внимание
Чем старше пациент, тем риск возникновения парапротезной инфекции выше. Это связано не только с возрастным ухудшением иммунитета, но и с инволютивными процессами в тканях, из-за чего они постепенно теряют возможность к восстановлению.
Любая тяжелая соматическая патология (текущая или недавно перенесенная) способствует ослаблению защитных сил организма и развитию парапротезной инфекции. Это серьезные заболевания любой из систем организма:
- сердечно-сосудистой – гипертоническая болезнь, атеросклероз, миокардит;
- дыхательной – пневмония, плеврит, бронхиальная астма;
- желудочно-кишечной – язвенная болезнь желудка и 12-перстной кишки, холецистит, панкреатит;
- мочеполовой – пиелонефрит, гломерулонефрит
и так далее.
Нарушение микроциркуляции приводит к ухудшению восстановления тканей, пораженных микроорганизмами. Зачастую оно наблюдается при сосудистых и эндокринных нарушениях – как правило, это:
- васкулит – воспалительное поражение стенки сосудов с их последующим нарушением;
- сахарный диабет – нарушения обмена углеводов из-за дефицита инсулина
и так далее.
Иммунодефициты играют непосредственную роль в возникновении парапротезной реакции – она способна развиться при наименьших нарушениях защитных сил организма. Это иммунодефицитные состояния:
- врожденные;
- приобретенные.
Ухудшение иммунитета может быть обусловлено и врачебными назначениями в перед- и послеоперационном этапе – это:
- переливание крови;
- лекарственная терапия.
Что касается роли особенности лекарственной терапии перед операцией, то выраженную негативную роль может сыграть длительное применение антибиотиков перед эндопротезированием. При этом микрофлора становится устойчивой к антибактериальным препаратам, и их применение в послеоперационном периоде с целью профилактики инфекций мало- или совсем неэффективно.
Важно
К человеческому фактору, который способствует развитию парапротезной инфекции, относится сознательное или несознательное нарушение предписаний врача, которые касаются режима двигательной активности и реабилитационных мероприятий в послеоперационном периоде.
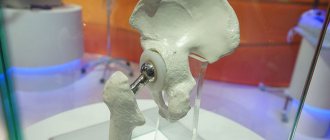
Виды парапротезной инфекции
В ортопедии и травматологии используют несколько классификаций ИОХВ. Систематизация и отнесение инфекции к конкретному виду помогает врачам оценить тяжесть состояния пациента. Классификация Coventry-Fitzgerald-Tsukayama самая распространенная.
Таблица 1. Типы глубокой парапротезной инфекции по Coventry-Fitzgerald-Tsukayama.
| Тип | Время развития | Тактика лечения | |
| I | Острая послеоперационная | 1-й месяц | Ревизия послеоперационной раны, удаление некротизированных тканей, при необходимости – замена некоторых частей эндопротеза при сохранении его основных компонентов. |
| II | Поздняя хроническая | От 1 месяца до 1 года | Обязательное ревизионное эндопротезирование. |
| III | Острая гематогенная | После 1 года | Вполне оправданной является попытка сохранить установленный протез. |
| IV | Положительные интраоперационные культуры | Бессимптомная бактериальная колонизация поверхности импланта | Консервативное лечение, заключающееся в парентеральной антибиотикотерапии на протяжении 6 недель. |
В классификации, созданной Новосибирским НИИТО, ИОХВ делят на ранние острые, поздние острые и хронические. Первые развиваются на протяжении трех месяцев после эндопротезирования, вторые – на 3-12 месяце, третьи – после 1 года. Инфекционные осложнения могут протекать в латентной, свищевой, флегмоноподобной или атипичной форме.
По распространенности инфекции бывают эпифасциальными (поверхностными) и субфасциальными (глубокими). Могут сопровождаться тотальной, бедренной или тибиальной нестабильностью.
Профилактика
Предупредить развитие парапротезной инфекции могут такие действия, как:
учет показаний и противопоказаний при постановке суставного импланта;- неукоснительное соблюдении принципов асептики и антисептики при проведении эндопротезирования;
- рациональный подход к антибиотикотерапии;
- ликвидация очагов хронической инфекции в организме;
- выполнение пациентом всех предписаний врача касательно активности и реабилитационных мероприятий.
Поверхностные и глубокие инфекции
Возникают в первый месяц после эндопротезирования. Характеризуются развитием воспаления в мягких тканях нижней конечности. Сам бедренный или коленный сустав остается интактным, то есть не вовлекается в патологический процесс. Причиной осложнения чаще всего является занесение в рану патогенных микроорганизмов во время хирургического вмешательства или в послеоперационном периоде.
Поверхностные ИОХВ:
- некроз кожных покровов;
- лигатурные свищи;
- расхождение краев раны;
- подкожная гематома.
Глубокие инфекции:
- некроз парапротезных тканей;
- глубокие свищи;
- инфицированная субфасциальная гематома.
Факт! Незначительная болезненность, локальная припухлость, покраснение и гипертермия кожи в области шрама обычно указывают на поверхностную инфекцию, которая поддается лечению. Появление лихорадки, спонтанное расхождение швов и сильные боли в ноге позволяют заподозрить воспаление глубоких тканей. В этом случае прогноз менее благоприятный.
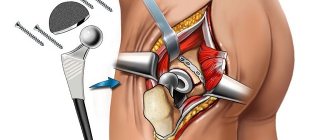
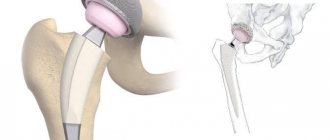
Инфекции протезированного сустава
При патологии воспаление распространяется на полости и оболочки прооперированного сустава, остатки синовиальной оболочки, кости в месте фиксации эндопротеза и прилегающие мягкие ткани. Причиной осложнения является колонизация поверхностей сустава патогенной микрофлорой. Бактерии могут попадать из внешней среды или заноситься гематогенным путем.
Так выглядит инфекция на рентгене.
Инфекции протезированного сустава самое грозное осложнение среди всех ИОХВ. Они не поддаются консервативной терапии, поэтому лечить их приходится хирургическим путем. Врачи заменяют эндопротез, однако иногда им все же удается сохранить его.
Существует три метода лечения инфекций протезированного сустава: ревизия раны без удаления импланта, ревизионное одноэтапное и двухэтапное эндопротезировение. Выбор методики зависит от состояния пациента, время манифестации инфекции, стабильности компонентов протеза и характера патогенной микрофлоры.
Рентгенологические исследования
Большую роль в дифференциальной диагностике свищевых форм инфекции играет рентгенофистулография. С ее помощью можно определить размер, форму и расположение свищей, выявить гнойные затеки и их связь с очагами костной деструкции. Это позволяет отличить поверхностные ИОХВ от глубоких.
Фото: Рентгенофистулография, свищ в нижней трети бедра.
Для диагностики инфекции протезированного сустава чаще всего используют рентгенографию. Метод на дает 100% верных результатов, однако позволяет заподозрить патологию. На наличие парапротезной инфекции указывает внезапное появление периостальной реакции и остеолиза. Если эти признаки возникают внезапно, вскоре после успешно проведенной операции, – есть повод заподозрить неладное.
Любопытно! МРТ, УЗИ и радиоизотопное сканирование в диагностических целях используют редко из-за их низкой информативности. К примеру, установленный эндопротез создает помехи при магнитно-резонансной томографии, что делает изображение размытым и нечетким.
Лабораторные анализы
Сдача анализов помогает выявить острые и хронические воспалительные процессы в организме. Повышение показателей не является достоверным признаком ИОХВ. Для постановки диагноза нужно учитывать наличие определенных клинических симптомом, данных рентгенографии и других методов исследования.
Клинически значимые лабораторные показатели:
- Количество лейкоцитов. Имеет значение в диагностике острой парапротезной инфекции. Ярким признаком воспаления является повышение общего количества лейкоцитов и нейтрофилов, сдвиг лейкоцитарной формулы влево.
- СОЭ. Является неспецифическим показателем. Нормальная скорость оседания эритроцитов говорит об отсутствии воспалительных процессов, повышенная – об их наличии.
- С-реактивный белок. СРБ является белком острой фазы воспаления и высокочувствительным маркером ИОХВ для людей, которым выполнили эндопротезирование. При диагностике парапротезных инфекций нужно обращать внимание именно на этот показатель.
Эндопротезирование колен в Чехии: гарантии, цены, реабилитация, отзывы и статистика.
Узнать подробнее
Малоинвазивное эндопротезирование в Чехии: врачи, реабилитация, сроки и цены.
Узнать подробнее
Медицинские интернет-конференции
Учитывая увеличение общей артропластики суставов, проводимой ежегодно, число
осложнений, требующих ревизионной хирургии, увеличивается.
Частота возникновения ППИ варьирует от 0,6 — 0,9% до 2,0 — 2,4% при общей артропластике
тазобедренного и коленного суставов [1]. Несмотря на относительно невысокую
заболеваемость ППИ, финансовое бремя остается огромным.
Патогенез
Присоединение бактерий к имплантату является первым шагом в патогенезе ППИ [2]. Во
Учитывая увеличение общей артропластики суставов, проводимой ежегодно, число осложнений, требующих ревизионной хирургии, увеличивается. Частота возникновения ППИ варьирует от 0,6 — 0,9% до 2,0 — 2,4% при общей артропластике тазобедренного и коленного суставов [1]. Несмотря на относительно невысокую заболеваемость ППИ, финансовое бремя остается огромным. Патогенез Присоединение бактерий к имплантату является первым шагом в патогенезе ППИ [2]. Во время адгезии бактерий к поверхности имплантата возникают две различимые фазы: обратимое (неспецифическое) и необратимое (специфическое) прикрепление. Обратимое прикрепление работает на основе неспецифических физических и химических характеристик бактерий [2]. Биоматериал и окружающая суставная жидкость также играют роль в обратимой адгезии бактерий к имплантату[3]. Напротив, необратимая адгезия зависит от более специфических структур и рецепторов. Биопленки играют важную роль в патогенезе ППИ. Прикрепление бактерий к поверхности предполагает межклеточную адгезию между микроорганизмами и искусственной поверхностью [3]. Данные свидетельствуют о том, что внутриклеточное проникновение стафилококков является механизмом, способствующим патогенезу ППИ и устойчивости к лечению. Согласно этой концепции, стафилококки могут проникать и жить в клетках-хозяевах, способствуя длительной персистенции микроорганизма в кости через уклонение от антибиотиков и реакции иммунной системы[4]. Большинство ППИ вызваны грамположительными кокками (золотистый стафилококк и коагулазонегативный стафилококк)[5]. В некоторых случаях грамотрицательные бактерии и грибки также могут приводить к инфекции. Значительная часть ППИ может быть полимикробной (около 19%). Определение и проявления перипротезной инфекции суставов В соответствии с предложенными критериями ППИ существует тогда, когда: 1. Патоген выделяют культурой по меньшей мере из двух отдельных образцов ткани или жидкости, полученных из пораженного протезного сустава 2. Существуют четыре из следующих пяти критериев. Повышенная скорость оседания эритроцитов в сыворотке (СОЭ) и концентрация С- реактивного белка (СРБ) в сыворотке, Повышенное количество синовиальных лейкоцитов, Повышенный процент синовиальных нейтрофилов, Наличие гноя в пораженном суставе, Выделение микроорганизма в одной культуре перипротезной ткани или жидкости. ППИ также может присутствовать, если соблюдены менее четырех из этих критериев, а клинические подозрения высоки [6]. Ранняя ППИ (возникающая в первые 3 месяца после первичной операции) обычно проявляется острой болью в суставах, воспалением раны ( локальной гипертермией и гиперемией), выпотом в суставах и потерей функции [7]. Хроническая ППИ обычно проявляется хронической болью в суставах и расшатыванием протеза. Факторы риска возникновения ППИ: возраст > 50 лет, ИМТ > 30, сахарный диабет II типа, алкоголизм и наркомания в анамнезе. Диагностика Работа по диагностике ППИ начинается с систематизации с определения СОЭ и СРБ из- за их высокой чувствительности и специфичности [8]. При наличии нормального уровня этих тестов показателей инфекция маловероятна. Повышенные уровни любого из этих показателей должны подтолкнуть к дальнейшему исследованию в виде суставной аспирации. Сочетание серологии и аспирации может помочь клиницисту подтвердить или опровергнуть диагноз. Комбинация серологии и суставной аспирации в большинстве случаев достаточна для диагностики ППИ [8]. Культура аспирированной суставной жидкости и пробы, взятые во время операции, играют важную роль в диагностике ППИ. Рекомендуется взять от трех до пяти образцов из разных мест вокруг протеза, чтобы повысить вероятность получения положительной культуры [9]. Предварительное использование антибиотиков, медленно растущие организмы и наличие биопленок являются одними из факторов, отрицательно влияющих на чувствительность результатов культивирования [10]. Одноэтапное ревизионное эндопротезирование В то время как двухэтапная обменная артропластика является предпочтительным методом лечения ППИ, многие европейские центры уже давно выступают за использование одноэтапной процедуры, ссылаясь на снижение заболеваемости, снижение затрат и сопоставимые результаты [11]. Для того чтобы пациент мог быть кандидатом на одностадийное лечение, он должен иметь здоровые мягкие ткани, минимальную потерю костной массы, а возбудители ППИ должны быть чувствительны к антибиотикам. Двухэтапная обменная артропластика Лечение ППИ с помощью двухэтапной обменной артропластики применяется уже более четырех десятилетий [12]. Первая стадия включает полную резекцию всего инородного материала, очистку окружающих инфицированных мягких тканей и установку пропитанного антибиотиком цементного спейсера. Второй этап включает удаление спейсера и любых дополнительных некротических тканей, тщательное промывание области хирургического вмешательства и установку новых протезных имплантатов. Ранее хроническая ППИ в основном лечилась с помощью двухэтапной обменной артропластики с 4-8-недельным курсом внутривенного введения антибиотиков между двумя этапами [13,14]. Однако эта хирургическая стратегия в настоящее время описывается как начальное лечение некоторых острых послеоперационных или острых гематогенных инфекций. Конкретно, острую инфекцию у пациентов с ослабленным иммунитетом, с высоко устойчивыми штаммами микроорганизмов, таких как Staphylococcus aureus (MRSA), лучше всего лечить с помощью первоначального двухстадийного обмена. Кроме того, в случаях острой ППИ, когда первоначальная попытка более консервативного хирургического лечения, такого как ирригация и санация , или одностадийного обмена не удалась, было показано использование последующих двухстадийных процедур [15]. Двухэтапный метод выгоден по нескольким причинам. Спейсеры не только обеспечивают повышенную стабильность суставов, но также предотвращают сокращение мягких тканей и облегчают процедуры реимплантации. Кроме того цемент с антибиотиком обеспечивает высокую бактерицидную активность непосредственно в месте инфекции, увеличивая внутрисуставную концентрацию антибиотиков, сводя к минимуму системные токсические эффекты парентеральной терапии [14]. Важным фактором при использовании цементных прокладок является включение в цемент специфических антибиотиков [16]. Наиболее часто используемая комбинация антибиотиков в спейсерах представляет собой порошкообразный тобрамицин и ванкомицин в полиметилметакрилатном цементе. На международном уровне используются самые разные соотношения концентраций антибиотиков, но, как правило, для минимизации системных побочных эффектов следует использовать не более 8 г на 40 г цемента. [15,16]. Одним из наиболее спорных аспектов двухэтапной процедуры обмена сегодня является решение между использованием статических и шарнирных прокладок [17]. Хотя в определенных ситуациях, таких как обширные потери костной ткани, использование шарнирных прокладок запрещено. Было показано, что статические прокладки, отлитые вручную, ограничивают диапазон движений колена и функциональность между двумя этапами и могут привести к худшим функциональным результатам после повторной имплантации. У некоторых пациентов с ослабленным иммунитетом, которые не могут переносить процедуру реимплантации, окончательное лечение заканчивается после резекции инфицированного протеза или даже после ампутации пораженной конечности [15]. Для всех остальных должно быть принято решение, когда следует повторно имплантировать новые протезы. К сожалению, до настоящего времени не было создано надежного метода для обеспечения адекватного клиренса инфекции до операции повторной имплантации. Исследование Kusuma SK, 2011 [18] показало, что даже воспалительные маркеры СОЭ и СРБ, а также количество и различие синовиальных лейкоцитов были ненадежными при выявлении персистирующей и леченой инфекции. Поэтому в настоящее время принятой практикой является введение антибиотиков в течение 4-8 недель с последующей суставной аспирацией, затем прекращение приема антибиотиков в течение как минимум двух недель. Жидкость, полученную в результате аспирации, затем культивируют для оценки наличия микроорганизмов. Длительная пероральная антибактериальная терапия Пациенты, которым операция была противопоказана по различным соматическим заболеваниям, может быть назначена длительная антибактериальная терапия без удаления протеза. В одном из исследований [19] среди 18 пациентов, получавших только длительную пероральную терапию без удаления протеза, 15 смогли сохранить протез функциональным. Заключение В настоящее время СОЭ и СРБ являются лучшими доступными скрининговыми тестами для ППИ. Повышение СОЭ и СРБ у конкретного больного требуют дальнейших исследований для диагностики ППИ. В настоящее время двухэтапная обменная артропластика является стандартным методом лечения хронической инфекции. При определенных условиях (здоровые мягкие ткани, минимальную потерю костной массы) возможно одноэтапное ревизионное эндопротезирование.
Микробиологические исследования
Бактериоскопическое и бактериологическое исследования позволяют выявить и идентифицировать возбудителя инфекции, а также определить его чувствительность к антибиотикам. Количественные исследования дают возможность установить число микробных тел в гнойном отделяемом.
Для исследования могут использоваться такие материалы:
- отделяемое из раны;
- образцы ткани;
- жидкость из суставной полости;
- протезный материал.
При имплант-ассоциированной инфекции выявить бактерии в биологических жидкостях и тканях практически невозможно. Патогенные микроорганизмы обнаруживают на самих поверхностях эндопротезов. Они покрывают импланты в виде адгезивной пленки.
Факт! Кроме бактериологического исследования для диагностики могут использовать ПЦР – полимеразную цепную реакцию. Метод имеет высокую чувствительность, но низкую специфичность. Из-за этого он нередко дает ложноположительные результаты.
Лечение
Прежде чем решить, как бороться с инфекцией, врачи тщательно обследуют пациента. Лишь установив диагноз и определив чувствительность патогенной микрофлоры к антибиотикам, они принимают окончательное решение.
Таблица 2. Методы лечения парапротезных инфекций:
| Метод | Показания | Результаты |
| Санация раны с сохранением эндопротеза | Проводится в том случае, когда ИОХВ возникла в первые 3 месяца после операции. Сохранить эндопротез можно лишь при отсутствии гнойных затеков и тяжелых сопутствующих заболеваний. При этом имплант должен быть стабильным, а микрофлора – высокочувствительной к антибиотикам. | Является наименее травматичным методом лечения. По разным данным, эффективность хирургической санации составляет 18-83%. |
| Ревизионное (повторное) эндопротезирование | Одномоментная или двухмоментная замена импланта выполняется в том случае, когда сохранить сустав не представляется возможным. Подобная ситуация наблюдается при нестабильности компонентов эндопротеза, позднем развитии инфекции, низкой чувствительности микрофлоры к антибиотикам, наличии тяжелых соматических заболеваний. | Позволяет полностью справиться с проблемой в 73-94% случаев. К сожалению, в ходе лечения больному приходится полностью менять установленный эндопротез. |
| Артродез с чрезкостным остеосинтезом | Глубокая рецидивирующая парапротезная инфекция, нечувствительная к антибиотикам микрофлора, наличие тяжелой сопутствующей патологии. | В 85% случаев позволяет устранить воспалительный процесс и восстановить опороспособность нижней конечности. |
| Экзартикуляция в тазобедренном суставе | Хроническое рецидивирующее воспаление, угрожающее жизни больного, или полная потеря функции нижней конечности. | Человек безвозвратно теряет ногу. Отсекают ее на уровне тазобедренного сустава. |
Прогноз
Прогноз при парапротезной инфекции в целом благоприятный, но в ряде случаев касательно сохранения функции конечности – сомнительный. Выздоровление наступает:
- при ревизии эндопротеза – у 18-83% больных;
- при повторном протезировании – у 73-94%;
- при выполнении артродеза – у 85%.
Ревизия искусственного сустава и его повторная установка помогают сохранить функции сустава (сгибание, разгибание и так далее), после артродеза такие функции полностью утрачиваются, но опорные возможности сохраняются.
Ковтонюк Оксана Владимировна, медицинский обозреватель, хирург, врач-консультант
6, всего, сегодня
(52 голос., средний: 4,10 из 5)
Костный панариций большого пальца кисти
Сакрализация позвоночника – что это такое, последствия и лечение
Похожие записи
Имплант-сохраняющая тактика
Ее главная цель – устранение инфекционного процесса при одновременном сохранении эндопротеза. Больному проводят хирургическую обработку раны, в ходе которой удаляют гной и некротизированные ткани. При вовлечении в патологический процесс самого сустава выполняют артроскопический дебридмент. Больному назначают массивную антибактериальную терапию.
Любопытно! Научные исследования доказали эффективность безоперационного лечения ранних глубоких инфекций. Как выяснилось, комбинация антибиотиков и ферментных препаратов помогает ликвидировать воспаление за 5-7 дней.