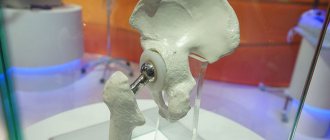
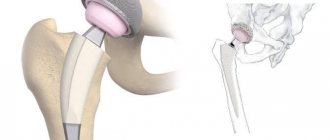
При тяжёлой степени артроза тазобедренного сустава консервативное лечение не даёт желаемого результата. Единственный способ избавить пациента от боли и вернуть его к нормальной физической активности — операция по эндопротезированию тазобедренного сустава.
Как и при любом другом хирургическом вмешательстве, после эндопротезирования тазобедренного сустава могут развиться осложнения. На их возникновение влияют возраст пациента, характер патологии в суставе, сопутствующие заболевания, избыточный вес. Поэтому до начала операции учитываются все возможные причины для сведения к минимуму риска развития осложнений в послеоперационном периоде.
Послеоперационные боли
В первый месяц после эндопротезирования тазобедренного сустава пациент может испытывать боли и дискомфорт. Они могут быть сосредоточены в области операционной раны, распространяться в область колена и пах. Такие боли считаются естественной ответной реакцией организма на операционную травму (разрез кожи, рассечение мышц). Для их купирования (ослабления) пациенту назначаются обезболивающие.
Часто после операции по эндопротезированию тазобедренного сустава у пациентов может болеть поясница. Обычно такие боли возникают при физической активности. Это связано с обострением остеохондроза из-за восстановления длины ранее укороченной конечности и увеличения нагрузки на позвоночник. При правильно проведённых реабилитационных мероприятиях боли в спине после эндопротезирования тазобедренного сустава со временем проходят.
Показания и противопоказания операции
Чтобы операция по замене ТБС прошла качественное и без негативных последствий, хирург устанавливает отсутствие противопоказаний и наличие показаний к эндопротезированию у пациента. Хирургическое вмешательство требуется не при каждой патологии и диагнозе. Часто медики прибегают к консервативной терапии, если это возможно. К тому же эндопротезирование – это довольно сложная и дорогостоящая операция, требующая подготовки от хирурга и пациента.
Основные показания к замене тазобедренного сустава:
- болит тазобедренный сустав, вследствие асептического некроза головки сустава;
- наличие оскольчатых переломов в кости бедра;
- новые переломы и травмы в шейке бедра у пациентов возрастной категории 65+;
- опухоли в шейке или головки бедра;
- остеоартроз суставов, 3-я или 4-я степень заболевания;
- ложные суставы или несросшиеся переломы в тазобедренной кости;
- поражения и разрушения суставов, вследствие заболеваний соединительной ткани: ревматоидный артрит, системная красная волчанка, болезнь Бехтерева.
Есть у операции и определенные противопоказания:
- Психоневрологические заболевания.
- Патологии сердечно-сосудистой системы.
- Туберкулез.
- Остеомиелит в острой или хронической форме.
Послеоперационные осложнения
Несмотря на все мероприятия по предупреждению осложнений, всё же существует риск их возникновения. Они могут развиться при неполном предоперационном обследовании пациента или ошибках оперирующего врача. Однако чаще в возникновении осложнений виноваты неправильный послеоперационный уход и несоблюдение режима физических нагрузок вне стационара.
Одно из наиболее частых осложнений — вывих головки имплантата. Для него характерны усиливающиеся при движении боли, спазм мышц вокруг тазобедренного сустава, вынужденное положение оперированной ноги. Характерными симптомами этого осложнения после эндопротезирования тазобедренного сустава являются хромота и укорочение больной конечности.
При наличии неизлеченного хронического воспалительного процесса в организме больного, есть вероятность развития парапротезной инфекции в тканях, окружающих эндопротез. В дальнейшем она может привести к образованию гнойного свища и развитию остеомиелита. Для воспалительного процесса характерны сильная боль, припухлость и покраснение в области оперированного сустава. Кожа становится горячей на ощупь, у больного поднимается температура.
К тяжёлым осложнениям относится перипротезный перелом бедренной кости. Для него характерны остро возникшая резкая боль, быстро нарастающий отёк, покраснение, хруст при движении и пальпации оперированного участка, деформация ноги и невозможность активных движений.
В ходе операции есть опасность повреждения малого берцового нерва, в результате чего развивается его невропатия. Она характеризуется непостоянными болями различной локализации, слабостью голеностопного сустава, чувством онемения в пальцах ноги и стопе.
Наиболее опасным осложнением является тромбоэмболия легочной артерии, когда оторвавшийся во время операции тромб закупоривает её просвет. У больного резко развиваются одышка, слабость, удушье. Пациент теряет сознание. При неоказании срочных реанимационных мероприятий наступает смерть. Это осложнение встречается достаточно редко.
Зачем нужна замена тазобедренного сустава
Одним из наиболее крупных сочленений в организме человека является именно тазобедренный сустав. При осуществлении повседневных операций на него возлагаются немалые нагрузки. Причина тому – соединение нижних конечностей с тазовой частью.
Сухожилия и мышцы в зоне ТБС сокращаются, за счет чего и выполняются движение. Здоровый сустав позволяет двигаться в любом направлении и плоскости за счет своей мобильности. Такой объем движений обеспечивает сразу несколько функций, важных для человеческого организма:
- ходьба и бег;
- опора;
- прыжки;
- выполнение силовых упражнений, кардионагрузок.
Чтобы провести эндопротезирование сустава, нужны определенные показания. Ими могут стать сильный болевой синдром в области ТБС, разрушение структуры ткани или компонентов сочленения, невозможность выполнять простые движения конечностями. То есть, показаниями к замене ТБС на искусственный протез служит только ситуация, когда он не выполняет свою физиологическую функцию (а также ухудшает качество жизни и самочувствие больного). Тогда именно оперативное вмешательство помогает решить проблему.
Реабилитация после замены тазобедренного сустава
Когда уже выполнена замена тазобедренного сустава, реабилитация сначала начинается в реанимационном отделении. Пациент находится под наблюдением медиков, пока не закончится действие наркоза. Только потом его можно переводить в палату. Спустя несколько часов пациенту помогают вставать с постели, садиться в кресло. Самостоятельно ощущать устойчивость он сможет примерно через 1-2 дня после операции. В это же время можно ходить с поддержкой. В течение реабилитации больной должен принимать назначенные врачом болеутоляющие и противовоспалительные препараты.
После того как закончена замена ТБС, реабилитация составляет от одной недели до десяти дней. Основной целью такой реабилитации является предотвращение осложнений после операции. Также медицинский уход и осмотр нужен для улучшения подвижности установленного протеза.
Кроме того, в первые недели после проведения эндопротезирования медики подключат пациента к легким упражнениям ЛФК. В то же время больной принимает обезболивающие средства и антибиотики. При правильном реабилитационном периоде пациент сможет легко пройти всю реабилитацию после замены ТБС – 3-6 месяцев. За это время он научится с помощью инструктора напрягать мышцы в области лодыжек и бедер. Именно эти упражнения способствуют улучшению притока крови к мышцам, предотвращают отеки и формирование тромбов. Но важно, чтобы они проводились под присмотром опытного инструктора-методиста программы ЛФК.
ПОЛИТРАВМА / POLYTRAUMA
Егиазарян К.А., Сиротин И.В., Ратьев А.П., Коробушкин Г.В., Лазишвили Г.Д., Бут-Гусаим А.Б.
Российский национальный исследовательский медицинский университет имени Н.И. Пирогова, г. Москва, Россия
АСЕПТИЧЕСКАЯ ЛИМФОРЕЯ ПОСЛЕ ЭНДОПРОТЕЗИРОВАНИЯ ТАЗОБЕДРЕННОГО СУСТАВА
Одним из осложнений после эндопротезирования тазобедренного сустава является длительное незаживление раны с продолжающимся отделяемым. Часто при выявлении подобной ситуации хирургами принимаются меры воздействия, имеющие в ряде случаев прямо противоположные направления – от консервативного ведения ран до агрессивной оперативной тактики с ревизией установленного сустава вплоть до замены его компонентов. Такая разница в подходах связана с недостаточно проработанным алгоритмом действия при наличии длительного незаживления раны без наличия явных признаков развития инфекции. Существует мнение, что в ряде случаев причиной такой ситуации является повреждение в ходе операции лимфатических сосудов и узлов с возникновением лимфореи. Вместе с тем в специализированной литературе травматолого-ортопедического профиля нам не удалось найти работы, посвященные тактике ведения подобных больных, причем не только при эндопротезировании тазобедренного сустава, но и при других типах профильных операций. Кроме этого, даже упоминание о лимфорее как отдельном специфическом осложнении приводится только в ограниченном числе публикаций. Вместе с тем в процентном соотношении лимфорея после эндопротезирования тазобедренного сустава не так уж редка. Так, Ткаченко и соавт. [1] сообщают о проявлении лимфореи в качестве осложнения данного типа операции в 0,5 % случаев. Кроме этого, Mayer et al. отмечает, что среди всех случаев лимфореи более 17 % приходится на лимфорею именно после артропластики тазобедренного сустава [2]. Тем не менее, во многих работах длительное отделяемое из послеоперационной раны часто связывают с инфекционным процессом [3]. В данной статье мы попытались обобщить сведения о феномене лимфореи и возможной тактике ведения подобных больных в случае развития подобного осложнения в результате артропластики тазобедренного сустава.
Терминология и анатомические предпосылки
Лимфоре́я (lymphorrhoea; Лимфа + греч. rhoia течение, истечение; синоним лифоррагия lymphorrhagia; Лимфо + греч. rhagos прорванный, разорванный) истечение лимфы на поверхность или в полости тела вследствие повреждения или заболевания лимфатических сосудов [4]. Как осложнение оперативных вмешательств лимфорея в достаточной степени встречается в практике врачей-хирургов. Лимфорея при повреждении паховых лимфатических узлов нередко встречается после удаления вен, а также радикальной лимфоаденэктомии при онкологических поражениях данной области (операции по Ducuing и по Школьнику). Особенностью данных оперативных вмешательств является частичное непреднамеренное повреждение или субтотальное удаление лимфоузлов и лимфатических протоков из области бедренного треугольника. Бедренный треугольник – топографическое образование, ограниченное сверху (основание треугольника) паховой связкой lig. inguinale, снаружи портняжной мышцей m. sartorius, изнутри длинным аддуктором m. adductor longus. Дно треугольника, называемое подвздошногребенчатая ямка fossa iliopectinea, образовано подвздошнопоясничной и гребенчатой мышцей mm. iliopsoas et pectineus [5]. В данной области расположена группа лимфатических протоков, образующих переднемедиальный лимфатический коллектор, а также группа поверхностных и глубоких лимфатических узлов. Последние расположены под широкой фасцией бедра непосредственно на mm. iliopsoas et pectineus, а впадающие в них лимфатические сосуды уходят далеко в область ягодичных мышц. Интересным является соотношение осложнений со стороны послеоперационной раны при выполнении ангиохирургических вмешательств в данной области. Так, по данным Шевченко, около 90 % (!) осложнений после флебэктомии составляют лимфогематомы [6]. Конечно, возвращаясь к эндопротезированию, можно с уверенностью отметить то, что такие операции выполняются в несколько иной анатомической зоне. Этим можно объяснить существенно более редкую частоту подобных осложнений при эндопротезировании тазобедренного сустава, тем не менее, не исключая возможность повреждения глубоких паховых лимфатических узлов и сосудов, расположенных непосредственно на m. iliopsoas. В ходе доступа к вертлужной впадине, ее экспозиции, иссечении или рассечении капсулы сустава, удалении центрального и передних остеофитов при артрозе данная мышца визуализируется в ране, а значит, может быть повреждена, равно как и другие анатомические структуры, расположенные в непосредственной близости от нее. В исследовании Малинина и соавт. выполнялась контрастная лимфография в области бедра и паховой области [7]. На рисунке видно расположение переднемедиального лимфатического коллектора, состоящего из 14-16 лимфатических сосудов, последовательно впадающих в паховые лимфатические узлы. Обращает на себя внимание расположение значительной части этих сосудов в значительной близи от вертлужной впадины, что опять же допускает теоретическую возможность их повреждения (рис.).
Рисунок. Прямая контрастная лимфорея через левую нижнюю конечность: левая паховая и подвздошная области, переднемедиальный лимфатический коллектор представлен 14-16 лимфатическими сосудами, последовательно впадающими в паховые лимфатические узлы (по А.А. Малинич, С.И. Прядко, М.С. Джабаева. Диагностика и лечение гемохилоперитонеума при хилезных мальфорациях с гравитационным рефлюксом хилуса в висцеральные органы)
Диагностика
Сложности при диагностике и дифференциальной диагностике лимфореи связаны в первую очередь с тем, что, по сложившимся в настоящий момент в оперативной ортопедии представлениям, большинство проблем с незаживлением ран и длительным сохранением раневого отделяемого считается проявлением развития инфекционного процесса. Так, Zimmerli и соавт. определяют длительное раневое отделяемое как подозрение на инфекцию, по поводу которого рекомендуется выполнение ревизии послеоперационной раны не позднее 3 недель с момента появления симптомов [8]. Такой подход абсолютно оправдан при подозрении на инфекционный генез осложнения. Но в случае принятия предположения, что характер отделяемого носит характер асептической лимфореи, – по мнению ряда исследователей – начинать следует с консервативных мероприятий [9]. Подобный подход импонирует снижением общих затрат на лечение больного и риска при повторном оперативном вмешательстве. Клиническая картина лимфореи при повреждении переднемедиального коллектора подробно описана в различных исследованиях, посвященных осложнениям после удаления вен при варикозной болезни нижних конечностей, удалении паховых лимфоузлов при онкологических операциях. В типичных случаях лимфорея начинается в области послеоперационной раны на 4-7-е сутки после операции, характеризуется отделением светлой жидкости с возможным розовым оттенком за счет примеси эритроцитов. Отделяемое может быть постоянным или периодическим с различными интервалами. Это связано с формированием «ложного лимфоцелле» – полости, заполненной лимфой. Также формируются лимфатические инфильтраты – пропитывание мягких тканей лимфой, их уплотнение и натяжение кожи [10]. На ранних этапах лимфореи важным моментом в диагностике является подтверждение происхождения экссудата, дифференциальная диагностика с лизированной гематомой. По химическому и клеточному составу периферическая лимфа в лимфатических сосудах конечностей (состав лимфы в отличие от плазмы не всегда однороден и может существенно отличаться в зависимости от уровня лимфатического сосуда) существенно отличается от плазмы. Тем не менее, в доступной нам литературе нет единого мнения в отношении ее качественного состава [11-14]. По всей видимости, это связано с высокой изменчивостью состава лимфы в норме и патологии. Однако во всех исследованиях лимфа – это прозрачная светло-желтая жидкость, менее плотная и с не менее чем двукратно меньшим содержанием белка относительно состава плазмы. Клеточный состав представлен преимущественно белыми клетками крови в количестве от 500 до 75 000 в мл. Эти особенности могут помочь при проведении дифференциального диагноза между отделением лимфы при лимфорее и плазмы при отхождении лизированной гематомы. Учитывая возможность образования полостей, заполненных лимфой, важное значение имеет ультразвуковое исследование с определением размеров полости, характера ее содержимого и возможностью выполнения пункции под контролем ультразвука с последующим анализом экссудата. При лимфорее и «ложном лимфоцелле» клеточный и химический состав будет соответствовать структуре лимфы, а бактериологический посев будет отрицательным [15-17]. Также для уточнения диагноза возможно применение магнито-резонансной томографии, которая не только поможет точно определить локализацию и объем полости, но и позволит определить характер экссудата – серозный, геморрагический или гнойный [18, 19].
Профилактика и лечение
В отличие от лимфореи, возникающей после флебэктомий в дистальных отделах конечности и самостоятельно купирующейся в течение 10-15 суток, лимфорея при повреждении структур переднее-медиального лимфатического коллектора без адекватной терапии склонна к длительному течению, формированию «истинного лимфоцелле» (полость «ложного лимфоцелле» обрастает фиброзной капсулой, которая препятствует ее спаданию и зарастанию) и лимфатических свищей [10]. Эти осложнения способны привести к развитию вторичного инфицирования раны [20] и, уже как следствие – к развитию перипротезной инфекции. При выполнении хирургических операций, традиционно сопровождающихся лимфореей в послеоперационном периоде, применяются различные методы профилактики. Особенно данные мероприятия целесообразны у пациентов с высоким уровнем содержания в плазме интерлейкина-1. Такие пациенты более склонны к образованию сером [21]. Положительным для снижения объема послеоперационной лимфореи может являться предоперационное введение метилпреднизолона [22]. Agrawal для профилактики лимфореи рекомендует использование вместо традиционного электрического каутера ультразвуковой скальпель [23]. Положительные отзывы исследователей вызывает местное применение тромбина, а также фибринового и тромбинового клеев [24, 25]. В работе Oertli показано, что применение транексамовой кислоты, помимо снижения кровопотери, снижает объем послеоперационной лимфореи [26]. Важным с точки зрения развития данного осложнения может оказаться и нутритивный статус пациента – пониженное содержание в плазме белка способствует развитию лимфореи [21]. При отсутствии достоверных признаков инфекции традиционно лечение лимфореи начинают с консервативных мероприятий с применением эластической компрессии, давящих повязок [9]. Для лечения лимфореи, возникающей после общехирургических вмешательств также рекомендуется применение УВЧ, что сомнительно в случае лимфореи после эндопротезирования по причине наличия металлоимпланта. Назначается диета с пониженным содержанием жиров [27]. Популярными методиками при неэффективности эластической компрессии являются пункция лимфоцелле под контролем ультразвука с последующим наложением давящих повязок, введение через лимфатические свищи препаратов местного действия, например, мазь «Левомиколь», 1% раствор йода, обладающий склерозирующим эффектом [10], а также препарата 5-фторурацил [28]. Одним из эффективных методов в лечении лимфореи является применение лучевой терапии. Mayer сообщает об эффективном применении низких доз излучения от 0,3 до 0,5 Гр для купирования лимфореи [2]. Применение лучевой терапии не рекомендуется более 3 недель при отсутствии эффекта [20]. Применение VAC-терапии также может быть эффективным для закрытия лимфатических фистул. Целесообразная продолжительность вакуумирования, по мнению Abai, составляет 14 дней [29]. Однако для достижения оптимального эффекта некоторыми авторами рекомендуется длительное применение вакуумной терапии – от 4 недель до 2 месяцев [30]. При неэффективности консервативных мероприятий необходимо выполнять оперативное вмешательство. Из всего многообразия оперативных вмешательств при паховой лимфорее отметим лишь те, что, по нашему мнению, являются возможными и целесообразными при установленном эндопротезе тазобедренного сустава. Для выполнения ушивания лимфатических сосудов рекомендовано проведение ревизии послеоперационной раны и лигирование обнаруженных в ране поврежденных лимфатических сосудов. Для их визуализации в кожу первого межпальцевого промежутка вводится витальный краситель (синий Эванса или индигокармин) за 1 час до операции [9]. Возможно применение метода Введенского, когда лимфатические сосуды перевязываются на уровне медиального мыщелка бедра, где располагаются в проекции большой подкожной вены [31]. В качестве красителя рекомендованы к применению также метиленовый синий и индоциан зеленый [32]. В качестве метода визуализации перед следующим вариантом операции – микрохирургическим созданием лимфовенозного анастомоза – наряду с окрашиванием целесообразно использовать магниторезонансную лимфоангиографию, которая позволяет точно определить локализацию повреждения [33]. Здесь хотелось бы отметить, что, по нашему мнению, методики визуализации лимфатических сосудов, связанные с их окрашиванием путем введения красителей в дистальные отделы лимфатических сосудов, могут быть не в полной мере актуальны для лимфореи после эндопротезирования тазобедренного сустава. Это связано с тем, что нельзя полностью исключать повреждение лимфатических коллекторов, несущих лимфу к паховым лимфоузлам от более краниально расположенных областей.
ЗАКЛЮЧЕНИЕ
По нашему мнению, проблема лимфореи после эндопротезирования тазобедренного сустава заслуживает пристального внимания. Во многом длительное незаживление раны может быть связано с развитием этого осложнения, а излишне агрессивная оперативная тактика, направленная на санацию раны, может, наоборот, лишь спровоцировать усиление лимфореи. Вместе с тем нерешительность при выполнении ранней ревизии послеоперационной раны в случае подозрения на инфекцию может привести к усугублению ситуации и потере эндопротеза. Поэтому, как нам кажется, важным шагом является разработка четких критериев не только для определения септического процесса в ране, но и для подтверждения его асептического течения.
Информация о финансировании и конфликте интересов:
Исследование не имело спонсорской поддержки. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
ЛИТЕРАТУРА:
1. Tkachenko AN, Tkachenko AN, Lapshinov EB et al. Features of hip joint replacement in adult patients. Fundamental Researches. 2011; (10): 162-165. Russian (Ткаченко А.Н., Ткаченко А.Н., Лапшинов Е.Б.,и др. Особенности эндопротезирования тазобедренных суставов у больных старших возрастных групп // Фундаментальные исследования. 2011. № 10. C. 162-165) 2. Mayer R, Sminia P, McBride WH et al. Lymphatic fistulas: obliteration by low-dose radiotherapy. Strahlenther Onkol. 2005; 181(10): 660-664 3. Vinkler T, Trampush A, Rents N, Perka K, Bozhkova SA. Classification and the treatment and diagnostic algorithm for hip joint periprosthetic infection. Traumatology and Orthopedics of Russia. 2016; 1(79): 33-45. Russian (Винклер Т., Трампуш А., Ренц Н., Перка К., Божкова С.А. Классификация и алгоритм диагностики и лечения перипротезной инфекции тазобедренного сустава // Травматология и ортопедия России. 2021. № 1(79). C. 33-45) 4. Small medical encyclopedia. M.: Medical Encyclopedia 1991-1996. Russian (Малая медицинская энциклопедия. М.: Медицинская энциклопедия. 1991-1996 гг.) 5. Prives MG, Lysenkov NK, Bushkovich VI. Human Anatomy. M.: Hippocrates, 1998. 704 p. Russian (Привес М.Г., Лысенков Н.К., Бушкович В.И. Анатомия человека. М.: Гиппократ, 1998. 704 с.) 6. Errors, hazards and complications in venous surgery: the manual for physicians / edited by Shevchenko YuL. St. Petersburg: PiterCom, 1999. 320 p. Russian (Ошибки, опасности и осложнения в хирургии вен: руководство для врачей / под редакцией Ю.Л. Шевченко. СПб.: ПитерКом, 1999. 320 с.) 7. Malinin AA, Pryadko SI, Dzhadaeva MS. Diagnosis and treatment of hemochyloperitoneum in chylous malformations with gravitation reflux of chyle into visceral organs // Herald of Lymphology. 2014; (1): 29-34. Russian (Малинин А.А., Прядко С.И., Джабаева М.С. Диагностика и лечение гемохилоперитонеума при хилезных мальфорациях с гравитационным рефлюксом хилуса в висцеральные органы // Вестник лимфологии. 2014. № 1. С. 29-34) 8. Zimmerli W, Trampuz A, Ochsner PE. Prosthetic-joint infections. N Engl J Med. 2004; 351(16): 1645-1654 9. Sushkov SA. Complications of surgical treatment of varicose disease of lower extremities. News of Surgery. 2008; 1 (16): 140-151. Russian (Сушков С.А. Осложнения при оперативном лечении варикозной болезни нижних конечностей // Новости хирургии. 2008. № 1(16). С. 140-151) 10. Albamasov KG, Malinin AA. Pathogenesis and management of lymphorrhea and lymphocele after vascular surgery of lower extremities. Surgery. 2004; (3): 23-30. Russian (Албамасов К.Г., Малинин А.А. Патогенез и тактика лечения лимфореи и лимфоцеле после сосудистых операций на нижних конечностях // Хирургия. 2004. № 3. С. 23-30) 11. Zhdanov DA. General anatomy and physiology of lymphatic system. Leningrad: Medgiz. Leningrad department, 1952. 336 p. Russian (Жданов Д.А. Общая анатомия и физиология лимфатической системы. Ленинград: Медгиз. Ленингр. отделение, 1952. 336 с.) 12. Rusznyák İ, Földi M, Szabó G. Lymphatics and Lymph Circulation, 2nd ed. Oxford, 1967 13. Pérez-de la Fuente T, Sandoval E, Alonso-Burgos A, García-Pardo L, Cárcamo C, Caballero O. Knee Lymphocutaneous Fistula Secondary to Knee Arthroplasty. Case Reports in Orthopedics. Volume 2014, Article ID 806164, 4 pages. URL: https://dx.doi.org/10.1155/2014/806164 14. Zavarzin AA, Rumyantsev AA. Course of histology. M., 1946. P. 421-424. Russian (Заварзин А.А., Румянцев А.А. Курс гистологии. М., 1946. С. 421-424) 15. Korneev KV. Modern directions of prevention of lymphorrhea in patients with breast cancer after radical mastectomy (literature review). Herald of Russian Scientific Center of X-ray Radiology. 2012. Mode of approach: https://vestnik.rncrr.ru/vestnik/v12/papers/korneev_v12.htm Russian (Корнеев К.В. Современные направления профилактики лимфореи у больных раком молочной железы после радикальных мастэктомий (обзор литературы) // Вестник РНЦРР МЗ РФ. 2012 Режим доступа: https://vestnik.rncrr.ru/vestnik/v12/papers/korneev_v12.htm) 16. Cihangir Ozaslan, Kerim Bora Yilmaz et al. Effect of mechanical closure of dead space on seroma formation in modified radical mastectomy. Turk j of med Sci. 2010; 40(5): 751-755 17. Katsuma Kuroi, Kojiro Shimozuma, Tetsuya Tagichi et al. Pathophysiology of seroma in breast cancer. Breast Cancer. 2005; 12(4): 34-39 18. Mazzocchi M, Dessy LA, Corrias F. A clinical study of late seroma in breast implantation surgery. Aesthetic and Plastic Surgery. 2011; 34: 53-60 19. Oliveira VM, Junior DR, Lucas F, Lucarelli A. Late seroma after breast augmentation with silicone prostheses: a case report. The Breast Journal. 2007; 12(3): 421-423 20. Konstantinova GD, Zubarev AR, Gradusov EG. Phlebology. M.: Vidar, 2000. 160 p. Russian (Константинова Г.Д., Зубарев А.Р., Градусов Е.Г. Флебология. М.: Видар, 2000. 160 с.) 1. Klink CD, Binnebosel M, Lucas AH, et al. Serum analyses for protein, albumin, and IL-1RA serve as reliable predictors for seroma formation after incisional hernia repair. Hernia. 2011; 15: 69-73 22. Okholm M, Axelsson CK. No effect of steroids on seroma formation after mastectomy. Dan Med Bul. February. 2011; 58(2): 1-5 23. Agrawal A, Abiodun A, Kwok Leung Cheung. Concepts of seroma formation and prevention in breast cancer surgery. ANZ Journal of Surgery. 2006; (76): 1088-1095 24. Jamal Bullocks, Bob Basu, Patrick Hsu et al. Prevention of hematomas and seromas. Semin Plast. Surg. 2006; 20: 233-240 25. Johnson L, Cusick T, Helmer S, Osland J. Influence of fibrin glue on seroma formation after breast surgery. Am J Surg. 2005; 189(3): 319-323 26. Oertli D, Laffer U, Haberthuer F, Kreuter U, Harder F. Perioperative and postoperative tranexamic acid reduces the local wound complication rate after surgery for breast cancer. Br J Surg. 1994; (81): 6: 856-859 27. Marts BC, Naunheim KS et al. Conservative versus surgical management of chylothorax. AMJ surg. 1992; 164: 532-535 28. Kocdor MA, Kilic Yildiz D, Kocdor H, et al. Effects of locally applied 5-Fluorourarcil on the prevention of postmastectomy seromas in a rat model. Eur surg res. 2008; 40: 256-262 29. Abai B, Zickler RW, Pappas PJ, Lal BK, Padberg FT Lymphorrhea responds to negative pressure wound therapy. Journal of Vascular Surgery. 2007; 45(3): 610-613 30. Greer SE, Adelman M, Kasabian A., Galiano RD, Scott R, Longaker MT. The use of subatmospheric pressure dressing therapy to close lymphocutaneous fistulas of the groin. British Journal of Plastic Surgery. 2000; 53(6): 484-487 31. Vedenskiy AN. Varicose disease. L.: Medicine, 1983. 208 p. Russian (Веденский А.Н. Варикозная болезнь. Л.: Медицина,1983. 208 с.) 32. Azuma R, Takikawa M, Nakamura S, Sasaki K, Yanagibayashi S, Yamamoto N, et al. Indocyanine green fluorography in Plastic Surgery and Microvascular Surgery. The Open Surgical Oncology Journal. 2010; 2: 48-56 33. Lohrmann C., Foeldi E, Langer M. Lymphocutaneous fistulas: pre-therapeutic evaluation bymagnetic resonance lymphangiography. British Journal of Radiology. 2011; 84 (1004): 714-718
Статистика просмотров
Загрузка метрик …
Ссылки
- На текущий момент ссылки отсутствуют.