МРТ диагностика синовиальных складок коленного сустава
Филистеев Павел Анатольевич, заведующий отделением МРТ диагностического центра MED-7, врач отделения рентгеновской диагностики и томографии ФГБУ «Центральная клиническая больница с поликлиникой » Управления делами Президента РФ
Синовиальные складки коленного сустава являются частью его нормальной анатомии и иногда способны вызывать клинические проявления. Магнитно-резонансная томография (МРТ) и МР-артрография позволяют неинвазивно оценить состояние синовиальных складок, провести дифференциальную диагностику причины болевого синдрома в коленном суставе. Синовиальные складки на МР-изображениях выглядят как линейные гипоинтенсивные тяжи на фоне окружающей жидкости и жира. Т2- и протонно-взвешенные импульсные последовательности с подавлением МР-сигнала от жировой ткани признаны оптимальными для визуализации синовиальных складок.
Синдром синовиальных складок (ССС) сопровождается болезненностью в области коленного сустава и нарушением его функции, и должен рассматриваться клиницистами и рентгенологами в качестве одного из возможных диагнозов. Диффузно утолщенная складка, обычно на фоне проявлений локального синовита и эрозий суставного хряща, — наиболее частые проявления ССС. Лечение синдрома синовиальных складок заключается в консервативном ведении пациента на первом этапе, при неэффективности проводят артроскопическую резекцию патологической складки.
Введение
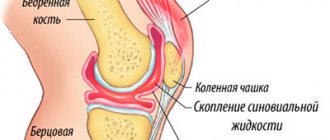
Складка коленного сустава представляет собой дупликатуру синовиальной оболочки, выстилающей полость сустава. Структура синовиальных складок тонкая, пленчатая, с зонами васкуляризации. С эмбриогенетической точки зрения складки являются частично рудиментированными синовиальными мембранами и обнаруживаются в коленных суставах здоровых людей. Точная функция синовиальных складок неизвестна. Ряд авторов считает, что синовиальные складки подобно глазным векам способствуют улучшению смазки сустава синовиальной жидкостью.
В случаях прямой травмы коленного сустава, при повторяющихся нагрузках или воспалительном процессе могут возникать клинические симптомы, обусловленные механическим воздействием складок на другие внутрисуставные структуры. В частности, при движении утолщенная и фиброзированная синовиальная складка вызывает раздражение синовиальной оболочки по краям мыщелков костей, что в конечном итоге приводит к реактивному синовиту и истончению суставного хряща (синдром синовиальной складки — ССС).
Наиболее часто возникают изменения медиопателлярной складки, однако точная оценка распространенности ССС затруднена по причине отсутствия четких критериев диагностики.
На МРТ интактные синовиальные складки представляют собой тонкие гипоинтенсивные линейные структуры, исходящие из синовиальной выстилки. Их визуализация значительно улучшается при наличии жидкости в суставе (суставного выпота, крови или контрастного препарата при проведении МР-артрографии).
Основные симптомы
При синовите чаще всего поражается только один сустав, но иногда болезнь носит и множественный характер.
Главными симптомами синовита можно считать:
- увеличение в объеме и сглаживание контуров сустава;
- болевые ощущения при нагрузке;
- выраженный отек мягких тканей;
- затрудненные движения;
- кожную гиперемию;
- озноб и общее недомогание.
Если говорить об инфекционном синовите, то он практически всегда начинается остро: пациент чувствует сильную пульсирующую боль, а температура тела резко поднимается. Через некоторое время коленный сустав отекает, появляются признаки общей интоксикации организма: слабость, сонливость, головная боль, тошнота и даже рвота.
Неинфекционная форма развивается достаточно медленно. Сначала воспаляется синовиальная мембрана, которая выстилает суставную сумку изнутри, а также продуцирует синовиальную жидкость (синовию). Первый признак – ощущение дискомфорта в области пораженного коленного сустава, а также боль при нагрузке. Постепенно появляются отеки, а болезненные ощущения нарастают.
Если обнаружили у себя такие симптомы, то не занимайтесь самолечением, а срочно записывайтесь к врачу.
Эмбриогенез
В настоящее время распространено мнение, что коленный сустав первоначально состоит из трех отсеков – медиального, латерального и супрапателлярного, разделенных синовиальными перегородками. Неполное рассасывание этих перегородок приводит к формированию хорошо развитых синовиальных складок, занимающих пространство между дистальными отделами эпифиза бедренной кости и проксимальными отделами большеберцовой кости. Внутриутробное движение в коленном суставе у плода может одновременно способствовать рассасыванию складок и формированию полости сустава. Эта теория позволяет объяснить наличие супрапателлярной и инфрапателлярной складок, но безосновательна для латеральной и медиальной складок, так как пателло-феморальный сустав ни на одном из этапов эмбриогенеза не разделен на полости в плоскости этих складок (то есть, во фронтальной). Эмбриологические работы S. Ogata и H.K. Uhthoff показали, что медиопателлярнная складка не является остатком синовиальной перегородки. Вероятно, она имеет мезенхимальное происхождение и связана с внутриутробной латерализацией надколенника, о чем говорит преобладание мезенхимы именно в медиопателлярной зоне.
В литературе нет точных данных о распространенности этих персистирующих эмбриологических структур в популяции. В анатомическом исследовании коленных суставов T. Jouanin с соавт. в 11% случаев присутствовали три основные складки, в 10% — не было выявлено ни одной складки. Супрапателлярная и инфрапателлярная складки встречаются наиболее часто, но обычно клинически интактны. Латеральная складка коленного сустава встречается крайне редко. Из-за клинических проявлений, на сегодняшний день наиболее изученной является медиопателлярная складка.
Возможности МРТ в диагностике синовиальных складок
Синовиальные складки на МР-изображениях выглядят как гипоинтенсивные тяжи на фоне жидкости и жира по периферии. Наиболее информативными импульсными последовательностями в диагностике синовиальных складок из-за высокого сигнала от жидкости признаны градиентные Т2-взвешенные импульсные последовательности, а также Т2- или протонно-взвешенные последовательности с использованием жироподавления. МР-артрография применима в случае недостаточного количества внутрисуставной жидкости и наличии выраженных клинических симптомов манифестирующей складки. Контрастный агент обеспечивает высокий межтканевой контраст суставных поверхностей, растягивает капсулу сустава, что в совокупности помогает визуализировать все складки коленного сустава, верифицировать или исключить их патологические изменения.
Размеры и морфологическая перестройка синовиальных складок не являются достоверным признаком их клинической значимости. При наличии стойких клинических симптомов и отсутствии других возможных причин похожего симптомокомплекса (например, повреждения медиального мениска или внутренней боковой связки, пателло-феморального артроза, артроз медиальных отделов сустава) характерными признаками синдрома патологической складки является локальный синовит, эрозии суставного хряща надколенника и пателлярной поверхности бедренной кости.
Возможные побочные явления
Данное инновационное изобретение, несмотря на малоинвазивность и высокую степень безопасности, не лишено побочного действия. Негативные реакции протезы аналоговой синовиальной жидкости, часто назначаемые при артрозах коленного сустава, вызывают редко. Но их нельзя назвать полностью безвредными, хотя бы потому, что основная категория продукции, которая реализуется фармацевтическими компаниями, не подвергалась клиническим испытаниям.
На основании минимальной экспериментально-клинической базы данных и личного опыта пациентов, которые столкнулись с проблемами после внутрисуставного применения гиалуроновой кислоты, были сделаны выводы о возможной вероятности развития следующих последствий:
- ощущение жара, зуда в месте укола;
- жжение и раздражение кожных покровов;
- крапивная лихорадка;
- припухлость и покраснение мягких надсуставных тканей;
- болезненные признаки в близлежащих мышцах;
- местная инфекционно-воспалительная реакция;
- онемение, покалывание, чувство «ползания мурашек» в конечности;
- анафилактический шок.
Как видим, при всех своих положительных качествах инновационные препараты, выпускаемые как «синовиальная жидкость», могут и навредить здоровью. Эффективность тоже на 100 % не гарантируется. Не стоит забывать, что каждый организм имеет свои индивидуальные характеристики, поэтому абсолютной гарантии благополучного исхода нет. Кроме того, маловероятно, что такие лечебные мероприятия дадут результат при патофункциональных изменениях суставных элементов на терминальных стадиях. Отсюда вывод: далеко недешевое лечение вполне может оказаться безрезультативным.
Супрапателлярная складка
В литературе существует несколько синонимов супрапателлярной складки: супрапателлярная перегородка, верхняя складка, надколенниковая складка.
Супрапателлярная складка локализована между супрапателлярной сумкой и полостью коленного сустава, имеет косо-нисходящий ход, начинаясь от синовиальной оболочки на передней поверхности метафиза бедра и заканчиваясь в области задней части сухожилия четырехглавой мышцы в зоне прикрепления к надколеннику. До конца 4 месяца внутриутробного развития плода супрапателлярная складка полностью отделяет полость коленного сустава от супрапателлярной сумки, а уже к концу 5 месяца ее форма не отличается от таковой у взрослого человека.
Считается, что ключевым фактором, обеспечивающим степень редукции складки, является механический. В зависимости от объема движений в коленном суставе может сформироваться как небольшая перфорация в складке, так и ее частичное или полное отсутствие. T. Zidorn классифицировал степень «развития», или более точно – редукции, супрапателлярной складки на 4 группы в зависимости морфологических особенностей:
МР-томограмма коленного сустава в Т2 В.И., сагиттальная плоскость
- тип I (septum completum) – замкнутая супрапателлярная сумка — супрапателлярная складка полностью отделяет надколенниковый карман от полости коленного сустава;
- тип II (septum perforatum) – супрапателлярная складка имеет одно или несколько отверстий, связывающих супрапателлярную зону с полостью сустава;
- тип III (septum residuale) – визуализируется остаточный соединительнотканный тяж, чаще с внутренней стороны;
- тип IV (septum extinctum) – характерна полная инволюция супрапателлярной складки.
При II типе складки зоны ее перфорации, обеспечивающие циркуляцию суставной жидкости в область заворота, получили название ворот.
Супрапателлярная складка персистирует очень часто – до 89% случаев по данным аутопсий. При МРТ коленного сустава складка лучше всего определяется в сагиттальной плоскости как линейный гипоинтенсивный тяж, кзади и сверху от надколенника.
При артроскопии полностью нередуцированную супрапателлярную складку можно заподозрить только по уменьшению объема супрапателлярного кармана. Иногда диагноз устанавливается случайно при пункции сустава, когда инъекционная игла оказывается в супрапателлярной сумке, а не в полости сустава.
Жидкие имплантаты: цена и аналоги
Прежде чем мы перечислим наиболее часто применяемые средства ГК, предназначенные для интраартикулярного введения, обратим внимание на важный момент: все терапевтические манипуляции должны осуществляться сугубо высококомпетентным врачом в отделении ревматологии, с соблюдением всех асептических норм. Кроме того, в техническом плане данная процедура полностью отличается от внутримышечных инъекций, поэтому только профессиональный медицинский работник сможет обеспечить правильное, нетравматичное и безопасное вхождение иглы в суставную сумку. Сеанс проводят под контролем УЗИ.
Аналоги Synvisc
| Наименование продукта | 1 доза ГК /мг | Производство |
| Адант | 25 | Япония |
| Ферматрон | 20 | Великобритания |
| Гиалган Фидия | 20 | Индия |
| Синокорм | 20 | Австрия |
| Гоу-он | 25 | Ирландия |
| Остенил | 20 | Германия |
| Гируан Плюс | 10 | Корея |
| Синвиск (3 шприца) | 16 | США |
| Гиалуром CS | 60 | Румыния |
| Виско Плюс | 20 | Швеция |
| РусВиск | 16 | Россия |
| Гиастат | 20 | Россия |
Инфрапателлярная складка
Инфрапателлярная складка, или ligamentum mucosum – самая распространенная складка коленного сустава. Ее формирование происходит с 8 по 12 неделю гестации и зависит от степени инволюции примитивной эмбриональной мембраны, разделяющей медиальные и латеральные отделы сустава. Форма складки легла в основу ее артрокопической классификации S. Kim and W. Choe:
- 0 — отсутствие складки;
- 1 — полная персистенция складки, складка отделена от передней крестообразной связки;
- 2 — полная персистенция складки, складка отделена от передней крестообразной связки и имеет несколько пучков;
- 3 — вертикальная складка – полная персистенция складки, которая связана с передней крестообразной связкой, делит полость сустава на медиальный и латеральный отделы;
- 4 — фенестрированная вертикальная складка — вертикальная складка с отверстием/дефектом.
Инфрапателлярная складка начинается в передних отделах межмыщелкового углубления бедренной кости, расширяется вперед и вниз, прикрепляется к нижнему полюсу надколенника. Толщина складки широко варьирует от субмиллиметровой вплоть до размера передней крестообразной связки.
Инфрапателлярную складку легко обнаружить на сагиттальных МР-томограммах, как линейную гипоинтенсивную структуру, идущую через жировое тело Гоффа в плоскости, параллельной передней крестообразной связке. В ряде случаев, особенно у пациентов с полным разрывом передней крестообразной связки, хорошо развитая инфрапателлярная складка может симулировать ее сохраненные пучки. Также необходимо проводить дифференциальную диагностику инфрапателлярной складки с локальным узелковым синовитом, послеоперационными изменениями и свободным телом в области жировой подушки Гоффа. Осведомленность врачей-рентгенологов о существовании данной анатомической структуры позволяет в большинстве случаев поставить правильный диагноз.
Услуги ортопедии и травматологии в ЦЭЛТ
Администрация АО «ЦЭЛТ» регулярно обновляет размещенный на сайте клиники прейскурант. Однако во избежание возможных недоразумений, просим вас уточнять стоимость услуг по телефону: +7
| Название услуги | Цена в рублях |
| Прием врача хирургического профиля (первичный, для комплексных программ) | 3 000 |
| МРТ локтевого сустава (1 сустав) | 7 000 |
| УЗИ мягких тканей, лимфатических узлов (одна анатомическая зона) | 2 300 |
Все услуги
Запишитесь на прием через заявку или по телефону +7 +7 Мы работаем каждый день:
- Понедельник—пятница: 8.00—20.00
- Суббота: 8.00—18.00
- Воскресенье: выходной
Ближайшие к клинике станции метро и МЦК:
- Шоссе энтузиастов или Перово
- Партизанская
- Шоссе энтузиастов
Схема проезда
Медиопателлярная складка
Медиопателлярную складку также называют медиальной складкой, синовиальной надколенниковой складкой, крыловидной складкой, пателлярным мениском, синовиальным выступом. Медиопателлярная складка начинается в области медиальной стенки коленного сустава, идет косо вниз и вплетается в синовий вокруг жирового тела Гоффа. Она может соединяться с супрапателлярной складкой, но чаще имеет раздельное прикрепление. В случае избыточного развития, медиопателлярная складка может распространяться на медиальную поверхность блока бедерной кости и медиальную фасетку надколенника.
МР-томограммы, аксиальная плоскость, протонно-взвешенный режим с подавлением сигнала от жировой ткани
J. Sakakibara, основываясь на форме и величине, выделил 4 типа медиопателлярной складки:
- тип А – складка представлена линейным жгутообразным выпячиванием синовиальной стенки;
- тип B – складка представлена удлиненным линейным тяжом с неровными контурами, но не достигает медиального мыщелка бедренной кости;
- тип С – складка удлинена, утолщена, с неровными бахромчатыми контурами, распространяется на область медиального мыщелка бедренной кости.
- тип D – складка распространяется на область медиального мыщелка бедренной кости, утолщена, неровная, имеет центральный дефект (фенестрированная складка).
Данная классификация получила всеобщее признание и одобрение, так как проста в использовании и клинически востребована. Типы A и B медиопателлярной складки бессимптомны. Типы C и D могут ущемляться между медиальным мыщелком бедренной кости и надколенником с последующим утолщением и уплотнением, повреждая хрящ в области пателло-феморального сочленения. Основным механизмом воздействия складки является компрессия суставного хряща медиальной фасетки надколенника при сгибании и пателлярной поверхности медиального мыщелка бедренной кости при разгибании. Ряд авторов придерживается точки зрения, что фенестрированная медиопателлярная складка (тип D) чаще вызывает повреждение (импинджмент) суставного хряща медиальных отделов пателло-феморального сустава.
Для визуализации медиопателлярной складки с помощью МРТ наиболее информативными считают Т2- или протонно-взвешенные изображения в сагиттальной и аксиальной плоскости с использованием режима жироподавления или без него. Медиопателлярная складка имеет низкий МР-сигнал и без труда распознается в типичном месте на фоне небольшого количества внутрисуставной жидкости. С другой стороны, следует всегда обращать внимание не только на размер складки и ее расположение относительно медиального мыщелка, но также на состояние суставного хряща в медиальной фасетке надколенника, мыщелке бедра и на жалобы пациента. При массивном внутрисуставном выпоте может произойти боковое смещение складки, осложняющее дифференциальную диагностику типов B и С. Крупный размер медиопателлярной складки может затруднить осмотр медиальных отделов сустава при артроскопии.
Анатомия
Синовиальная оболочка располагается вокруг суставов и связок, обеспечивая им защиту. Это происходит благодаря выделению небольшого количества жидкости (смазочного секрета), которая уменьшает трение и дает амортизацию.
Точная причина синовита бедра неизвестна, но некоторые теории называют травму бедренной кости в анамнезе или недавно перенесенные вирусные заболевания, такие, как инфекция верхних дыхательных путей, бронхит или воспаление среднего уха.
Одной из причин развития воспаления тазобедренного сустава является попадание инфекции в синовиальную жидкость. Это происходит на фоне любого другого инфекционного заболевания. В таком случае к классическим симптомам добавляются лихорадка, значительное повышение температуры тела и общее плохое самочувствие. В этом случае требуется в первую очередь бороться с источником инфекции.
Основные причины:
- спортивная травма;
- растяжение;
- заболевания крови;
- проблемы с обменом веществ;
- эндокринные патологии;
- дистрофическая патология сустава;
- избыточный вес;
- аллергия;
- ушибы.
В числе инфекционных возбудителей, которые чаще всего становятся причиной синовита, находятся пневмококки, стрептококки, стафилококки, палочка Коха (туберкулез) и ИППП (инфекции, передающиеся половым путем).
Латеральная пателлярная складка
Схематическое изображение анатомических структур латерального кармана коленного сустава (норма)
Латеральная пателлярная складка – наиболее редко встречающаяся складка коленного сустава. Чаще всего она имеет продольную форму, очень тонкая и расположена на 1-2 см латеральнее надколенника.Латеральная пателлярная складка берет свое начало на латеральной стенке и прикрепляется к инфрапателлярному жировому телу. S. Ogata и H.K. Uhthoff выдвинули гипотезу, что редкая персистенция латеральной пателлярной складки связана с латеральным смещением надколенника, не оставляющим места для нее в латеральном кармане. Латеральная складка может затруднять проведение артроскопии коленного сустава через передне-латеральный доступ.
Латеральную пателлярную складку не следует путать с более часто встречающимися крыловидной, верхнелатеральной, поперечной дугообразной складками.
Стрелками указаны: на рисунке А — латеральная пателлярная складка (белая тонкая стрелка), латеральная крыловидная складка (черная тонкая стрелка), поперечная дугообразная складка (черная толстая стрелка); на рисунке Б — верхнелатеральная складка (белая толстая стрелка).
Латеральная крыловидная складка расположена вплотную к надколеннику по наружной стенке, верхнелатеральная складка представляет собой разновидность дислоцированной кнаружи супрапателлярной складки. Поперечная дугообразная синовиальная складка часто обнаруживается на стыке вертикальной и переднезадней частей латерального кармана.
Патогенез и клинические проявления
Синдром синовиальной складки (shelf-, plica-синдром или их наиболее частая разновидность — синдром медиопателлярной складки) описывает комплекс болезненных нарушений функций коленного сустава, при которых единственной находкой оказывается утолщенная и фиброзно-измененная складка.
МР-томограмма коленного сустава
Пациент А., 18 лет. МР-томограмма коленного сустава, протонно-взвешенный режим с подавлением жира (аксиальная плоскость) и артроскопические слайды. Жалобы на боль во внутренних отделах коленного сустава. Определяется удлинение, утолщение, фибрилляция медиальной пателлярной складки, которая достигает медиального мыщелка бедра (тип С по Sakakibara). Стрелкой указана зона «растрескивания» и хондромаляции суставного хряща медиальной фасетки надколенника.
Дебютом патологии обычно является травма коленного сустава (прямой удар, повторяющаяся нагрузка, скручивание, приводящие к растяжению складки), реже воспалительные и дегенеративные изменения. Посттравматический, воспалительный отек складки приводит к потере ее эластичности, утолщению и клиническим проявлениям в том случае, если она достигает пателло-феморального сустава при движениях. Результатом фиброза и гипертрофии становится реактивный механический синовит, а также эрозии суставного хряща бедренной кости и надколенника. На ранних стадиях заболевания причиной болевого синдрома часто является сама складка, тогда как в более поздний период на первое место выходит хондромаляция суставного хряща и синовит. Следует помнить, что размеры, форма, ригидность складок коленного сустава напрямую зависят от наследственных и конституциональных особенностей конкретного человека, однако, большинство специалистов сходятся во мнении, что толстая складка манифестирует клинически значительно чаще, чем тонкая.
Синдром медиопателлярной складки чаще диагностируется у подростков, чем у взрослых, в связи с более редким сопутствующим поражением менисков и связок. Наиболее типичным является возникновение симптомов после тупой травмы колена. Основной жалобой пациентов являются боли в медиальных отделах сустава, которые могут возникать как при нагрузке, так и в покое, и усиливаются при повторяющемся сгибании/разгибании. Боль локализуется кнутри от надколенника, выше линии суставной щели коленного сустава. Неспецифические признаки включают крепитацию, выскакивание, щелчки, псевдозаклинивание и выпот. Дифференцировать ССС чаще всего приходится с разрывом медиального мениска и пателлярной нестабильностью. В случае пальпации медиальнее надколенника плотного болезненного тяжа диагноз синдрома медиопателлярной складки становится более вероятным.
Существует два основных механизма патологического воздействия супрапателлярной складки. Первый — компрессия полости коленного сустава супрапателлярной сумкой с импинджментом суставного хряща верхнемедиальных отделов бедренной кости при сгибании. Второй — воспаление супрапателлярной сумки.
МР-томограмма коленного сустава (сагиттальная плоскость)
МР-томограмма коленного сустава (сагиттальная плоскость) в режиме Т2- взвешенности с жироподавлением до контрастирования (А) и Т1-взвешенности после внутривенного введения контрастного препарата (Б). Определяется полностью нередуцированная супрапателлярная складка с формированием замкнутой супрапателлярной сумки. Отмечается утолщение синовиальной оболочки сумки (признаки бурсита), пролабирование нижнего полюса сумки в верхние отделы пателло-феморального сочленения с явлениями компрессии.
Как правило, оба патологических состояния встречаются при полностью нередуцированной складке (I тип) с формированием замкнутой супрапателлярной (субквадриципитальной) полости.
Латеральная пателлярная складка встречается крайне редко и обычно асипмтоматична. Клинические и МР-признаки латерального ССС идентичны таковым при синдроме медиопателлярной складки. Проявлениями латерального ССС могут быть болезненность в латеральной области сустава и щелчки. Пальпируемый жгутоподобный болезненный тяж соответствующей локализации является патогномоничным симптомом.
Морфология и метаболизм синовиальных суставов
Синовиальные суставы — сложная многокомпонентная органоспецифическая система, включающая как элементы внутренней среды (суставные хрящи, синовиальную жидкость, синовиальную мембрану), так и прилежащую к суставному хрящу субхондральную кость, через которую в определенной мере осуществляются энергетические, пластические и механические функции суставного хряща (Павлова В. Н., 1989). Все перечисленные компоненты тесно функционально связаны и, в зависимости от характера взаимодействия и особенностей их организации, обеспечивают локомоторную функцию.
Суставные хрящи лишены сосудов, и нервов, в связи с этим характер поступления веществ и выполнение ими функций сказывается на морфологической организации. Так, эта структура характеризуется фенотипически, а по данным некоторых исследователей, и генотипически неоднородной популяцией хондроцитов, имеющих вертикальное позиционно-специфическое расположение по толще суставного хряща и специфические метаболические характеристики. Хондроциты занимают 5% объема хряща и обеспечивают биосинтез белков и углеводов, необходимых для формирования полноценного матрикса, способного выдержать механические нагрузки. В поверхностных зонах контактирующих поверхностей суставов хондроциты располагаются в 1-2 слоя, имеют овальные ядра, окруженные цитоплазмой, вытянутой в краевых отделах. Само расположение хондроцитов соответствует направлению коллагеновых волокон, образующих бесклеточную часть поверхностной зоны (Lamina splendens), то есть параллельно поверхности. Зачастую эти клетки не формируют капсул, а по электронномикроскопическим характеристикам напоминают фибробласты: они имеют ядро с компактным расположением хроматина, а их цитоплазма содержит развитый эндоплазматический ретикулум (рис. 1-1.). В этих клетках практически не определяется скоплений гликогена, являющегося одним из маркеров цитодифференцировки хондроцитов. Наиболее обширная по площади территория приходится на среднюю зону, в которой хондроциты располагаются в капсулах поодиночно или в виде изогенных групп, состоящих преимущественно из двух клеток. По электронномикроскопическим характеристикам они отличаются организацией цитоплазмы: обнаруживаются хондроциты с развитым эндоплазматическим ретикулумом, что свидетельствует о высоком уровне в них биосинтеза белков, в основном коллагена. У части клеток в цитоплазме сложно организован комплекс Гольджи и содержится большое количество секреторных гранул, что указывает на интенсификацию синтеза углеводсодержащих соединений.
Гликоген обаруживается практически во всех клетках в виде небольших диффузно расположенных по цитоплазме скоплений. Клетки глубокой зоны суставного хряща отличаются колонкообразной организацией, включающей два и более хондроцитов. В основной массе они имеют организованную цитоплазму с развитым эндоплазматическим ретикулумом, комплексом Гольджи, большим количеством митохондрий и лизосом, обширными скоплениями гликогена. Наличие последних в этих клетках трактуется как сигнал к оссификации. Если рассматривать в целом клеточную популяцию суставного хряща, то необходимо отметить, что усложнение ультраструктурной организации клеток идет по направлению от поверхностной зоны к глубокой (Brighton С. Т., Kitajimana T., Hunt R. М., 1984). В зоне кальцифицированного хряща клетки располагаются в расширенных капсулах на значительном расстоянии друг от друга, имеют плотные ядра, слабо организованную цитоплазму с большим количеством включений в виде гликогена, липидов и плотных осмиофильных частиц. Хондроциты, прилежащие к зоне оссификации, имеют пикнотичные ядра, зачастую окруженные лишь фрагментами цитоплазмы. Клетки располагаются в капсулах, размеры которых больше, чем у капсул хондроцитов других отделов хряща.
Рис. 1.1. Варианты структурной организации хондроцитов:
- хондроцит поверхностной зоны с развитыми мембранными органеллами цитоплазмы, ув. 12000;
- фрагмент хондроцита средней зоны с развитым гладким эндоплазматическим ретикулумом и скоплениями гликогена в цитоплазме, ув. 16000;
- хондроцит средней зоны с большим количеством митохондрий, ув. 12000;
- хондроцит средней зоны с развитым гранулярным эндоплазматическим ретикулумом, ув. 12000;
- хондроцит глубокой зоны, вакуолизация цитоплазмы, ув. 12000;
- хондроцит глубокой зоны, единичные канальцы эндоплазматического ретикулума, микрофиламенты и микротрубочки цитоскелета, ув. 12000; контрастировано по Рейнольдсу, ЭМВ-100БР.
В настоящее время доказана несостоятельность представления о хондроцитах как метаболически инертных клетках; получены данные, свидетельствующие о том, что этот вид клеток характеризуется высокой интенсивностью обменных процессов (Павлова В. Н. и соавт., 1988).
Хондроциты всех зон суставного хряща характеризуются определенными чертами сходства и различия по метаболическому профилю. Так, ферменты цикла Кребса, гексомонофосфатного шунта, цитохромоксидаза прогрессивно увеличиваются в цитоплазме хондроцитов, располагающихся по направлению от поверхностной к глубоким зонам хряща. Гликолитические ферменты присутствуют в хондроцитах всех зон суставного хряща, такая же ситуация характерна и для липидов (Sampson Н. W., Cannon М. S., 1986). Эти данные подтверждают ранее высказанную точку зрения о наличии двух популяций хондроцитов, в данном случае дифференцируемых по ферментам, — анаэробов и аэробов, — ориентированных в толще суставного хряща в соответствии со спецификой поступления в него питательных веществ.
С возрастом суставные хрящи претерпевают определенные изменения. В них снижается плотность хондроцитов на единицу площади. Это приводит к тому, что единичные хондроциты не могут метаболически обеспечить большие площади матрикса и катаболические процессы начинают преобладать над анаболическими. Возникающая ситуация может быть рассмотрена как „слабое звено” в системе суставного хряща. Вследствие уменьшения в клетках мембранных органелл и разрастания в них элементов цитоскелета, упрощается ультраструктурная организация хондроцитов. Однако, даже в суставных хрящах людей возрастной группы 60-80 лет, были выявлены хондроциты, по ультраструктурной организации которых можно сделать вывод об активации в них процессов биосинтеза фибриллярных битков и протеогликанов. Но в основной массе хондроциты имеют признаки инволютивной атрофии (Виноградова Е. В., Михайлов И. Н., 1983).
Хрящевые клетки являются предметом пристального внимания исследователей, так как в конечном итоге от их реактивности и пластической функции зависит биохимическая надежность матрикса.
Установлено, что дифференцировка клеток и возрастные изменения сопровождаются и характерными преобразованиями макромолекулярной организации матрикса. В целом, в хрящевых тканях, так же, как и в других видах соединительной ткани, прослеживается четкая взаимосвязь между клеточными и неклеточными компонентами. То есть клетка воспроизводит макромолекулы матрикса: коллаген, гликопротеины, протеогликаны и неколлагеновые белки, а макромолекулы, формируя микроокружения клетки, оказывают влияние на ее цитодифференцировку.
Названные компоненты находятся в матриксе в четкой взаимосвязи между собой, а в онтогенезе происходит преобразование их структурной и пространственной упорядоченности. На этих процессах остановимся более подробно.
Известно, что на этапах хондрогенеза биосинтез коллагена, одного из основных компонентов матрикса, неоднороден. С помощью биохимических и иммунологических методов исследования показано, что предхрящевые клетки синтезируют I тип коллагена (Modis L. et al., 1986). Специфической функцией хондроцитов является биосинтез коллагена II типа. Однако, даже при изучении зрелого суставного хряща, выявлено, что хондроциты поверхностной зоны могут синтезировать I тип коллагена, а в клеточном территориальном матриксе хондроцитов других зон определяются перицеллюлярные коллагены (коллаген У типа), образующие опору клеток по типу экзоцитоскелета. Кроме того, в хрящевой ткани выявлено большое количество минорных компонентов коллагена. Исследования последних лет показали, что в норме процесс обмена коллагена в хрящевой ткани длителен, при этом период полужизни макромолекул составляет от 50 до 300 дней. По теоретическим расчетам, выполненным на основе изотопных исследований, установлено, что его полный обмен в матриксе хрящей у человека может осуществляться в течение 120-360 лет (Maroudas А., 1980), то есть система матрикса имеет большой запас прочности. В целом, в матриксе хрящей коллаген составляет 50-70%, при этом большая его часть находится в составе коллагеновых волокон и именно с их ориентацией и упорядоченным расположением в толще суставного хряща связываются его прочность и функциональные свойства. В матриксе суставного хряща человека анизотропия коллагена в поверхностной и промежуточной зонах находится практически на одном уровне, а в глубокой — несколько выше. При старении, в условиях патологического процесса и физиологических сдвигов, синтез и типовой состав коллагена может изменяться. Установлено, что двойное лучепреломление коллагена во всех зонах суставного хряща остается на одном уровне до определенного возраста. Так, в поверхностной зоне — до 70 лет, в средней — до 60 лет, в глубокой — до 50 лет, а затем снижается на 27, 18 и 24% соответственно указанным выше зонам и возрастам (Дедух Н. В., 1988).
При старении увеличивается протяженность коллагеновых фибрилл и их переплетений, что вносит определенный вклад в теорию „утомляемости структуры” и способствует нарушению организации матрикса: демаскированию коллагеновых волокон, их деструкции и, соответственно, нарушению взаимосвязи с протеогликанами (Hough A. J., Weber R. J., 1986).
В связи с тем, что процесс фибриллогенеза базируется на участии в нем протеогликанов и гликопротеидов, оценке роли этих макромолекул посвящены фундаментальные исследования (Серов В. В., Шехтер А. Б., 1981, Павлова В. Н. и др., 1988). Так, показано, что протеогликаны могут присутствовать в матриксе либо в виде комплексов, либо — минорных компонентов. Важной структурной единицей протеогликановых комплексов являются гликозаминогликаны (ГАГ). На сегодняшний день выделено 8 типов ГАГ, 6 из которых — сульфатированные формы. В целом, ГАГ, присутствующие в суставном хряще могут быть объединены в три функциональные группы: 1) гиалуронаты, 2) хондроитин и хондроитинсульфаты, 3) кератансульфаты. Установлено, что для предхрящевых клеток характерен высокий уровень синтеза гиалуруновой кислоты, играющей определенную роль в пролиферации и миграции клеток. Дифференцировка клеток сопряжена с нарушением в ткани соотношения: гиалуроновая кислота/гиалуронидаза. По мере дифференцировки клеток синтез гиалуроновой кислоты снижается, а содержание гиалуронидазы и хондроитинсульфатов увеличивается. Хондроитинсульфаты распределяются довольно равномерно по толще суставного хряща, в то время как содержание кератансульфатов возрастает по направлению к глубокой зоне (Williams I. М. et al., 1988). Если сопоставить данные по содержанию в хрящах ГАГ и коллагена, то выявляется следующая картина: наиболее глубокие слои суставного хряща содержат в 2 раза больше хондроитинсульфатов и в 6 раз больше кератансульфатов по сравнению с коллагеном. С возрастанием сульфатированных форм ГАГ, отражающих более высокий уровень организации матрикса, фиксируется и повышение биосинтеза коллагена и его ориентационной упорядоченности (Foldes I. et al., 1980). На основе динамики выявления и данных по организации в матриксе этих макромолекул, исследователями постулируется точка зрения, что сульфатированные формы ГАГ являются матрицей для ориентационно упорядоченно расположенного коллагена (Серов В. В., Шехтер А. Б., 1981, Modis L. et al., 1986). В последние годы разработаны методы визуализации протеогликанов при электронной микроскопии (рис. 1.2.).
Рис. 1.2. Протеогликаны в матриксе суставного хряща (контрастировано альциановым синим 8GS.ЭMB-100БP):
- гранулы в целлюлярком и интерцеллюлярном матрикс, ув. 16000;
- варианты гранул протеогликанов, ув. 44000;
- протеогликаны и коллагеновые волокна, ув. 45000.
Известно, что в состав протеогликанового комплекса входит 5% хондроитинсульфатов, 2-7% кератансульфатов и 7-12% неколлагеновых белков (Hadley С., Phelps С., 1982; Harding- ham Т., 1981). Однако на этапах онтогенеза соотношение между этими макромолекулами не остается постоянным (Гонгадзе Н. Р., 1986; Косягин Д. В., 1983). Так, если в суставном хряще детей преобладают хондроитинсульфаты, то у взрослых — кератансульфаты (Elliott R. I., Gardner D. R., 1979; Triphaus G., Schmidt A., Buddecke E., 1980). Кроме того, с возрастом изменяется и соотношение хондроитин-4-сульфатов к хондроитин-6-сульфатам, за счет резкого снижения первого компонента и при незначительном возрастании второго TGreilind Н., 1976). Установлено изменение соотношения и плотности фракций протеогликанов с возрастом (Roughley Р. I., 1987). Кроме того, в них нарушается связь между белком и гиалуроновой кислотой (Mitrovic D. R., 1987), а также соотношение белок/гиалуроновая кислота за счет увеличения содержания первого компонента и снижения второго (Косягин Д. В., 1983). Деградация протеогликанов в суставном хряще наблюдается на протяжении всей жизни человека, но усиливается с возрастом. Это проявляется повышением фрагментации протеогликановых комплексов за счет входящих в их состав белковых цепей, гиалуроновой кислоты и гликопротеинов, которые могут в свободном виде накапливаться в тканях (Roughley Р. I., 1987). Однако протеогликаны остаются способными к агрегации с гиалуроновой кислотой, практически не изменяющей свою форму. Другие изменения протеогликанов связаны с увеличением гистидиналаниновых участков и снижением молекулярной массы протеогликанов (Hough A. J., Weber R. J., 1986).
Методами поляризационной микроскопии доказано, что в поверхностной зоне суставного хряща рефракция ГАГ сохранялась на одном уровне до 50 лет, а затем прогрессивно снижалась и достигала 34% от исходных значений. В возрастной период от 41 до 50 лет в промежуточной зоне снижение рефракции ГАГ было зафиксировано на 37%, а в группе 71 год и старше — на 50%. В глубокой зоне пик двойного лучепреломления ГАГ выявлен в возрастной группе 31-40 лет, дальнейшее снижение прослеживалось во всех остальных группах, достигая 40% к возрасту 71 год и старше (Дедух Н. В. и соавт., 1988). С возрастом в территориальном матриксе степень рефракции ГАГ уменьшалась, но всегда оставалась выше, чем в интерриториальном (рис. 1.3.). Дифференциальный анализ рефракции ГАГ показал, что старение сопровождается уменьшением анизотропии хондроитинсульфатов и увеличением во всех зонах суставного хряща рефракции кератансульфатов, достигающих в глубокой зоне возрастной группы 71 год и старше 91% от общего состава. Повышение доли кератансульфатов в суставном хряще от 60% и выше сопровождалось выраженными нарушениями степени рефракции коллагена, что проявлялось, в первую очередь, в глубокой зоне. Следует отметить, что качественные изменения фибрилл коллагена с возрастом были выявлены именно в этой зоне е помощью методов электронной микроскопии (Копьева Т. Н. и др., 1983), Описанные выше изменения структурной организации матрикса хряща приводят к нарушению ее эластических качеств.
Рис. 1.3. Гликозаминогликаны в матриксе суставного хряща:
- выраженная анизотропия, равномерное распределение в матриксе, ув. 80;
- нарушение организации. Локальная анизотропия вокруг клеток, ув. 90. Поляризованный свет. „Polmy-А”.
Еще одним важным компонентом матрикса, принимающим участие в его организации, являются макромолекулы гликопротеинов — объект пристального изучения в связи с выявлением их роли в фибриллогенезе, кальцификации тканей и некоторыми другими функциями (Шубич М. Г., Могильная Г, М, 1979; Шубич М. Г., 1980; Серов В. В., Шехтер А, Б, 1981; Хьюз Р., 1985; Anderson J., 1876). На отдельных аспектах их участия в хондрогенезе считаем необходимым остановиться. Обобщая имеющиеся данные литературы по вопросам формирования матрикса, Шубич М. Г. (1980) отмечает, что на этапах сближения и агрегации клеток у них изменяются свойства цитолеммы за счет изменения подвижности входящих в их состав гликопротеинов, что в свою очередь является стимулом для высвобождения гиалуронидазы, расщепляющей гиалуроновую кислоту на наружной поверхности мембран. При этом возрастает уровень цАМФ в клетке и в результате всех преобразований активизируются ферменты синтеза протеогликанов и коллагена. Другой важной функцией гликопротеинов является их участие в агрегации протеогликанов для обеспечения взаимосвязи их с гиалуроновой кислотой (рис. 1,4,).
Кроме того, считается, что структурные гликопротеины, как и протеогликаны, могут выступать в качестве „матрицы” для отложения коллагена и играют важную роль в организации протеогликанов и коллагеновых волокон (Robert R., Robert В, 1984; Modis L. 1974). В целом показано, что гликопротеины не только регулируют рост и ориентацию коллагеновых волокон, но и способствуют их стабилизации (Серов В. В., Шехтер А. Б.г 1981). С возрастом и в условиях патологии содержание гликопротеинов снижается, что приводит к дестабилизации коллагеновых волокон (Anderson С, Н, Salter S. 1971). У человека повышение двойного лучепреломления гликопротеинов отмечено в возрастной группе 41-50 лет, а затем наблюдалось их снижение, что было наиболее четко выражено в промежуточной и глубокой зонах суставного хряща. Именно в этой возрастной группе и начинают активно манифестировать процессы демаскирования: (фибрилляции) коллагеновых волокон.
Рис. I. 4. Схема махромолекулярной организации матрикса суставного хряща.
Установлено, что в хрящевой ткани содержится особый вид гликойротеинов — хондронектин (Kevitt А. Т. et aL, 1980). Предполагается, что он является посредником для связи хондроцитов преимущественно со II типом коллагена.
Составной частью протеогликанов и гликопротеинов являются неколлагеновые белки. В протеогликановых комплексах они составляют осевую структуру (protein — core) (Romhanyi G. et al., 1975; Shipp D., Bowness J., 1975). Кроме того, они формируют структуру гликопротеинов, обеспечивающих взаимосвязь протеогликанов с гиалуроновой кислотой (link) (Нагdinghman Т. Е.,1977, 1981, 1982).
Часть неколлагеновых белков в матриксе находится в свободном состоянии. Состав и структура неколлагеновых белков изменяется с возрастом и в условиях патологии (Szirmai J. A. et al., 1967; Heinegard D., Oldberd A., 1989).
Затухание биосинтетических процессов отражается на взаимосвязи коллагена и ГАГ, что способствует снижению репаративных потенций и приводит к появлению в матриксе, в частности в коллагеновом каркасе, локальных деструктивных изменений.
В связи с тем, что трофика суставного хряща обеспечивается диффузионно-деформационным механизмом, существует выраженная зависимость суставного хряща от состава и интенсивности обмена синовиальной жидкости. Доказано, что область диффузии синовиальной жидкости в суставной хрящ составляет от 3 до 5 мм, однако на величине этого показателя сказывается ее вязкость. При этом, чем выше вязкость, тем больше смазывающая способность синовиальной жидкости, но тем меньше жидкости проникает в суставной хрящ и наоборот. Синовиальная жидкость имеет определенные черты сходства с плазмой крови, но различается присутствием и содержанием некоторых белковых компонентов, в частности соотношением альбуминов к глобулинам. (3:1). Содержание а-глобулина в синовиальной жидкости почти в три раза меньше, чем в плазме. В синовиальной жидкости содержится трансферин, гаптоглобулин, но отсутствует фибриноген, а также белки с молекулярной массой более 160000. В ней имеются ГАГ, в том числе гиалуроновая кислота, выступающая как основной компонент, связывающий воду. Кроме того, в синовиальной жидкости содержится до 30 ферментов. Ее функции многообразны. Помимо питания суставного хряща и регуляции в нем метаболических процессов, она обеспечивает смазывание суставных поверхностей, что облегчает их трение — скольжение.
Капсула суставов имеет два слоя — синовиальный и фиброзный. В образовании синовиальной жидкости принимают участие синовиоциты — клетки, выстилающие синовиальный слой капсулы. По организации синовиоциты являются специфическим клеточным компонентом покровного слоя. Это крупные клетки, содержащие большие овальные ядра, окруженные мелкодисперсной цитоплазмой. Синовиоциты относятся к полярным клеткам — ядро и органоиды в них расположены по длине оси и перпендикулярно просвету. Апикальный конец синовиоцитов часто имеет мночисленные филоподии и вакуоли (Павлова В. Н., 1980).
По ультраструктурным особенностям среди синовиоцитов можно выделить три типа клеток, условно обозначаемых как А, В и С. Клетки А — макрофагоподобные синовиоциты, содержат большое количество лизосом, они способны к активному пино- и фагоцитозу. Эти клетки наиболее многочисленны, имеют развитый комплекс Гольджи, вакуоли, митохондрии и секреторный материал, идентифицируемый как гиалуроновая кислота. В-клетки — синовиоциты фибробластического типа. Они продуцируют белковые и полисахаридные вещества. Это немногочисленная популяция клеток, имеющих развитый эндоплазматический ретикулум, преимущественно гладкого типа. С-клетки совмещают черты А и В синовиоцитов.
Остальные клеточные элементы покровного слоя — фибробласты, тучные клетки, лимфоциты и макрофаги, плазматические клетки, имеют типичное строение, свойственное клеткам соединительной ткани. Межклеточное вещество синовиального слоя богато рыхлоупакованными ретикулиновыми волокнами, агрегатами протеогликанов и гликопротеинов. Благодаря такой организации синовиальной мембраны, она выполняет функции по переносу веществ „полость сустава — кровь — полость сустава”.
Фиброзный слой капсулы представлен коллагеновыми и эластическими волокнами, обеспечивающими процессы растяжения и сжатия при перемещении суставных концов.
Суставная капсула имеет сложноорганизованное сосудистое русло, в котором капилляры подходят непосредственно к синовиоцитам покровного слоя, а также систему нервной регуляции, состоящую из многочисленных эфферентных окончаний различной структуры (пластинчатые тельца, кустиковидные свободные окончания), выступающие как проприорецепторы, рецепторы болевой чувствительности, хеморецепторы и барорецепторы. Эффекторные пути представлены симпатическими безмякотными волокнами, которые заканчиваются нервными окончаниями на гладкомышечных миоцитах сосудов и регулируют их проницаемость. С более детальным анализом организации синовиальной мембраны и синовиальной жидкости можно ознакомиться в монографии Павловой В. Н. (1980).
Возрастные изменения в капсуле по характеру принципиально не отличаются от происходящих в других тканях сустава и заключаются в уменьшении клеточности, наличии инволютивных (атрофических) изменений в клетках, увеличении объема, занимаемого в межклеточном веществе коллагеновыми волокнами. С повышением возраста в капсуле увеличивается полиморфизм коллагеновых волокон и уменьшается содержание эластических волокон.
СПИСОК ЛИТЕРАТУРЫ
- Виноградова Е. В., Михайлов И. Н. Электронногистохимическая характеристика протеогликанов гиалинового и эластического хряща человека //Структура, функция и развитие хряща в норме и патологии: Тез. докл. 3 симпоз. — М., 1983. — С. 20.
- Гонгадзе Л. Р. Мукополисахариды стареющего суставного хряща человека //Архив анат. — 1974. — Т. 67, №. 7. — С. 99-103.
- Г онгадзе Л. Р. Базофильная линия суставного хряща в норме и при некоторых патологических состояниях //Архив анат. — 1986. — Т. 79, №. 1. С. 52-57.
- Дедух Н. В. Морфологические аспекты воздействия гормонов на суставной хрящ в онтогенезе: Автореф. дис. д-ра биол. наук. — М., 1988. — 32 с.
- Дедух Н. В., Кулиш Н. И., Череватова С. X. и др. Функциональное состояние некоторых эндокринных желез у больных коксартрозом //Возрастные, адаптивные и патологические процессы в опорно-двигательном аппарате: Тез. докл. 7-ой шк. по биологии мышц. — X., 1988. — С. 191-192.
- Копьева Т. И., Мульдилров П. Я., Бельскал О. Б., Пастель В. Б. Структура суставного хряща у лиц пожилого возраста //Архив анат. — 1983. — Т. 85, № 10.-С. 60-67.
- Кослгин Д. В. Соотношение белкового и углеводного компонентов в мономерах и агрегатах протеогликанов суставного хряща человека //Структура, функция и развитие хряща в норме и патологии: Тез. докл. 3 симпоз. — М., 1983. — С. 26.
- Павлова В. Н. Синовиальная среда суставов. — М.: Медицина, 1980. С. 296.
- Павлова В. Н., Копьева Т. Н., Слуцкий Л. И., Павлов Г. Г. Хрящ. — М.: Медицина, 1988. — 320 с.
- Павлова В. Н. Компоненты внутренней среды суставов и их функциональное взаимодействие //Успехи соврем, биологии. — 1989. — Т. 107. Вып. 2. — С. 238-242.
- Серов В. 3., Шехтер А. Б. Соединительная ткань. Функциональная морфология и общая патология. — М.: Медицина, 1981. — 312 с.
- Шубич М. Г., Могильная Г. М. Гликопротеины и протеогликаны: принципы их гистохимического анализа //Архив анат. — 1979. — Т. 71, № 8. — С 92-95.
- Шубич М. Г. Механизм формирования хряща в эмбриогенезе //Природа. — 1980. — № З.-С. 26.
- Хьюз Р. Гликопротеины. — М.: Мир, 1985. — 140 с.
- Anderson I. Glycoprjteins of the connective tissue matrix //Intern. Rex Connect Tissue Res. — 1976. — Vol. 7. — P. 252-322.
- Anderson С. H., Salter S. IV. The fine structure of bovine nasal cartlage //J. Cell. Biol. — 1971. — N. 49. — P.650-663.
- Brighton С. T. The zonal analysis of cytoplasmik components of artcular cartilage //Artritis Rheum. — 1984. — Vol. 37. — P. 1290-1299.
- Greiling H. Biochemische Untersuchungen zur medikamentosen ther; pie der Arthrosen. Meniscuslasionen und posttraumatische Arthrose //Unfa heilung. — 1976. — Bd 128. — S. 87-97.
- Elliott R., Gardner D. R. Changes with agein the glycosaminoglycar of human articular cartilage //Ann. Rheum. Dis. — 1979. — Vol. 38. — 371-377.
- Foldes L., Modis L., Antalety J., Adam J. Ultrastructure of extracellul; matrix of embryonic chick limb bud and cartilage //Acta Biol. Acad. Sci. Hung. 1980. — Vol. 31. N3.-P.81-95.
- Hadley C., Phelps C. The biosynthesis in vitro of chondroitinsulfa neonatal rat epiphyseal //Biochem. — 1972. — Vol. 126. — P. 427-432.
- Hardingham T. E. Cartilage proteoglycans: structure, interactions ar organization //Med. Sci. Upsala. — 1977. — N 82. — P. 67-68.
- Hardingham T. E. The role of link-proteins in the structure of cartilat proteoglycan aggregates //Arthritis Rheum. — 1981. — Vol. 711, N 1. — P. 28-29.
- Hardingham T. E.Proteoglycans: their structure, interaction and mol cular organization in cartilage //The Sixteenth Colworth Medal Lecture. — London, 1982. — Vol. 67. — P. 489-497.
- Hevitt A. T. Identifikation of adhesive factor for chondrocytes //Prc Nat. Acad. Ski. USA. — 1980. — Vol. 77. — P. 355-388.
- Hough A. J., Weber R. J. Aging Phenomena and Osteoarthritis: cause coincidence? //Annals of clinical and laboratory science. — 1986. — Vol. 16. N. 6.-P.502-510.
- Maroudas A. Metabolism of cartilagenous tissues: a quantitative a (roach //Stud. Joint Disease. — Cambridge, 1980. — P. 59-86.
- Mitrovic D. R., Aprile F., Front Ph. Age-related changes in the structi of bovine articular cartilage proteoglicans //Joint destruction: 16-th Simposii of the European Society of Osteoartrology. — 1987. — P. 6-17.
- Modis L. Topo-optical investigations of mucopolysaccharides (ai glycosaminoglycans) //Handbuch Histochemie. Polysaccharide. Stuttgr 1984. — Vol. 11. Part 4. — P. 164.
- Modis L„ Adany R., Szekanecz Z., Raystijk G., Nagy I. Differentiation the extracellular matrix in cartilage: 21-st Symposium of the Polish Histochecal fnd Cytochemical Society. — Poland: Krakov, 1986. — P. 46.
- Robert S., Robert B. Structural glycoproteins of connective tissue, their role in morphogenetics and immunopathology //Connective Tissue, Biochemistry and Pathophysiology. — Berlin, 1974. — P. 240-256.
- Roughley P. I. Structural changes in the proteoglycans of human articular cartilage during aging //J. of Rheumatology. — 1987. — Vol. 14. — P. 14-15.
- Romhanyi G., Deak G„ Fisher G. Aldehyd-bisulfite-toluidine blue (ABT) staining as a topo-optical reaction for demonstration of linear order of vicinal OH-groups in biological structures //Histochemie. — 1975. — Vol. 43. — P. 333.
- Salter R. B., Gross A., Hamilton-Hall I. Hydrocortisone artropathy: An experimental investigation //Can. Med. Assoc. J. — 1967. — Vol. 97. — P. 374.
- Sampson H. W., Cannon M. S. Zonal analysis of metabolic profiles of articular — epiphyseal cartilage chondrocytes: a histochemical study /Histo- chemical J. — 1986. — Vol. 18. — P. 233-238.
- Shipp D., Boweness I. Insoluble noncollagenous cartilage glycoproteins with aggregation subunits //Biochem. Biophys. Acta. — 1975. — Vol. 279. — P. 282-394.
- Szirmai J. A., Tyssonak £., Gardell S. Microchemical analysis of glyco- saminoglycans, collagen, total protein and water in histological layers of nasal septum cartilage //Biochem. Biophys. Acta. — 1967. — Vol. 136, N 5. — P.331 — 340.
- Triphaus G., Schmidt A., Buddecke E. Age-related changes in the incorporation of S sulfate into two proteoglycan populations from human cartilage //Hoppe-Seylers Z. Physiol. Chem. — 1980. — Vol. 361, N 12. -P. 1773 — 1779.
- Williams l. M., Kafz R., Dchilds M. et. al. Keratan sulfate content in the superficial and deep layers of osteophytic and nonfibrillated human articular cartilage in osteoarthritis //Calcif. Tissue Int. — 1988. — Vol. 42. — P. 163- 166.
Лечение
На первом этапе лечения ССС обычно применяют консервативные методики, такие как ограничение физической активности, массаж, физиотерапию, растяжение подколенных мышц и укрепление четырехглавой мышцы бедра. Медикаментозная терапия заключается в накожном, пероральном или внутрисуставном введении нестероидных противовоспалительных препаратов и кортикостероидов.
В случае неэффективности консервативной терапии выполняется артроскопическая резекция синовиальной складки. Радикальная операция предполагает полное удаление складки от основания. При нерадикальной операции, например, при разделении складки ножницами, может произойти ее самостоятельная репарация с повторным возникновением симптомов.
Интересным представляется исследование D.S. Tearse с соавт., который по данным выполненных 3000 артроскопий коленного сустава обнаружил латеральные складки у 21 пациента. Из них 14 были утолщены, фиброзно изменены и коррелировали со степенью выраженности жалоб. У 13 пациентов резекция складки сопровождалась полным выздоровлением.