Первый считается наиболее точным показателем содержания минеральных солей в костной ткани. Второй не менее важен, поскольку очень высоко его соотношение с риском переломов, поэтому такой индекс имеет большую прогностическую ценность.
Расшифровка результатов денситометрии может содержать и еще один параметр – объемную минеральную плотность тканей, однако он используется все реже. Это связано с тем, что он достаточно сложно выявляется и нередко для получения такого параметра необходимо применять особый вид компьютерной томографии и использовать достаточно дорогие способы обработки данных.
Как подготовиться к денситометрии?
Такое исследование костей, как денситометрия, предполагает обследование дистальной части костной ткани, а затем – эпифизов костей. Чтобы получить наиболее достоверные результаты, пациенту необходимо:
- за сутки до проведения диагностики отказаться от любых содержащих кальций пищевых добавок и лекарственных препаратов;
- уведомить врача о проведении любых процедур с применением контраста – в течение некоторого времени после них проводить денситометрию нельзя;
- не шевелиться во время процедуры и не менять положение тела и конечностей.
Теперь вы знаете, как подготовиться денситометрии, и становится понятно, что никаких особых предварительных процедур проводить не потребуется.
Виды денситометрии – для чего выполняется обследование плотности костной ткани?
Рассматриваемый метод диагностики бывает нескольких видов:
- Рентгенологический. Для изучения структуры костной ткани применяют два типа рентген-лучей. Благодаря сопоставлению сведений поглощения излучаемой энергии доктор оценивает уровень отклонения от нормы плотности кости. Указанная манипуляция отнимает минимум времени, а доза облучения в 400 раз меньше, нежели при стандартной рентгенографии. К данному виду денситометрии обращаются, когда нужно изучить костную ткань тазобедренного сустава, плеча, предплечья, пояснично-крестцовой зоны позвоночника, либо всего позвоночного столба.
- Ультразвуковой. В силу отсутствия какой-либо лучевой нагрузки указанная методика считается абсолютно безопасной. Ее можно использовать в отношении детей, а также беременных женщин. Однако результативность данной манипуляции более низкая, чем у рентгенологической денситометрии. Ее принцип основан на исчислении скорости, с которой УЗИ-волны распространяются по костным структурам. Плотность кости прямо пропорциональна скорости поглощения лучей костной тканью. При значительных потерях костной массы назначается рентгенологическая денситометрия. С ее помощью возможно получить информацию об эластичности, прочности кортикального слоя, а также толщине отдельных микроструктур.
- Количественная компьютерная томография. Дает возможность получить трехмерную картинку структурной плотности костных элементов. Так как радиационная нагрузка при данной методике весьма существенна, ее на практике применяют очень редко.
В связи со снижением уровня кальция в костях, рассматриваемый метод диагностики назначают людям после достижения ими 50-летнего возраста. Именно в этом возрасте есть большая вероятность появления остеопороза, который, согласно статистическим данным, занимает третье место по смертности.
Измерять значение минеральной плотности костных структур необходимо следующей категории людей:
Тем, у кого присутствуют два и более явлений, провоцирующих остеопороз:
- Женщины, у которых климакс наступил в раннем возрасте (до 45 лет).
- Ярко-выраженная худоба.
- Наличие остеопороза у ближайших родственников.
- Дефицит кальция и/или витамина Д в ежедневном рационе.
- Малоподвижный образ жизни.
- Табакокурение.
- Сбои в гормональном фоне.
- Злоупотребление алкогольными напитками.
- Лечение кортикостероидами.
Сахарный диабет.
Серьезные сбои в работе почек.
Наличие в анамнезе ревматических патологий: системной красной волчанки, васкулита, склеродермии и т.д.
Частые переломы костей, которые могут возникнуть даже при незначительном травмировании.
Разнообразные патологии позвоночника.
Рассматриваемую диагностическую процедуру не проводят в следующих случаях:
- Период вынашивания ребенка (для рентгенологической денситометрии).
- Деформации в пояснично-крестцовой секции позвоночника, которые препятствуют больному в принятии правильного положения тела во время обследования.
- Проведение диагностики с применением бариевого контраста менее чем за неделю до указанной манипуляции.
Виды исследования
Всего существует два вида такой процедуры: рентгеновская и ультразвуковая. Каждый из этих методов является более эффективным при обследовании определенных частей тела. К примеру, ультразвук используется для определения проблем в пяточной кости, поскольку дает большее количество информации, а рентгеновский метод целесообразно применять при необходимости осмотра шейки бедра или поясничного отдела позвоночника
.
Рентгеновская денситометрия
Если вам назначили такую процедуру, стоит узнать, что такое денситометрия и как ее проводят, чтобы понимать, к чему быть готовым. Такой метод является более информативным, однако он же является менее щадящим. Проходить исследование можно не чаще раза в год, а этого может быть недостаточно. Однако при этом доза облучения будет небольшой – куда меньше, чем при стандартном рентгене. Такая процедура позволит выявить даже минимальные отклонения в костной ткани и точно определить ее плотность на основании того, как именно будут проходить через кости лучи. Очень информативным такой метод является также при исследовании запястий.
Ультразвуковая денситометрия
Если вы не знаете, как делают денситометрию костей ультразвуковым способом, стоит узнать, что она является самой безопасной и не имеет противопоказаний. Ее назначают даже беременным и кормящим женщинам. Проводится такая процедура при помощи специального денситометра, работа которого основывается на прохождении ультразвука через кости пациента. Плюс заключается в том, что такая диагностика может проводиться как для выявления, так и для контроля болезни сколь угодно часто.
Первый опыт применения анидулафунгина в лечении больных с кандидемией
Клин. и эксперимент. хир. Журн. им. акад. Б.В. Петровского. — 2013. — № 2. — С. 41-46.
Инфекции, вызываемые микроскопическими грибами, представляют серьезную проблему в современном стационаре, особенно у тяжелых больных, получающих повторные курсы антибиотиков, а также у пациентов отделений интенсивной терапии. По данным исследования SCOPE, грибы рода Candida
занимают 4-е место среди возбудителей нозокомиальных инфекций в США, уступая только коагулазонегативным стафилококкам, золотистому стафилококку и энтерококкам [1].
Если до недавнего времени системные грибковые инфекции в основном были уделом иммунокомпрометированных больных (онкологические пациенты, больные на иммуносупрессии и др.), то теперь они значительно чаще регистрируются у осложненных больных терапевтического и хирургического профиля. Внедрение в клиническую практику новых высокотехнологичных методов лечения, поддерживающих жизнь критических больных, привело к расширению показаний и увеличению объема выполняемых хирургических вмешательств. Благодаря совершенствованию методов интенсивной терапии значительно увеличилась продолжительность жизни больных в критическом состоянии, что привело к увеличению доли пациентов с факторами риска развития грибковых инфекций.
По данным различных авторов, летальность при инвазивном кандидозе достигает 30-50%, что в ряде случаев существенно выше, чем при инфекционных осложнениях бактериальной этиологии [2, 3].
В настоящее время известно около 200 видов грибов рода Candida
, которые могут вызывать инфекционные заболевания у человека. Эти условно-патогенные микроорганизмы являются одноклеточными эукариотами, которые по сравнению с бактериями имеют более высокий уровень клеточной организации. Наличие в составе клеточной стенки хитина и относительно крупные размеры (5-12 мкм) затрудняют инактивацию грибковых клеток факторами иммунной системы организма, а продукция различных ферментов (протеолитических, липолитических, карбогидразы), являющихся факторами агрессии и проницаемости, способствует проникновению грибов в эпителиальные клетки и распространению в тканях.
Грибы вида Candida albicans
являются представителями нормальной микрофлоры кишечника. Вместе с тем данный вид является наиболее распространенным возбудителем кандидозов во всех странах мира. Однако в последние годы отмечается четкая тенденция к увеличению доли инфекций, вызванных не-
albicans
видами кандид, особенно
C. parapsilosis
,
C. glabrata
и
C. tropicalis
[1]. Также отмечается снижение чувствительности кандид к базовому антифунгальному препарату — флуконазолу, что обусловливает высокую вероятность неудачи традиционной терапии [4].
В отличие от антибиотиков арсенал противогрибковых препаратов сравнительно невелик. Структурно-биохимическое сходство клетки гриба с клетками макроорганизма затрудняет поиск препаратов, обладающих одновременно высокой антифунгальной активностью и невысокой токсичностью. Так, многие противогрибковые препараты действуют на ферментные системы, нарушая синтез стероидных гормонов и простагландинов в организме.
Ряд антимикотиков нецелесообразно применять при системных грибковых инфекциях. Так, полиеновый препарат нистатин не всасывается при пероральном приеме, поэтому он применяется исключительно для снижения грибковой колонизации или лечения поверхностного кандидоза слизистых оболочек желудочно-кишечного тракта. Производное имидазола кетоконазол в терапевтических концентрациях действует как фунгистатик, что создает высокую вероятность рецидива. Кроме того, препарат имеет достаточно высокую токсичность и применяется только перорально. Бoльшую ценность при системных микозах имеет итраконазол, так как он менее токсичен и в гораздо меньших концентрациях, чем кетоконазол, действует на ферментные системы грибковых клеток, подавляя синтез эргостерола. Однако итраконазол обладает отрицательным инотропным действием, снижая сердечный выброс, поэтому его использование у больных с тяжелыми заболеваниями сердечно- сосудистой системы нежелательно.
Применение амфотерицина В ограничивается высокой токсичностью данного препарата, и во многих случаях невозможно использовать дозы, создающие эффективные тканевые концентрации у тяжелых больных. Значительно меньшей токсичностью обладает липосомальная форма амфотерицина В. Вместе с тем до настоящего времени липосомальный амфотерицин B не зарегистрирован и не поставляется в РФ.
Препаратом первого ряда для лечения кандидозов на протяжении последних двух десятилетий является флуконазол. Благодаря хорошим фармакокинетическим свойствам он обладает высокой эффективностью не только при парентеральном, но и при пероральном приеме. Однако, как было отмечено выше, в последнее время, по данным различных исследований, отмечается тревожная тенденция роста резистентности грибов рода Candida
к флуконазолу. Это объясняется как необоснованно широким применением препаратов группы азолов, так и увеличением частоты инфекций, вызываемых грибами
Candida
non-
albicans
со сниженной чувствительностью к флуконазолу [1]. Важно учитывать, что штаммы кандид, выделенные в ОРИТ, значительно чаще обладают неблагоприятным профилем резистентности к противогрибковым препаратам по сравнению с внебольничными штаммами и госпитальными штаммами, циркулирующими вне ОРИТ.
Высокий удельный вес проблемных грибов снижает эффективность профилактики и эмпирической терапии кандидемий флуконазолом у больных в ОРИТ, поэтому в последнее время клиницисты все чаще отдают предпочтение альтернативным антифунгальным препаратам — новым азолам (вориконазолу) и эхинокандинам.
В соответствии с последними клиническими рекомендациями, препараты азольного ряда используются при стабильном состоянии больного, в отсутствие нейтропении, при доказанном отсутствии или низком риске устойчивых штаммов грибов рода Candida
(например,
C. glabrata
,
C. krusei
) в качестве этиологического фактора. В противном случае предпочтение следует отдавать эхинокандинам [5].
Краткая сравнительная характеристика эхинокандинов
Эхинокандины являются полусинтетическими липопептидами, полученными путем химической модификации продуктов ферментации плесневых грибов: пневмокандина B0
Glarea lozoyensis
(каспофунгин), гексапептида FR901370
Coleophoma empedra
(микафунгин) и эхинокандина B
0Аspergillus nidulans
(анидулафунгин). Эхинокандины иногда образно называют противогрибковыми пенициллинами из-за характерного для них механизма действия, заключающегося в ингибировании синтеза 1,3-β-D-глюкана, что приводит к осмотическому лизису грибковой клетки в результате повреждения ее оболочки. Препараты данной группы обладают высокой фунгицидной активностью в отношении дрожжевых грибов рода
Candida
, в том числе резистентных к другим антимикотикам, не оказывают токсического действия на макроорганизм и имеют хорошую переносимость. В отличие от азолов эхинокандины обладают потенциальной активностью в биопленках [6].
Все 3 эхинокандина характеризуются более высокими величинами минимальных подавляю- щих концентраций (МПК) в отношении C. parapsilosis
,
C. lusitaniae
и
C. guilliermondii
по сравнению с другими видами грибов рода
Candida
[7, 8]. При этом МПК90 (концентрации, вызывающие подавление роста 90% клеток) лежат в диапазоне <2 мкг/мл. Наибольшей активностью
in vitro
обладает анидулафунгин, далее по убывающей — микафунгин и каспофунгин [9]. Следует заметить, что в настоящее время рутинное определение чувствительности клинических изолятов грибов к эхинокандинам проводить не рекомендуется, так как прямая корреляция между МПК и клинической эффективностью отсутствует.
Эхинокандины обладают низкой биодоступностью при пероральном приеме, поэтому их вводят только парентерально. По сравнению с другими эхинокандинами, анидулафунгин характеризуется наибольшим объемом распределения (30-50 л) и более длительным периодом полувыведения (~26 ч) [10]. Препараты не создают эффективных концентраций в цереброспинальной жидкости и моче, что следует учитывать при инфекциях соответствующих локализаций.
Эхинокандины не оказывают значимого влияния на фармакокинетику препаратов, метаболизирующихся посредством изоферментов цитохрома Р450, не диализируются, необходимость коррекции дозы при почечной недостаточности отсутствует.
В отличие от каспофунгина и микафунгина, частично подвергающихся биотрансформации в печени, элиминация анидулафунгина обусловлена только спонтанной химической деградацией до экскретирующихся с желчью неактивных пептидных продуктов. Это обусловливает его преимущество у больных печеночной недостаточностью [11].
В настоящее время наиболее широким спектром одобренных показаний к применению обладает каспофунгин, как препарат, ранее других вышедший на рынок и вследствие этого наиболее хорошо изученный. Вместе с тем более «молодой» анидулафунгин в силу своих характеристик имеет большой клинический потенциал, который, несомненно, будет раскрыт с течением времени.
На текущий момент опыт клинического применения анидулафунгина в нашей стране минимален. Ниже приведены 3 клинических примера, иллюстрирующих результаты лечения кандидемии данным препаратом у кардиохирургических больных с осложненным течением послеоперационного периода.
Клинический пример 1
Больная Г., 53 года, с диагнозом аномалии Эпштейна, сопутствующая патология — субклинический гипотиреоз, артериальная гипертензия 2 ст. высокого риска, НК 2А, ФК 2, выполнена операция коррекции порока с протезированием трикуспидального клапана биологическим протезом в условиях искусственного кровообращения.
В раннем послеоперационном периоде отмечалась выраженная сердечная и дыхательная недостаточность, что потребовало длительного пребывания больной в отделении интенсивной терапии. На 14-е сутки после операции развилась ИВЛ-ассоциированная пневмония (Acineto- bacter baumannii
), в последующем присоединилась острая почечная недостаточность, потребовавшая проведения гемодиафильтрации и печеночная недостаточность с повышением уровня билирубина в крови до 87,4 мкмоль/л. На фоне комплекса интенсивной терапии, включающей антибактериальную терапию цефоперазоном/сульбактамом и антифунгальную профилактику флуконазолом, отмечена положительная динамика состояния больной, разрешение пневмонии, что позволило отлучить пациентку от ИВЛ и на 25-е сутки после операции перевести в палатное отделение. На 4-е сутки после перевода — состояние средней тяжести, отмечается гипотермия 35 °С, сдвиг влево в лейкоцитарной формуле (до 7% палочкоядерных форм) при уровне лейкоцитов 13,3×109/л, РСТ — 0,73 нг/мл.
Status localis
— диастаз и гиперемия краев стернотомной раны в средней и нижней трети со скудным гнойным отделяемым (поверхностная инфекция области хирургического вмешательства). При микробиологическом обследовании в посевах крови (взятых пункционно и из центрального венозного катетера) выявлен рост дрожжевых грибов, идентификация и определение чувствительности к антимикотикам в работе. Также рост дрожжевых грибов выявлен при посеве раневого отделяемого, мочи, отделяемого из зева. Оценка тяжести состояния по шкале APACHE II — 5 баллов, по SOFA — 6 баллов.
Учитывая наличие у больной клинической картины системного воспаления на фоне очага инфекции, данных микробиологического обследования и невысокого уровня РСТ, свидетельствующего против бактериальной этиологии процесса, центральный венозный катетер заменен на новый, начата антифунгальная терапия анидулафунгином в стандартном режиме (200 мг — нагрузочная доза, далее — по 100 мг в/в капельно однократно в сутки), на фоне которой отмечена положительная динамика состояния больной. Уже со следующих суток после начала терапии анидулафунгином нормализовалась температура тела, в течение последующей недели отмечен регресс воспалительных изменений по данным клинического анализа крови. По результатам микробиологического обследования во всех исследованных материалах выявлен рост Candida albicans
, чувствительного к вориконазолу, флуцитозину и амфотерицину В, умеренно чувствительного к флуконазолу. Первый отрицательный посев крови получен на 2-е сутки, санация мочевого тракта произошла на 27-е сутки противогрибковой терапии. Курс лечения анидулафунгином продолжали в течение 20 суток, после чего был назначен вориконазол еще на 1 нед.
Больная была выписана в удовлетворительном состоянии, через 2 мес после окончания терапии анидулафунгином при контрольном обследовании — клинических и лабораторных признаков инвазивного кандидоза нет.
Клинический пример 2
Больному К., 48 лет, по поводу ревматического порока сердца выполнена операция протезирования митрального клапана механическим протезом, пластика трехстворчатого клапана. Сопутствующая патология — ИБС, артериальная гипертензия 2 ст. высокого риска. В анамнезе — тромбоэмболия легочной артерии, постинфарктная пневмония. НК 2А, ФК 3.
В раннем послеоперационном периоде больной перенес острое нарушение мозгового кровообращения по смешанному типу в бассейне левой мозговой артерии, на фоне чего отмечались астенизация, персистирующая дыхательная недостаточность, энцефалопатия, почечная недостаточность, к 15-м послеоперационным суткам развилась ИВЛ-ассоциированная пневмония (Klebsiella pneumoniae
, БЛРС+), в связи с чем больной находился на продленной ИВЛ, проводилось комплексное лечение, включая антибактериальную терапию меропенемом, не- однократно выполнялись процедуры гемодиализа. На этом фоне регистрировалась некоторая положительная динамика, однако сохранялась выраженная дыхательная недостаточность, в связи с чем больной продолжал находиться в палате интенсивной терапии.
С 30-х суток после операции состояние пациента тяжелое, с отрицательной динамикой, связанной с появлением признаков системного воспаления (фебрильная лихорадка до 38,6 °С, лейкоцитоз до 18,4×109/л без сдвига влево в лейкоцитарной формуле) в отсутствие явного очага инфекции. Тест на РСТ — 0,12 нг/мл. В динамике сохраняется почечная недостаточность — уровень сывороточного креатинина до 183-204 мкмоль/л. Оценка тяжести состояния больного по шкале APACHE II — 12 баллов, по шкале SOFA — 6 баллов.
Взяты пробы крови (пункционно из периферической вены и из сосудистого катетера), мочи, отделяемого из зева и прямой кишки для микробиологического исследования. Эмпирически проведена коррекция режима антибактериальной терапии (меропенем отменен, назначены цефоперазон/сульбактам и линезолид). На следующий день во всех исследованных образцах получен рост дрожжевых грибов.
В связи с развитием у больного инвазивного кандидоза на фоне нестабильного состояния, клинической картины системного воспаления выполнена замена центрального венозного катетера, эмпирически начата терапия анидулафунгином: 200 мг нагрузочная доза, 100 мг — поддерживающая, однократно в сутки внутривенно капельно. На следующие сутки после начала лечения анидулафунгином получены результаты микробиологического обследования, в образцах крови и мочи выявлен рост Candida parapsilosis
(чувствителен к амфотерицину В, флуцитозину и вориконазолу, умеренно чувствителен к флуконазолу), при исследовании отделяемого из зева обнаружен рост
Candida krusei
(чувствителен к амфотерицину В и вориконазолу, умеренно чувствителен к флуцитозину, устойчив к флуконазолу). С учетом этих данных терапия анидулафунгином продолжена. Все последующие посевы крови были стерильны, однако длительно сохранялась асимптомная бактериурия, в связи с чем после окончания 2-недельного курса анидулафунгина больному перорально был назначен вориконазол на последующие 14 дней, после чего получены отрицательные результаты посева мочи, пациент выписан в удовлетворительном состоянии на долечивание в реабилитационный центр. При контрольном осмотре через 3 мес со дня начала лечения анидулафунгином состояние пациента удовлетворительное, самочувствие хорошее, клинико-лабораторных данных грибковой инфекции нет, почечная недостаточность разрешилась. Сохраняется резидуальная неврологическая симптоматика.
Клинический пример 3
Больная В., 74 лет, поступила для оперативного лечения по поводу критического кальцинированного порока аортального клапана. Сопутствующая патология — артериальная гипертензия 2 ст., высокого риска, сахарный диабет типа 2, компенсированный на фоне диеты и перорального приема сахароснижающих препаратов, язвенная болезнь двенадцатиперстной кишки (ремиссия), хронический неактивный вирусный гепатит В. В анамнезе 10 лет назад экстирпация матки по поводу злокачественного новообразования.
Больной выполнена операция протезирования аортального клапана биологическим протезом в условиях гипотермического искусственного кровообращения. Течение раннего послеоперационного периода осложнилось развитием острого нарушения мозгового кровообращения в бассейне правой средней мозговой артерии по типу тромбоэмболии с развитием левостороннего гемипареза, отеком головного мозга. На фоне длительной ИВЛ развилась ИВЛ-ассоциированная пневмония (Klebsiella pneumoniae
, БЛРС+). Проводилась плановая интенсивная терапия, включая антибактериальную терапию меропенемом, с положительной динамикой клинико-лабораторных данных по пневмонии. К 14-м суткам после операции отмечена вторая волна инфекции: отмечено появление стойкой гипертермии до 38,9 °С, наросли воспалительные изменения в клиническом анализе крови (лейкоцитоз 17,9×109/л, со сдвигом влево до 7% незрелых форм) на фоне низких показателей прокальцитонинового теста — 0,78 нг/мл. Оценка тяжести состояния по шкале APACHE II — 22 балла, по шкале SOFA — 9 баллов. При микроскопии осадка мочи визуализированы дрожжевые грибы. Заподозрено развитие системного кандидоза. После взятия посевов крови (пункционно и из центрального венозного катетера), мочи, мазков со слизистых оболочек зева/прямой кишки на грибы больной эмпирически начата терапия анидулафунгином (в/в капельно, однократно в сутки, нагрузочная доза — 200 мг, поддерживающая — 100 мг). На следующий день по результатам микробиологического обследования пациентки во всех исследованных образцах выявлен рост дрожжевых грибов. Выполнена замена сосудистого катетера.
К 3-м суткам лечения отмечена положительная динамика — регрессировали признаки системного воспаления, уровень РСТ снизился до 0,22 нг/мл. Получены данные микробиологического обследования: в крови выявлен рост Candida parapsilosis
(чувствителен к амфотерицину В, флуцитозину и вориконазолу, умеренно чувствителен к флуконазолу), в посеве мочи, отделяемого из зева и прямой кишки обнаружен рост
Candida albicans
(чувствителен к флуконазолу, амфотерицину В, флуцитозину и вориконазолу), с учетом этого терапия анидулафунгином продолжена. На 11-е сутки лечения анидулафунгином у больной вновь отмечен подъем температуры тела на фоне болей в животе при отрицательных перитонеальных симптомах, частого жидкого колитического стула. Верифицирован колит, ассоциированный с
Clostridium difficile
, по поводу которого назначен ванкомицин перорально, через 5 сут клиника была купирована.
Длительность терапии анидулафунгином составила 14 сут, после чего на фоне стабилизации состояния, положительной динамики по инфекции была выполнена деэскалация терапии с пероральным назначением флуконазола еще на 7 сут. После начала антифунгальной терапии при мониторинге посевов крови последние оставались стерильными, в посевах мочи грибы перестали определяться, начиная с 6-х суток лечения анидулафунгином. Больная выписана из стационара в удовлетворительном состоянии, при контрольном осмотре через 3 мес после выписки — признаков рецидива грибковой инфекции нет.
Заключение
Начальный опыт клинического применения анидулафунгина свидетельствует об эффективности данного препарата у больных с кандидемией, вызванной штаммами со сниженной чувствительностью к флуконазолу. Препарат характеризуется хорошей переносимостью, при длительности курса лечения анидулафунгином до 20 сут не зарегистрировано нежелательных лекарственных реакций. На наш взгляд, анидулафунгин является весьма перспективным средством лечения инвазивного кандидоза, особенно у пациентов с полиорганной недостаточностью или высоким риском ее развития.
Сведения об авторах
Д. А. Попов
— кандидат медицинских наук, руководитель лаборатории клинической микробиологии и антимикробной терапии
Место работы: ФГБНУ «Научный центр сердечно-сосудистой хирурги им. А.Н. Бакулева», Москва
Т. Ю. Вострикова
Место работы: ФГБНУ «Научный центр сердечно-сосудистой хирурги им. А.Н. Бакулева», Москва
Как проводится процедура?
Процедура редко занимает более тридцати минут в случае рентгеновской денситометрии и пятнадцати – в случае ультразвуковой. Все, что нужно сделать пациенту, – занять определенное положение на специальном столе для диагностики. Над исследуемым участком будет расположен детектор. Если вы не знаете, как проводится денситометрия костей, стоит узнать, что такой датчик может перемещаться над разными областями тела пациента. Уровень прохождения лучей через тело замеряется и записывается специальной программой, после чего данные подлежат обработке. Иногда части тела пациента фиксируют специальными приспособлениями, чтобы свести их подвижность к нулю, а также просят человека задержать дыхание, чтобы получить максимально четкое изображение.
Стационарное исследование
Важно узнать, что такое денситометрия, что это за процедура и чего от нее ожидать перед тем, как пройти такое обследование. Вы можете пройти диагностику во врачебном кабинете с использованием стационарного аппарата. Представляет собой специальный стол с датчиками, на который нужно ложиться пациенту.
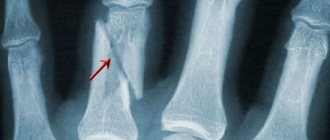
Моноблочным оборудованием
Нередко люди задаются с вопросом: «Денситометрия: что это такое, как ее проводят?», – когда им назначают такое исследование. Производиться диагностика может и при помощи переносного оборудования. Однако это не означает, что процедура может быть проведена вне диагностического центра, поскольку речь идет о рентгеновском излучении. При помощи моноблочного оборудования удобно осуществлять осмотр костей фаланг пальцев, пяточной.