Состав и форма выпуска
Медикамент выпускается сразу в нескольких формах:
- таблетки;
- мазь;
- гель;
- свечи;
- детская суспензия для перорального применения.
Активное вещество – ибупрофен.
Вспомогательные компоненты в составе таблеток: крахмал картофеля, стеарат магния, пчелиный воск, сахароза.
Составные дополнительные ингредиенты геля: этанол, лавандовое масло, вода.
Вспомогательные вещества в составе мази: макрогол.
Дополнительные составные элементы свеч: твердый жир.
История ибупрофена
Из всех противовоспалительных для ибупрофена примечательно то, что он был открыт в рамках поиска средства для лечения ревматоидного артрита (заболевания суставов).
В 1950-е годы стероиды — гормональные препараты — являлись единственным способом облегчения симптомов и снятия воспаления. Тогда перед молодым ученым Стюартом Адамсом была поставлена амбициозная цель — найти новую альтернативу стероидам, которая могла бы соревноваться с ними по эффективности, но при этом отличалась более высоким профилем безопасности с точки зрения побочных эффектов.
После тщательных десятилетних исследовательских поисков всего несколько химических соединений были допущены до клинических исследований группой ученых, возглавляемой Стюартом Адамсом. Среди них и было вещество, которое сегодня мы знаем под названием ибупрофен. В 1953 году начались исследования данного вещества в Великобритании, а уже через 16 лет оно было одобрено в качестве лекарства, отпускаемого по рецепту, для уменьшения боли и воспаления при ревматоидном артрите. С 80-х годов прошлого века ибупрофен стал применяться для снятия температуры и жара, в 1983 году получил безрецептурный статус и вышел в массовые продажи в качестве противовоспалительного, жаропонижающего и болеутоляющего препарата.
Когда нужно принимать лекарство
Лекарство в виде таблеток эффективно при следующих состояниях:
- воспалительные процессы в позвоночнике и суставах;
- умеренная боль разного происхождения (менструальная, головная, зубная, боль после хирургического вмешательства);
- лихорадка, вызванная простудной инфекцией.
Гель и мазь стоит использовать в следующих случаях: остеоартроз, артрит, подагра и другие заболевания скелетно-мышечной системы.
Свечи и сироп обычно прописывают детям с целью уменьшить температуру тела, при различных детских инфекциях и для уменьшения боли (в голове, горле, ухе).
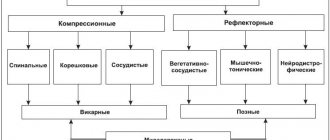
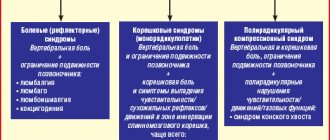
Ибупрофен в практике врача-терапевта: возможности в купировании болевых синдромов
Болевые синдромы различного происхождения часто встречаются в повседневной практике врача-терапевта, что определяет растущие потребности в эффективных обезболивающих препаратах. По данным независимого исследовательского центра DSM Group анализ фармацевтического рынка в 2012 г. показал, что болеутоляющие средства оказались одними из самых популярных групп фармацевтических препаратов [1]. Именно анальгетики являются наиболее широко востребованной категорией препаратов на фармацевтическом рынке [2].
Ощущение боли знакомо каждому человеку. Наверное, нет людей, которые в течение жизни не пережили бы чувство боли. Разнообразие причин боли обусловливает высокую обращаемость пациентов по этой причине к врачу. Следует отметить, что распространенность болевых синдромов за последние годы, несмотря на развитие фармации, нисколько не уменьшилась [3], напротив, даже наблюдается тенденция к ее росту, особенно это относится к хронической боли [4].
Верификация причины боли является одним из залогов ее успешного лечения. Среди болевых синдромов наибольший процент составляют головные боли, распространенность которых достигает 90% в популяции. Среди них несомненно доминируют головные боли напряжения (до 60%) и мигрень (до 23%). Глобальное обследование состояния здоровья, проведенное в 54 странах с участием 27 000 респондентов, показало, что головные боли являются самой частой причиной обращения за медицинской помощью и приема лекарственных средств (ЛС) (рис. 1). Распространенность первичной головной боли в России (2725 респондентов из 35 городов) достигает 62,9% с некоторым преобладанием в городской популяции, причем более чем у 10% головная боль наблюдается на протяжении более 15 дней в месяц. О самостоятельном применении безрецептурных лекарств указали 68,1% респондентов [5]. Именно головные боли являются наиболее распространенными жалобами на здоровье среди потребителей ЛС во всем мире.
В первую десятку жалоб, наряду с головной болью, входят также боли в спине, боли в горле и другие виды боли. Около 20% взрослого населения страдает от периодически повторяющихся болей в спине длительностью более трех дней, из них у 20% боли длятся более месяца и носят хронический характер. Не менее острой проблемой является и мышечная боль, которая в целом встречается 30–85% в популяции. При этом миалгии могут сопровождать вертеброгенные боли в спине (у 60% больных), но могут носить и первичный характер [6].
Рост распространенности и встречаемости болевых синдромов связывают как с изменением образа жизни, так и с общим постарением населения (рис. 2).
Основной тенденцией в предпочтениях пациентов является возможность самолечения, т. е. самостоятельный выбор обезболивающего средства. Поэтому, как показывают и данные эпидемиологических исследований, большинство пациентов с самыми распространенными формами болевых синдромов остаются вне поля зрения специалистов. Так, лишь около 10% больных с болями в спине обращается за помощью к специалистам. Похожая ситуация наблюдается и при головных болях. Так, среди больных с одной из самых распространенных форм цефалгий — мигренью — лишь 1/6 часть обращается к специалистам, остальные пациенты находятся вне их поля зрения, предпочитая лечиться самостоятельно [6].
Экономическое бремя болевых синдромов
Рост распространенности болевых синдромов в популяции является существенным бременем для работников, работодателей и общества, ведущим к недополучению прибыли и дополнительным затратам и выплатам [8]. Парадокс в фармакоэкономике боли связывают с тем, что стоимость является потенциальным барьером для оптимального ведения боли, даже субоптимальное ведение боли показывает повышение общих затрат здравоохранения [9].
Так, только в США ежегодные затраты, направленные на облегчение боли, а также судебные издержки и компенсации, связанные с болевым синдромом, оцениваются почти в 100 млрд долларов США [10]. А, к примеру, в Швеции среднегодовые затраты на лечение заболеваний, связанных с хроническим болевым синдромом (n = 840 000), составляют 6400 евро на одного пациента. Большую часть расходов (59%) составляют непрямые затраты (выплаты по больничным листам и досрочный выход на пенсию), в то время как затраты на анальгетические препараты составляют лишь около 1%. В целом социально-экономическое бремя заболеваний, связанных с хроническим болевым синдромом, только в Швеции достигает 32 млрд евро в год [11].
Нестероидные противовоспалительные средства (НПВС)
Практический опыт показывает, что для купирования субъективных болевых проявлений наиболее часто используются НПВС. Наличие универсальных механизмов возникновения боли обусловливает возможность применения лекарственных средств этой группы в различных клинических ситуациях. В Европе НПВС назначают 82% врачей общей практики и 84% ревматологов поликлиники, в стационаре их применяют у 20% больных [12].
Благодаря изученным анальгетическим, противовоспалительным, жаропонижающим механизмам действия различные представители НПВС нашли широкое практическое применение.
НПВС способны купировать боли различной локализации — в опорно-двигательном аппарате, головную, зубную, менструальную боль. Кроме того, все НПВС обладают жаропонижающими и противовоспалительными свойствами. Многообразие лечебных эффектов НПВС, а также большая распространенность клинических ситуаций, в которых они эффективны, делают препараты данной группы наиболее часто назначаемыми пациентам. Особенно возрастает потребность в НПВС у лиц пожилого возраста, нередко имеющих сопутствующие заболевания.
Основные эффекты НПВС связаны с механизмом подавления активности циклооксигеназы (ЦОГ) — фермента, регулирующего превращение арахидоновой кислоты в простагландины, простациклин и тромбоксан. Различия в выраженности противовоспалительного, анальгетического эффектов и токсического действия препаратов этого класса связаны с их различной способностью влиять на две изоформы ЦОГ — ЦОГ-1 и ЦОГ-2. Анальгетический и противовоспалительный эффекты преимущественно связаны с ингибированием ЦОГ-2, а развитие побочных эффектов — с подавлением ЦОГ-1. Поэтому выбор конкретного представителя определяется его способностью преимущественного влияния на ЦОГ-2.
Профиль анальгетической эффективности ибупрофена
Одним из наиболее известных представителей класса НПВС является ибупрофен, который успешно применяется в клинической практике более 30 лет и более 10 лет в безрецептурной форме (Нурофен). Высокая клиническая эффективность данного препарата подтверждается и высоким спросом на него среди потребителей. Так, только за последние полгода по доли от стоимостного объема продаж на территории России препарат Нурофен переместился с 8?го на 3?е место, занимая при этом лидирующие позиции по Москве [13].
Анальгетическая эффективность ибупрофена убедительно доказана на различных моделях болевого синдрома — при зубной боли [14–16], при головной боли [17–23], при боли в горле [14], при мышечно-скелетной боли [14–16] и пр.
Зубная боль является хорошо распознаваемой и достаточно чувствительной для оценки анальгетического эффекта препаратов. Ибупрофен в дозировке 200–400 мг является «золотым стандартом» при лечении умеренного болевого синдрома при послеоперационной зубной боли [14]. В метаанализе была продемонстрирована высокая эффективность ибупрофена по сравнению с плацебо по результатам 72 исследований. Ибупрофен значительно снижал боль у всех пациентов не менее чем на 50%, в среднем на 4,7 часа. Повторная анальгезия требовалась всего у 48% пациентов, принявших ибупрофен в дозе 200 мг и у 42% — в дозе 400 мг [15]. В другом метаанализе, на основании 33 исследований, было выявлено преимущество ибупрофена (400 мг) в купировании болевого синдрома после экстракции зуба по сравнению с парацетамолом (1000 мг), а также комбинацией парацетамола (600–650 мг) и кодеина (60 мг) [16].
При головной боли ибупрофен как препарат первого ряда входит в перечень анальгетиков, рекомендованных ВОЗ, а также Европейской федерацией неврологических обществ (European Federation of Neurological Societies, EFNS) для терапии приступа мигрени легкой и средней тяжести (класс А) [17, 18]. Эффективность ибупрофена в терапии цефалгий доказана во многих плацебо-контролируемых клинических исследованиях, а также нескольких метаанализах, в том числе у детей и подростков [19–23].
При боли в горле, обусловленной тонзиллофарингитом, в двойном слепом рандомизированном многоцентровом исследовании сравнивали анальгетическую эффективность ибупрофена (400 мг) или парацетамола (1000 мг). Оценивали выраженность боли при глотании, затруднение глотания, изменение интенсивности боли каждые 6 часов после приема первой дозы препаратов. Ибупрофен по сравнению с парацетамолом оказался значимо более эффективным по влиянию на выраженность боли и затруднение глотания, при этом действие ибупрофена начиналось существенно раньше, чем у парацетамола. Переносимость лечения была сопоставима в обеих группах, серьезных побочных эффектов в ходе исследования не наблюдалось. Таким образом, исследование показало, что ибупрофен является более эффективной альтернативой парацетамолу при лечении боли в горле [24].
Ибупрофен, обладая высокой эффективностью и низкой токсичностью, широко применяется при длительном лечении различных воспалительных и дегенеративных заболеваний опорно-двигательного аппарата.
Эффективность ибупрофена и его преимущества были неоднократно продемонстрированы в крупномасштабных исследованиях. Показательным примером является многоцентровое рандомизированное исследование IPSO (Ibuprofen, Paracetamol Study in Osteoarthritis), проведенное в 2004 г. с участием 222 пациентов, страдающих остеоартрозом (ОА) тазобедренного (30% пациентов) или коленного (70%) сустава. В течение двух недель по шкале WOMAC (Western Ontario and McMaster Universities osteoarthritis index) оценивалось влияние ибупрофена (400–1200 мг/сут) и парацетамола (1000–3000 мг/сут) на выраженность болевого и суставного синдромов. Результаты исследования продемонстрировали более значительное уменьшение боли в первые 6 часов после приема препарата и более выраженное дальнейшее ее снижение в течение 14 дней в группе ибупрофена по сравнению с парацетамолом. Авторами был сделан вывод, что ибупрофен при однократном (400 мг) или многократном (до 1200 мг) приеме обладает лучшим соотношением «эффективность/безопасность», нежели парацетамол [25]. Большая эффективность НПВС, в том числе ибупрофена, по сравнению с парацетамолом в лечение ОА была также продемонстрирована в Кокрановском обзоре [26].
По современным рекомендациям прием НПВС в качестве симптоматического лечения показан всем больным ревматоидным артритом (РА). Пациентам с ОА рекомендован прием НПВС только в период усиления болей и в меньших дозировках, нежели при воспалительных артритах [27, 28].
Ибупрофен возможно использовать как в монотерапии, так и в составе комбинированной терапии в сочетании с другими ЛС. Так, добавление к ибупрофену миорелаксанта центрального действия тизанидина способно не только повысить эффективность терапии, но и снизить частоту нежелательных явлений от применения НПВС. Тизанидин оказывает защитное действие на слизистую желудка от действия НПВС [29]. Этот эффект был убедительно продемонстрирован в работе Berry H. еt al., в которой изучалось добавление к терапии ибупрофеном 400 мг трижды в день тизанидина 4 мг больным с острой болью в поясничной области. Общая эффективность лечения в обеих группах оказалась практически одинаковой, однако безопасность лечения была выше при сочетанном применении ибупрофена и тизанидина. Пациенты, получавшие комбинированную терапию ибупрофен/тизанидин, значимо реже отмечали побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ) по сравнению с группой плацебо/ибупрофен (р < 0,002) [30].
Топические формы ибупрофена
Высокая востребованность препаратов ибупрофена обусловлена и разнообразием его лекарственных форм. У больных с острой или хронической мышечно-суставной болью, особенно при локальном поражении скелетно-мышечной системы и при травматических поражениях мягких тканей, возможно местное применение НПВС в виде гелей и мазей, что снижает системный эффект, а следовательно, и побочные реакции.
Эффективность данной лекарственной формы не уступает таблетированной. В ряде исследований показано, что ибупрофен, независимо от лекарственной формы, является высокоэффективным представителем НПВС с хорошим профилем безопасности.
Широкое использование топических форм ибупрофена обусловлено тем, что у пациентов, длительно принимающих пероральные формы НПВС, в 22–68% случаев могут развиться эрозивно-язвенные поражения слизистых ЖКТ, в том числе с перфорацией и кровотечением. При этом до 30% дополнительных затрат при лечении артритов может приходиться на лечение желудочно-кишечных побочных явлений, вызываемых приемом пероральных НПВС [31, 32]. Учитывая, что топические формы НПВС так же эффективны, как и пероральные, наличие более благоприятного профиля их переносимости делает их предпочтительными в определенных клинических ситуациях, например при болях в коленных суставах. Так, назначение пероральных и топических форм ибупрофена имеет эквивалентный эффект на коленную боль в течение года. Вследствие более благоприятного профиля переносимости, топические формы НПВС могут назначаться в качестве альтернативы пероральным формам [33]. По результатам Кокрановского обзора 47 исследований авторами был сделан вывод, что при использовании топических форм НПВС наблюдается хороший эффект по сравнению с энтеральным использованием и значительно меньшее количество осложнений [34].
Одинаковая эффективность применения топической формы ибупрофена (5% гель) и перорального приема ибупрофена 400 мг (1200 мг в сутки) доказана и при остром повреждении мягких тканей минимум в течение 7 дней. В обеих группах полное улучшение отмечалось между 3-м и 6-м днем терапии. Следует отметить хорошую переносимость лечения в обеих группах (выявленные случаи нежелательных явлений были не связаны с проводимым лечением) [35].
При несколько больших затратах на применение топических форм ибупрофена по сравнению с пероральными формами общие расходы на лечение сокращаются за счет уменьшения частоты побочных эффектов, что было показано при обработке результатов исследования TOIB (Topical or oral ibuprofen for chronic knee pain in older people) [36].
Профиль безопасности терапии ибупрофеном
Главной проблемой пациентов с хронической болью является безопасность используемого препарата при длительном применении. Ни для кого не секрет, что основным серьезным побочным эффектом всех НПВС является желудочно-кишечное кровотечение (ЖК-кровотечение). Во многих исследованиях отмечается, что использование ибупрофена в низких дозах (до 1200 мг/день) вызывает лишь минимальные повреждения слизистой оболочки ЖКТ даже при длительном применении. Ибупрофен как препарат с хорошо изученными фармакологическими эффектами считается «золотым стандартом» по безопасности использования, что особенно важно при лечении пациентов с хроническими болевыми синдромами. Ибупрофен в низких дозах (800–1200 мг в сутки) во многих странах одобрен для безрецептурного применения, при этом он обладает хорошим профилем безопасности, сравнимым с парацетамолом.
Увеличение рекомендованных доз (до 1800–2400 мг в день) используется при долгосрочном лечении ревматических и некоторых других заболеваний опорно-двигательного аппарата. На основании метаанализа обсервационных эпидемиологических исследований за 2000–2008 гг. установлено влияние различных НПВС на риск возникновения кровотечений из верхних отделов ЖКТ. Как изначально предполагалось, наименьшая частота ЖК-кровотечений была отмечена в группе коксибов (соотношение рисков (ОР) 1,88; 95% доверительный интервал (ДИ) 0,96–3,71), среди неселективных НПВС лучшие результаты были получены у ибупрофена (ОР 2,69; 95% ДИ 2,17–3,33), наибольший риск наблюдался у кеторолака (ОР 14,54; 95% ДИ 5,87–36,04) и пироксикама (ОР 9,94; 95% ДИ 5,99–16,50). Авторами были сделаны выводы, что частота кровотечений зависит от нескольких факторов: селективности лекарственного средства в отношении ЦОГ, дозировки и длительности применения, а также времени полувыведения или использования пролонгированной формы препарата [37]. Аналогичные результаты были продемонстрированы и в ряде более ранних метаанализов, в соответствии с которыми ибупрофен характеризовался наиболее низким риском возникновения ЖК-кровотечения по сравнению с диклофенаком, напроксеном, индометацином, пироксикамом и кетопрофеном [37–40].
Дозозависимый эффект ибупрофена на возникновение серьезных желудочно-кишечных осложнений подтвержден и в ряде других исследований. Риск серьезных желудочно-кишечных неблагоприятных событий при лечении НПВС сравнительно низок, последние отмечаются у 1% пациентов в год преимущественно при использовании их в высоких дозах при длительном лечении хронических состояний. Частота побочных эффектов при применении ибупрофена в рекомендованных дозах у детей и взрослых сопоставима с таковой у парацетамола. Из всех НПВС ибупрофен, как представляется, имеет один из лучших желудочно-кишечных профилей безопасности [41, 42].
Можно сделать однозначный вывод, что ибупрофен обладает лучшим профилем безопасности в отношении ЖКТ среди неселективных НПВС, а также относительно низким риском развития кардиоваскулярных осложнений при длительном применении.
В соответствии с существующими рекомендациями, достоверно не выявлено преимуществ в эффективности различных НПВС между собой, в том числе селективных, при лечении ревматических заболеваний, поэтому выбор препарата следует производить, основываясь на его профиле безопасности и индивидуальных особенностях пациента. Пациентам, имеющим высокий риск сердечно-сосудистых осложнений, прием коксибов противопоказан. Для снижения риска желудочно-кишечных осложнений, совместно с неселективным НПВС рекомендовано использовать мизопростол или блокаторы протонной помпы.
В настоящее время проводится первое крупное рандомизированное исследование (n = 20000 пациентов), целью которого является установление профиля безопасности целекоксиба, ибупрофена и напроксена у больных, страдающих ОА или РА с высоким риском развития кардиоваскулярных осложнений [43]. Данное исследование позволит дать более четкие рекомендации в отношении введения таких пациентов.
Заключение
Таким образом, клинический опыт использования ибупрофена при самых частых формах болевых синдромов демонстрирует его эффективность не только как средства для купирования болевых эпизодов, но и для курсового лечения хронической боли. Дополнительным преимуществом данного препарата является существование его в нескольких лекарственных формах.
Применение ибупрофена (Нурофен) отвечает современным стандартам терапии боли. Удобство применения, разнообразие лекарственных форм препарата и его доступность обуславливают высокую комплаентность пациентов предписанной терапии, что является залогом успешного лечения.
Более чем 50-летний опыт успешного применения ибупрофена в широкой клинической практике более чем в 80 странах мира в качестве безрецептурного препарата служит наглядным примером высокого профиля его эффективности и безопасности [44].
Литература
- Фармацевтический рынок России. Май 2012 г. DSMGroup. Доступно на: https://www.dsm.ru/content/file/cpravka_may_2012.pdf.
- Global Healthcare Calls for Target Marketing. Available on: https://blog.nielsen.com/nielsenwire/consumer/global-healthcare-calls-for-target-marketing/.
- Friessem C. H., Willweber-Strumpf A., Zenz M. W. Chronic pain in primary care. German figures from 1991 and 2006 // BMC Public Health. 2009; 9: 299.
- Breivik H., Collett B., Ventafridda V., Cohen R., Gallacher D. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment // Eur J Pain. 2006; 10: 287–333.
- Ayzenberg I., Katsarava Z., Sborowski A. et al. The prevalence of primary headache disorders in Russia: a countrywide survey // Cephalalgia. 2012; 32 (5): 373–381.
- Табеева Г. Р. Ибупрофен в лечении нейрогенных болевых синдромов // Consilium Medicum. 2006; 8 (2): 28–32.
- Blyth F. M., March L. M., Brnabic A. J., Jorm L. R., Williamson M., Cousins M. J. // Pain. 2001; 89 (2–3): 127–134.
- Patel A. S., Farquharson R., Carroll D. The Impact and Burden of Chronic Pain in the Workplace: A Qualitative Systematic Review // Pain Pract. 2012 .
- Chandler S., Payne R. Economics of unrelieved cancer pain // Am J HospPalliat Care. 1998; 15 (4): 223–226.
- National institute of health. The NIH Guide: new direction in pain research I. Washington (DC): US Government Printing Office; 1998.
- Gustavsson A., Bjorkman J., Ljungcrantz C. Socio-economic burden of patients with a diagnosis related to chronic pain — register data of 840,000 Swedish patients // Eur J Pain 2012; 16 (2): 289–299.
- Топчий Н. В., Топорков А. С. Оптимизация применения нестероидных противовоспалительных препаратов в общемедицинской практике // РМЖ. 2011; 19 (2): 27–32.
- Фармацевтический рынок России. Май 2012 г. DSMGroup. Доступно на: https://www.dsm.ru/content/file/cpravka_may_2012.pdf.
- Derry C., Derry S., Moore R. A., McQuay H. J. Single dose oral ibuprofen for acute postoperative pain in adults // Cochrane Database Syst Rev. 2009, Jul 8; (3): CD001548. Review. PubMed PMID: 19588326.
- Hersh E. V., Kane W. T., O’Neil M. G., Kenna G. A., Katz N. P., Golubic S., Moore P. A. Prescribing recommendations for the treatment of acute pain in dentistry // Compend Contin Educ Dent. 2011, Apr; 32 (3): 22, 24–30; quiz 31–2. PubMed PMID: 21560740.
- Ahmad N., Grad H. A., Haas D. A., Aronson K. J., Jokovic A., Locker D. The efficacy of nonopioid analgesics for postoperative dental pain: a meta-analysis // Anesth Prog. 1997, Fall; 44 (4): 119–26. PubMed PMID: 9481955; PubMed Central PMCID: PMC2148941.
- Aids for management of common headache disorders in primary care 2007 www.who.int/entity/mental_health/neurology/who_ehf_aids_headache.pdf.
- Evers S., Afra J., Frese A., Goadsby P. J., Linde M., May A., Sandor P. S. European Federation of Neurological Societies. EFNS guideline on the drug treatment of migraine — revised report of an EFNS task force // Eur J Neurol. 2009, Sep; 16 (9): 968–981. PubMed PMID: 19708964.
- Rabbie R., Derry S., Moore R. A., McQuay H. J. Ibuprofen with or without an antiemetic for acute migraine headaches in adults // Cochrane Database Syst Rev. 2010, Oct 6; (10): CD008039. Review. PubMed PMID: 20927770.
- Verhagen A. P. et al. Treatment of tension type headache: paracetamol and NSAIDs work: a systematic review // Ned Tijdschr Geneeskd. 2010; 154: A1924. Review. Dutch. PubMed PMID: 20699021.
- Suthisisang C., Poolsup N., Kittikulsuth W., Pudchakan P., Wiwatpanich P. Efficacy of low-dose ibuprofen in acute migraine treatment: systematic review and meta-analysis // Ann Pharmacother. 2007, Nov; 41 (11): 1782–91. Epub 2007 Sep 18. Review. PubMed PMID: 17878396.
- Silver S., Gano D., Gerretsen P. Acute treatment of paediatric migraine: a meta-analysis of efficacy // J Paediatr Child Health. 2008, Jan; 44 (1–2): 3–9. Epub 2007, Sep 14. Review. PubMed PMID: 17854415.
- Damen L. et al. Symptomatic treatment of migraine in children: a systematic review of medication trials // Pediatrics. 2005, Aug; 116 (2): e295–302. Review. PubMed PMID: 16061583.
- Boureau F., Pelen F., Verriere F. et al. Evaluation of lbuprofenvsParacetamol analgesic activity using a sore throat pain model // Clin Drug Invest. 1999; 17 (1): 1–8.
- Boureau F., Schneid H., Zeghari N., Wall R., Bourgeois P. The IPSO study: ibuprofen, paracetamol study in osteoarthritis. A randomised comparative clinical study comparing the efficacy and safety of ibuprofen and paracetamol analgesic treatment of osteoarthritis of the knee or hip // Ann Rheum Dis. 2004 Sep; 63 (9): 1028–34. PubMed PMID: 15308513; PubMed Central PMCID: PMC1755112.
- Towheed T. E., Maxwell L., Judd M. G., Catton M., Hochberg M. C., Wells G. Acetaminophen for osteoarthritis // Cochrane Database Syst Rev. 2006, Jan 25; (1): CD004257. Review. PubMed PMID: 16437479.
- Ревматология. Клинические рекомендации / Под ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2008. 288 с.
- Zhang W. et al. EULAR evidence based recommendations for the management of hand osteoarthritis: report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann Rheum Dis. 2007, Mar; 66 (3): 377–388. Epub 2006 Oct 17. PubMed PMID: 17046965; PubMed Central PMCID: PMC1856004
- Watanabe K., Watanabe H., Maeda Hagiwara M. et at. Influence of a muscle relaxant, tizanidine, on gastric acid secrction and ulcers in the rat // Folia Pharmacol Jpn. 1983; 82: 237–245.
- Berry H., Hutchinson D. R. Tizanidine and ibuprofen in acute low-back pain: results of a double-blind multicentre study in general practice // J Int Med Res. 1988; 16 (2): 83–91.
- Aabakken L. NSAID-associated gastrointestinal damage: methodological considerations and a review of the experience with enteric coated naproxen // Eur J RheumatolInflamm. 1992; 12 (2): 9–20.
- Russell R. I. Non-steroidal anti-inflammatory drugs and gastrointestinal damage-problems and solutions // Postgrad Med J. 2001; 77 (904): 82–88.
- Underwood M., Ashby D., Cross P. et al. Advice to use topical or oral ibuprofen for chronic knee pain in older people: randomised controlled trial and patient preference study // BMJ. 2008; 336 (7636): 138–142.
- Tiso R. L., Tong-Ngork S., Fredlund K. L. Oral versus topical Ibuprofen for chronic knee pain: a prospective randomized pilot study // PainPhysician. 2010; 13 (5): 457–467.
- Whitefield M., O’Kane C. J., Anderson S. Comparative efficacy of a proprietary topical ibuprofen gel and oral ibuprofen in acute soft tissue injuries: a randomized, double-blind study // J Clin Pharm Ther. 2002; 27 (6): 409–417.
- Castelnuovo E. et al. TOIB study team. Cost-effectiveness of advising the use of topical or oral ibuprofen for knee pain; the TOIB study Rheumatology (Oxford) 2008; 47 (7): 1077–1081.
- Masso Gonzalez E. L. et al. Variability among nonsteroidal antiinflammatory drugs in risk of upper gastrointestinal bleeding // Arthritis Rheum. 2010 Jun; 62 (6): 1592–1601. PubMed PMID: 20178131.
- Lewis S. C. et al. Dose-response relationships between individual nonaspirin nonsteroidal anti-inflammatory drugs (NANSAIDs) and serious upper gastrointestinal bleeding: a meta-analysis based on individual patient data // Br J Clin Pharmacol. 2002, Sep; 54 (3): 320–326. PubMed PMID: 12236853; PubMed Central PMCID: PMC1874428.
- Henry D. et al. Variability in risk of gastrointestinal complications with individual non-steroidal anti-inflammatory drugs: results of a collaborative meta-analysis // BMJ. 1996, Jun 22; 312 (7046): 1563–1566. PubMed PMID: 8664664; PubMed Central PMCID: PMC2351326.
- Richy F. et al. Time dependent risk of gastrointestinal complications induced by non-steroidal anti-inflammatory drug use: a consensus statement using a meta-analytic approach // Ann Rheum Dis. 2004, Jul; 63 (7): 759–766. Review. PubMed PMID: 15194568; PubMed Central PMCID: PMC1755051.
- Doyle G., Furey S., Berlin R. Gastrointestinal safety and tolerance of ibuprofen at maximum over-the-counter dose // Aliment Pharmacol Ther. 1999; 13 (7): 897–906.
- Bjarnason I. Ibuprofen and gastrointestinal safety: a dose-duration-dependent phenomenon // J R Soc Med. 2007; 100 Suppl 48: 11–14.
- Becker M. C. et al. PRECISION Investigators. Rationale, design, and governance of Prospective Randomized Evaluation of Celecoxib Integrated Safety versus Ibuprofen Or Naproxen (PRECISION), a cardiovascular end point trial of nonsteroidal antiinflammatory agents in patients with arthritis // Am Heart J. 2009, Apr; 157 (4): 606–612. Epub 2009, Feb 25. PubMed PMID: 19332185.
- Rainsford K. D. Fifty years since the discovery of ibuprofen // Inflammopharmacology. 2011, Dec; 19 (6): 293–297. PubMed PMID: 22120888.
Т. Е. Морозова, доктор медицинских наук, профессор С. М. Рыкова, кандидат медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Контактная информация об авторах для переписки
Как принимать Ибупрофен
Таблетки
В день взрослым и детям с 14-ти лет можно давать не более 4-таблеток. В зависимости от состояния доза может корректироваться и увеличиваться до 6 таблеток (доза разбивается на несколько приемов). Когда будет отмечаться улучшение состояния, дозу нужно уменьшить до первоначальной. Первую таблетку нужно выпить с утра до приема пищи, запив стаканом воды. Затем принимать по 1 таблетке после еды.
Без консультации врача таблеток можно использовать не больше 5 дней.
Свечи
Свечи ставятся ректально. При болезненных ощущениях и лихорадке доза определяется с учетом возраста и массы тела малыша. За раз можно использовать не более 10 мг на 1 кг. За день свечи можно ставить до 4-х раз. Оптимальная продолжительность использования – 3 дня. Если свечи используются как анальгетик, то их можно вводить 5 дней.
Если по истечению положенного времени лихорадка не исчезла, то стоит обратиться к детскому врачу.
Гель
За раз можно использовать полоску геля 5-9 см. Плавными легкими движениями нужно втирать гель в проблемный участок, пока состав полностью не впитается. В сутки разрешается использовать гель не более 4-х раз с повторным применением не ранее чем через 4 часа.
Продолжительность лечебного курса может составлять 15-20 дней.
Мазь
Схема использования мази во всем схожа с нанесением геля. Препарат втирают в проблемный участок кожи 3-4 раза на день. Можно использовать в течение 15-20 дней.
Детская суспензия
Ибупрофен в виде суспензии можно давать ребенку не более 3-х раз на день. Если ребенку еще не исполнился год, то перед использованием нужно обязательно проконсультироваться со специалистом. Если же лихорадка появилась в результате вакцинации, то суспензию дают 2 раза на день. Между приемами должен быть перерыв минимум в 6 часов.
Подробное описание исследования
Существует большое число различных заболеваний суставов. Среди них часто встречаются: ревматоидный артрит, подагра, постинфекционные поражения суставов. Воспаление в суставах проявляется их отеком, болезненностью, покраснением и местным повышением температуры в области поражения. Пациенты нередко испытывают боль, нарушение подвижности суставов. В дальнейшем может наблюдаться их деформация, разрушение хрящевой ткани, сужение суставной щели. Некоторые заболевания, например ревматоидный артрит, имеют также системные проявления: человек отмечает патологическую слабость, утомляемость, снижение массы тела, лихорадку.
Провести дифференциальную диагностику заболеваний суставов бывает сложно ввиду схожей симптоматики. Лабораторные анализы помогают установить верный диагноз.
Данное исследование содержит два теста, необходимых для выявления причины воспаления суставов:
- С-реактивный белок;
- Мочевая кислота.
С-реактивный белок (СРБ) — это одна из множества молекул, участвующих в иммунных реакциях. CРБ выявляется в крови пациентов при различных воспалительных процессах и считается маркером острой фазы их течения. Повышение уровня CРБ наблюдается в течение первых четырех часов от момента повреждения ткани и достигает пика через 24−72 часа.
Содержание CРБ при воспалении может быть увеличено в 20 раз и более. Наиболее распространенными заболеваниями суставов, которые сопровождаются повышением СРБ являются:
- Ревматоидный артрит;
- Подагра;
- Реактивный артрит.
СРБ также является маркёром активности заболевания.
Следует отметить, что определение уровня СРБ играет важную роль в оценке воспаления суставов, однако не является специфическим маркером данной группы заболеваний. Показатель может отражать воспаление другой локализации, в том числе на фоне острых инфекций, травм и прочих.
Мочевая кислота представляет собой один из основных продуктов обмена белков в организме человека. В основном данное вещество выводится вместе с мочой. При чрезмерном содержании мочевой кислоты в крови (гиперурикемии) наблюдается отложение ее солей (уратов) с формированием кристаллов. Последние откладываются в суставах, подкожной клетчатке, почках (где ураты могут образовывать камни).
Подагра — системная патология, для которой характерно накопление кристаллов моноурата натрия в суставах, а также иных органах и тканях. Повышение содержания мочевой кислоты позволяет заподозрить, что воспаление суставов связано с развитием данного заболевания.
Таким образом, данное комплексное исследование поможет врачу в проведении дифференциальной диагностики причин поражения суставов и подборе терапии.
Сдавать для анализа необходимо венозную кровь. Нередко комплекс назначается совместно с другими исследованиями, например общим анализом и биохимией крови, для проверки других органов и систем.
Подробное описание исследований, референсные значения представлены на страницах с описаниями отдельных исследований.
Противопоказания и нежелательные реакции
К числу противопоказаний для всех форм лекарств относят:
- язвы в желудке;
- проблемы с работой печени;
- вынашивание ребенка (3-й триместр);
- внутреннее кровотечение;
- прогрессирующая болезнь почек;
- хронические заболевания кишечника;
- повышенная чувствительность к составным компонентам.
С осторожностью следует принимать при таких состояниях и проблемах: цирроз печени, гастрит, язва желудка, проблемы с сердечно-сосудистой системой, печенью и почками.
Детям до 12 месяцев можно давать лекарство только по назначению врача и под его наблюдением.
При использовании свечей и таблеток могут проявиться следующие побочные реакции;
- раздражение и сухость в ротовой полости;
- одышка;
- ухудшение зрения;
- головная боль;
- спутанное мышление;
- нарушенный сон;
- повышенное артериальное давление;
- чрезмерное потоотделение.
Хондропротекторы и заместители внутрисуставной жидкости
Артра, Дона, Структум, Терафлекс, Хондроитин, Глюкозамин, Адгелон, Пиаскледин, Алфлутоп, Гиалуроновая кислота, Синвиск, Остенил, Нолтрекс, Синокром, Ферматрон
Хондропротекторы – это лекарства, заживляющие суставы. Мы используем их, если нарушено питание сустава (артроз, остеохондроз, обменные нарушения), или сустав был поврежден воспалением или травмой. Полноценное лечение хондропротекторами начинаем после купирования воспаления.
Лечение хондропротекторами для приема внутрь должно быть длительным: действие обычно начинается спустя 3 месяца, а устойчивый эффект – как минимум через 6 месяцев. Эти лекарства специально разработаны для длительного приема и, обычно, хорошо переносятся.
Хондропротекторы для введения в сустав или внутримышечно оказывают более быстрый эффект, подчас заметный уже после 1 инъекции. Всего на курс мы выполняем от 1 до 5 внутрисуставных или 10-20 внутримышечных инъекций, с последующим переходом на прием препаратов внутрь.
Инъекции создают высокую концентрацию лекарства непосредственно в пострадавшем суставе
Помогают работать хондропротекторам и часто используются совместно лекарства, улучшающие кровообращение и обмен веществ.
Хондропротекторы для приема внутрь. Часто используемые лекарства.
Пиаскледин – препарат растительного происхождения, регулирующий обмен в хрящевой ткани. Содержит неомыляемые соединения масел авокадо и сои. Препарат способствует замедлению развития дегенеративного процесса в хрящевой ткани, снимает боль (связанную с этим процессом) и восстанавливает двигательную функцию больного. Стимулирует синтез протеогликанов и коллагена. Способствует восстановлению хрящевой ткани. Уменьшает выработку коллагеназы.
Хондроитин и/или Глюкозамин содержатся в препаратах Артра, Дона, Структум, Терафлекс.
Хондроитин – средство, влияющее на фосфорно-кальциевый обмен в хрящевой ткани, является высокомолекулярным мукополисахаридом. Замедляет разрушение костной ткани и снижает потери кальция, ускоряет процессы восстановления костной ткани, тормозит процесс дегенерации хрящевой ткани. Препятствует сжатию соединительной ткани и играет роль своеобразной смазки суставных поверхностей. При наружном применении замедляет прогрессирование остеоартроза. Нормализует обмен веществ в гиалиновой ткани. Стимулирует регенерацию суставного хряща.
Глюкозамин – средство, влияющее на обмен в хрящевой ткани. Восполняет естественный дефицит глюкозамина, стимулирует синтез протеогликанов и гиалуроновойкислоты синовиальной жидкости; увеличивает проницаемость суставной капсулы, восстанавливает ферментативные процессы в клетках синовиальной мембраны и суставного хряща. Способствует фиксации серы в процессе синтеза хондроитинсерной кислоты, облегчает нормальное отложение кальция в костной ткани, тормозит развитие дегенеративных процессов в суставах, восстанавливает их функцию и уменьшает боли. При однократном приеме внутрь среднетерапевтической дозы максимум концентрации в плазме достигается через 3-4 ч, в синовиальной жидкости – через 4-5 ч.
Инъекционные препараты и заместители внутрисуставной жидкости. Часто используемые препараты.
Адгелон – это препарат, стимулирующий процесс регенерации хрящевой ткани. Активное вещество препарата представляет собой гликопротеин, выделенный из сыворотки крови крупного рогатого скота. Препарат способствует быстрому накоплению массы молодых хрящевых клеток и их дифференцировке, что приводит к более быстрому образованию замещающей хрящевой ткани, восстановлению ровной суставной поверхности в области повреждения и улучшению подвижности сустава. При применении препарата происходит заполнение области повреждения молодыми хрящевыми клетками. При внутрисуставных инъекциях вырабатываемое клетками хрящевой ткани основное вещество имеет более упорядоченную структуру: оно становится таким же плотным, как в нормально функционирующей хрящевой ткани.
Алфлутоп (Alflutop) – инъекционный препарат натурального происхождения. Это биоактивный концентрат из мелкой морской рыбы Килька (Sprattus sprattussprattus), Мерланг черноморский (Odontogadus merlangus euxinus), Пузанок черноморский (Alosa tanaica nordmanni), Анчоус черноморский (Engraulis encrassicholusponticus). Препарат Алфлутоп регулирует обмен веществ в хрящевой ткани, состит из мукополисахаридов, хондроитин сульфата, аминокислот, пептидов, ионов натрия, калия, кальция, магния, железа, меди и цинка. Алфлутоп предотвращает разрушение макромолекулярных структур нормальных тканей, стимулирует процессы восстановления в интерстициальной ткани и ткани суставного хряща, что объясняет его обезболивающее действие. Противовоспалительное действие Алфлутопа и регенерация тканей основаны на угнетении активности гиалуронидазы и нормализации биосинтеза гиалуроновой кислоты. Эти эффекты синергичны и обусловливают активацию процессов восстановления в тканях (в частности, восстановление обменных процессов в хрящевой ткани).
100% синтетический полимер Нолтрекс не содержит веществ животного происхождения и не является естественным метаболитом. Благодаря наличию ионов серебра в составе препарата Нолтрекс обладает антибактериальными свойствами. При введении Нолтрекса на первом этапе происходит физическое разведение соприкасающихся и трущихся поверхностей сустава пораженного остеоартрозом в результате увеличения вязкости синовиальной жидкости. Уменьшаются боли, улучшается подвижность сустава. На втором этапе за счет уникальных свойств Нолтрекс как губка всасывает суставную жидкость и воду из хряща и субхондральнойкости, обеспечивает декомпрессию болевых окончаний. На третьем этапе биохимические фрагменты суставной жидкости – ферменты воспаления и протеолиза – адсорбируются и инактивируются на строго ориентированных активных центрах полимера. Одновременно с этим происходит миграция ионов серебра к поверхности сустава, в результате чего происходит подавление эндогенной инфекции. Нолтрекс является на сегодняшний день одним из самых легко применяемых средств борьбы с артрозом. Весь процесс применения препарата сводится к обычной и очень широко распространенной процедуре — внутрисуставной инъекции, не требующей от врача никаких дополнительных навыков.
Заместители внутрисуставной жидкости – препараты гиалуроновой кислоты (Синвиск, Остенил, Синокром, Ферматрон). Терапевтический эффект Гиалуронатанатрия связан с “восполнением вязкости” внутрисуставной жидкости пораженного сустава. Кроме того, действие Гиалуроната натрия базируется на эффекте “пускового механизма” – непосредственно восстанавливает способность сустава вырабатывать гиалуронан и, таким образом, возвращает его в состояние биохимического равновесия, которое сохраняется в течение нескольких месяцев. Как показывают накопленные клинические материалы, при применении Гиалуроната натрия имеют место следующие моменты:
- восстанавливает синовиальное равновесие: повышает вязкость синовиальной жидкости, востанавливая ее смазывающие, ударопоглащающие и фильтрующие свойства;
- защищает суставной хрящ от механического и химического повреждения: восстанавливает защитное покрытие на внутренней поверхности сустава и повышает связывание свободных радикалов;
- воспаление синовиальной оболочки уменьшается и ее защитные функции восстанавливаются.
Замедление разрушения суставного хряща в комплексе с процессами восстановления биохимического равновесия синовиальной жидкости приводят к быстрому снятию болевых симптомов и регрессу явлений ограниченной подвижности в суставе.
Полезное действие Гиалуроната натрия проявляется постепенно в течение курса и сохраняется в течение нескольких месяцев. После прохождения полного курса из 5 инъекций симптомы обычно снимаются на срок от 6 до 12 месяцев.