Боли, вызванные дегенеративными процессами в суставах, – доставляют человеку немалый дискомфорт. Одно из обязательных назначений врача-ортопеда – нестероидные противовоспалительные средства, которые иногда пациент начинает принимать и по собственному усмотрению в больших количествах. О чем нужно помнить, чтобы еще больше не навредить своему здоровью?
Бесконтрольный прием НПВП – это прямой путь к обострению болезней ЖКТ
Что такое НПВП
Предназначение противовоспалительных препаратов негормонального происхождения – уменьшать и ликвидировать воспаление в суставах. Отсутствие в составе гормонов делает действие медикаментов достаточно мягким и исключает серьезные побочные эффекты. Однако это справедливо, только если лечение артроза или остеоартроза проходит под контролем специалиста.
Каков принцип действия нестероидных противовоспалительных препаратов? Как правильно их принимать? Рассказывает опытный врач, мануальный терапевт Антон Епифанов:
Алгоритмы безопасной терапии нестероидными противовоспалительными препаратами
В последние годы в периодической печати все чаще появляются сообщения об осложнениях терапии нестероидными противовоспалительными препаратами (НПВП), прежде всего – о токсическом действии данных лекарственных средств на желудочно-кишечный тракт. Учитывая крайнюю востребованность нестероидных препаратов в современной амбулаторной и госпитальной практике и колоссальный объем их рецептурного и безрецептурного отпуска, проблема осложнений терапии НПВП для популяции в целом становится весьма острой.
Проблема нестероидной гастропатии традиционно находится на стыке нескольких врачебных специальностей: с одной стороны – неврологи, ревматологи и терапевты, наиболее часто назначающие НПВП, с другой стороны – гастроэнтерологи, которые по определению, должны выявлять и лечить пациентов с нестероидной гастропатией. Но, к сожалению, наиболее часто с НПВП-индуцированным повреждением пищеварительного тракта приходиться сталкиваться хирургам. Это происходит из-за характерных особенностей клинического течения НПВП-индуцированной гастропатии, прежде всего – скудности или отсутствия симптоматики, приводящих пациентов уже не на амбулаторный прием к гастроэнтерологу, а в отделения неотложной хирургии. При этом хирургам приходится заниматься лечением не пациентов с «абстрактной журнальной» гастро- и энтеропатией, а пациентов с желудочно-кишечными кровотечениями и перфорациями, являющимися жизнеугрожающими осложнениями НПВП-индуцированных язв. Результаты этого лечения остаются весьма неутешительными: общая летальность при возникновении кровотечения или перфорации НПВП-индуцированных язв как в гастродуоденальной зоне, так и в тонкой кишке, достигает 27 – 30%.
Очевидно, что широкий спектр побочных эффектов традиционных НПВП со стороны органов пищеварения не ограничен лишь их гастротоксичностью. Не менее значимой проблемой, связанной с широким применением НПВП, является гепатотоксический потенциал данной группы лекарственных средств. На первый взгляд мишени токсического воздействия НПВП различны – слизистая оболочка пищеварительной трубки и печеночная паренхима. Однако говорить о разнонаправленном побочном действии данной группы препаратов было бы слишком упрощенно. Представляется, что гастро- и гепатотоксичность НПВП могут являться звеньями одной патогенетической цепи, одним из конечных следствий которой может быть возникновение массивной геморрагии из верхнего отдела пищеварительного тракта, что опять-таки находится в компетенции хирургов.
К сожалению, проблема токсического воздействия НПВП на пищеварительный тракт не сводится к описанию только отдельных клинических случаев. По данным наших американских коллег вероятность летального исхода от осложнений терапии нестероидными препаратами сопоставима с таковой от злокачественных новообразований и табакокурения и во много раз превышает вероятность смерти от дорожно-транспортных происшествий или бытовых несчастных случаев. Принимая во внимание высокую частоту токсического воздействия препаратов на пищеварительный тракт, а также трудности диагностики и лечения пациентов с данной патологией, большинство современных исследователей в своих работах подчеркивает, что только целенаправленная патогенетически обоснованная профилактика может явиться тем единственным средством, которое способно предотвратить зачастую фатальные осложнения терапии НПВП, и тем самым сохранить жизнь больному.
Выбор в каждом конкретном случае того или иного НПВП очевидно определяется балансом его эффективности и безопасности. Анализ отечественных и зарубежных исследований по терапии НПВП дает возможность заключить, что современные нестероидные препараты (диклофенак, напроксен, ибупрофен, кетопрофен, нимесулид, мелоксикам, целекоксиб) по своей эффективности в плане воздействия на локальную или системную воспалительную реакцию, ноцицептивную боль и гипертермию являются вполне сопоставимыми друг с другом. В качестве примера можно привести отчет R. Deyo et al. (2008), основанный на данных Cochrane Database of Systemic Reviews, о проведенном мета-анализе 65 многоцентровых исследований (11237 пациентов), посвященных оценке эффективности НПВП при дорсалгиях. На основании проведенного исследования авторы заключили, что на сегодняшний день получены четкие доказательства того, что современные НПВП, включая ингибиторы ЦОГ-2 (коксибы) обладают сходной противовоспалительной и анальгетической активностью и сопоставимой клинической эффективностью. Тем не менее, как показывает практика, предпочтение того или иного препарата по критерию его эффективности, как правило, определяется сугубо субъективным фактором, а именно — личным опытом врача. С другой стороны выбор НПВП по критерию его безопасности в отношении пищеварительного тракта должен быть основан только на объективном факторе токсического потенциала данного препарата на слизистую пищеварительной трубки и на печеночную паренхиму.
Токсический потенциал каждого конкретного НПВП в отношении слизистой пищеварительной трубки следует рассматривать, используя только альтернативную оценку: безопасен данный препарат или нет. Учитывая, что с увеличением дозы почти всех НПВП увеличивается их повреждающее действие на слизистую пищеварительной трубки, критерием безопасности нестероидного препарата является отсутствие у него дозозависимой гастротоксичности (диагр. 1, 2, 3). В свою очередь сама дозозависимая гастротоксичность определяется неселективным ингибированием традиционными НПВП обоих изоферментов циклооксигеназы 1 и 2 типа (ЦОГ-1 и ЦОГ-2). Именно по этой причине в классификациях американской Food and Drug Administration (FDA) и европейской European Medicines Agency (EMEA) все НПВП подразделяются на селективные ингибиторы ЦОГ-2 (коксибы), не обладающие дозозависимой гастротоксичностью и потому безопасные в отношении слизистой пищеварительной трубки, и на неселективные ингибиторы ЦОГ-2 (все остальные НПВП), обладающие дозозависимой гастротоксичностью и потому повреждающие слизистую пищеварительной трубки. Используемые некоторыми отечественными авторами градации НПВП на «селективные и высокоселективные ингибиторы ЦОГ-2», или на «неселективные, селективные и высокоспецифичные ингибиторы ЦОГ-2», подразумевающие наличие количественного различия в селективности, вносят в работу практического врача много путаницы и, очевидно, не должны применяться. В настоящее время имеется только один класс нестероидных препаратов, не обладающих дозозависимой гастротоксичностью и поэтому безопасных в отношении слизистой пищеварительной трубки, а именно – коксибы, единственным представителями которых, зарегистрированными в России, являются целекоксиб и эторикоксиб.
Токсическое воздействие НПВП на печеночную паренхиму является еще одним фактором, определяющим необходимость дифференцированного подхода при назначении каждому конкретному больному того или иного нестероидного средства. Большинство исследователей подчеркивает, что риск лекарственного поражения печени возрастает при наличии хронического диффузного заболевания печени любой этиологии. При этом нарушение метаболизма лекарств прямо пропорционально признакам хронической печеночноклеточной недостаточности, наиболее выраженной при циррозе печени. Как указывают H. Tan et al. (2007), клинико-морфологические формы токсического воздействия НПВП на печень могут быть весьма вариабельными: острый гепатит, холестаз, холестатический гепатит, имеющий тенденцию к хронизации гранулематозный гепатит, хронический холестаз с дуктопенией, желтая атрофия печени, проявляющаяся фульминантной печеночной недостаточностью. N. O’Connor et al. (2003) приводит два наиболее часто упоминающихся в литературе механизма повреждения печеночной паренхимы НПВП: 1) реакции гиперчувствительности, 2) метаболическое повреждение (аберрация). R. Bort et al. (1999) на основании обобщения экспериментальных данных представили последовательность событий при повреждении гепатоцита НПВП следующим образом. Основной мишенью НПВП на субклеточном уровне являются митохондрии. В процессе метаболизма НПВП цитохромом Р450 образуются производные НПВП, которые способны влиять на процессы переноса электронов в дыхательной цепи на кристах митохондрий, приводя к нарушению окислительного фосфорилирования, синтеза АТФ и энергетическому дефициту в клетке. Не исключено, что токсическим влиянием на митохондрии обладают и нативные НПВП. Нарушение процессов окислительного фосфорилирования в митохондриях и микросомальное окисление некоторых НПВП (например, напроксена) приводят к активации свободно-радикального окисления, результатом чего в конечном счете является дезорганизация мембран, гибель гепатоцита и синтопичных клеточных структур (клетки желчных протоков). Возможно, что в процессе дезорганизации цитолемма приобретает антигенные свойства, что приводит к индукции аутоиммунного ответа и морфологически проявляется как перипортальный отек и момонуклеарная инфильтрация.
По данным L. Garcia-Rodriguez et al. (1994), C. Sgro et al. (2002), I. Lacroix et al. (2004) к факторам риска развития НПВП-индуцированного повреждения печени следует относить: женский пол пациента, возраст старше 56 лет, наличие хронического аутоиммунного заболевания, наличие хронического диффузного заболевания печени, снижение функции почек, гипоальбуминемия, терапия высокими дозами НПВП наличие хронического заболевания, требующего приема НПВП, полипрагмазия.
При назначении НПВП длительным курсом или при лечении пациентов с проявлениями «идиопатической» печеночной недостаточности следует помнить о возможности трансформации гепатоксического потенциала НПВП в реальное повреждение печени с трудноконтролируемыми последствиями в виде фульминантной печеночной недостаточности и гепаторенального синдрома. Учитывая крайне ограниченную в России возможность трансплантации печени, для большинства пациентов подобные осложнения терапии НПВП становятся фатальными. Очевидно, что с клинической, да и с экономической точки зрения целесообразнее не пассивно контролировать возможные проявления гепатотоксичности (которая очень быстро сама по себе способна стать неконтролируемым процессом), а исключить саму причину гепатотоксичности. Тем боле, что для современной клинической практики доступен целый ряд НПВП, чья гепатотоксичность выражена в минимальной степени. почках м анная ситуация приводя длительного и неселективными НПВП приводят к дисбалансу в системе эндотелины (вазоконстрикция)
В обширном аналитическом отчете J. Rubenstein et al. (2004), являющимся результатом мета-анализа 8 клинических исследований гепатотоксичности НПВП, помимо установленного общего риска клинически значимого НПВП-индуцированного повреждения печени в популяции (4,8 – 8,6 / 100000 пациентов в год), приводятся данные об индивидуальных различиях гепатотоксического потенциала современных НПВП. Наибольшим потенциалом в плане НПВП-индуцированной гепатотоксичности обладают сулиндак и индометацин. Наименьшей гепатотоксичностью, исходя из результатов проведенных исследований, обладают селективный ингибитор ЦОГ-2 целекоксиб и традиционный НПВП напроксен.
Таким образом, выбор безопасного в отношении пищеварительного тракта НПВП представляет собой весьма непростую задачу, требующую оценки целого ряда факторов. Такая оценка может быть представлена в виде пошаговых алгоритмов для выбора наиболее безопасного в отношении слизистой пищеварительной трубки и печеночной паренхимы НПВП.
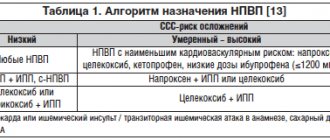
Первым этапом алгоритма выбора безопасного в отношении слизистой пищеварительной трубки НПВП (рис. 1) является тщательная и взвешенная оценка показаний к назначению НПВП. Основным показанием для применения НПВП является локальная или системная воспалительная реакция любой этиологии (инфекционный процесс, травма, аутоиммунные реакции). Хотя наличие болевого синдрома и гипертермии, являющихся проявлением воспаления, служит основанием для назначения НПВП, последние не должны являться препаратами выбора для «чистой» анальгезии или купирования лихорадки. Назначать НПВП при болях следует только при наличии доказанного ноцецептивного компонента, исключив нейропатический характер боли. Напомним, что для купирования нейропатической боли в настоящее время целенаправленно применяется целый ряд препаратов, наиболее эффективным из которых является прегабалин (Лирика®). Дифференцированный подход к анальгезии необходим не только для проведения патогенетической, а значит и эффективной терапии болевого синдрома, но и для предупреждения необоснованного (как правило, длительного и в больших дозах) назначения НПВП. Аналогично, избирательное воздействие на гипертермию при незначительной выраженности воспалительной реакции не должно являться основным поводом к назначению НПВП, в данной ситуации следует предпочесть, например, ацетаминофен.
Следующий этап алгоритма – оценка предполагаемой продолжительности курса терапии НПВП. Известно, что уже через 7 суток от начала лечения нестероидные препараты способны вызвать формирование эрозий и язв на фоне изначально интактной слизистой оболочки желудка и двенадцатиперстной кишки. Поэтому с точки зрения потенциально возможной гастротоксичности терапию НПВП следует разделять на кратковременную (менее 7 суток) и длительную (более 7 суток). Учитывая тот факт, что даже кратковременное назначение НПВП при «компрометированной» слизистой может вызвать ее повреждение, решение о терапии НПВП коротким курсом предполагает обязательное выполнение следующего этапа алгоритма – оценки факторов риска развития НПВП-гастропатии. К ним относятся: применение НПВП в максимально допустимой дозировке, сочетанный прием двух и более НПВП, сочетание НПВП с глюкокортикоидами, предшествующий прием НПВП продолжительностью более 3 месяцев, возраст пациента более 65 лет и, наконец, наличие в анамнезе язвенной болезни, ранее верифицированных острых стресс-язв или НПВП-индуцированных язв. Отсутствие указанных факторов риска возникновения НПВП-гастропатии делает возможным назначение традиционных НПВП в среднетерапевтических дозах с длительностью терапии не более 7 суток. Наличие хотя бы одного или, тем более, нескольких факторов риска развития НПВП-гастропатии определяет невозможность даже краткосрочной терапии традиционными НПВП и, одновременно, необходимость применения безопасных в отношении слизистой пищеварительного тракта селективных ингибиторов ЦОГ-2 – коксибов. Длительная терапия нестероидными препаратами, сама по себе являясь фактором риска развития НПВП-индуцированных эрозий и язв, очевидно, требует назначения коксибов. Следует напомнить, что возможная вариабельность дозировки целекоксиба (от 100 до 800 мг/сут) не влияет на его безопасность в отношении слизистой пищеварительного тракта и делает возможным проведение эффективной терапии данным препаратом при воспалении и болевом синдроме различной выраженности.
Принципиально важным моментом при назначении НПВП является оценка язвенного анамнеза пациента. При наличии субъективных жалоб (характерные боли в эпигастрии, диспепсия) или объективных анамнестических данных, указывающих на возможность или факт существования у больного патологии гастродуоденальной зоны, перед назначением любых НПВП при любой предполагаемой длительности терапии, обязательным является проведение эзофагогастродуоденоскопии (ЭГДС). Наличие гастрита, дуоденита, эрозий и, тем более, язв желудка или двенадцатиперстной кишки полностью исключает возможность применения всех традиционных (неселективных в отношении ЦОГ-2) НПВП и требует проведения специфической терапии, прежде всего – антисекреторными средствами (ингибиторы протонной помпы: омепразол 40 мг/сут). В случае наличия неосложненного эрозивно-язвенного процесса в желудке или ДПК и, одновременно, крайней необходимости в назначении НПВП принципиально возможно одновременное применение целекоксиба и ингибиторов протонной помпы, проводящееся под контролем ЭГДС (еженедельное обследование). Из этого следует, что даже при назначении в качестве НПВП целекоксиба, перед началом терапии не следует пренебрегать клинической (а в случае необходимости – и инструментальной) оценкой состояния слизистой гастродуоденальной зоны, поскольку не диагностированное эрозивно-язвенное поражение делает ошибочным назначение целекоксиба в моноварианте без антисекреторных средств.
Назначение НПВП с учетом их потенциальной гепатотоксичности также может иметь характер алгоритма (рис. 2), сходного с алгоритмом выбора безопасного в отношении гастродуоденальной слизистой нестероидного средства. На первом этапе, по аналогии с вышеописанным алгоритмом, проводится оценка показаний к назначению НПВП (локальная или системная воспалительная реакция). Затем проводится оценка факторов риска гепатотоксичности НПВП. При этом следует помнить, что гепатотоксическим потенциалом качественно обладают все современные НПВП. С другой стороны, количественный критерий гепатотоксичности позволяет разделить все НПВП на препараты с относительно высоким гепатотоксическим потенциалом (сулиндак, ибупрофен, нимесулид) и препараты с относительно низким гепатотоксическим потенциалом (напроксен, целекоксиб). Кроме того, четкого временного промежутка между началом терапии НПВП и возникновением повреждения печеночной паренхимы до настоящего времени не установлено. Поэтому разделение терапии НПВП на непродолжительную и длительную (по аналогии с гастротоксичностью) с точки зрения реализации их гепатотоксического потенциала является некорректным: развитие цитолитического или холестатического синдрома возможно уже через несколько суток от начала терапии. К факторам риска гепатоксичности НПВП относятся: возраст пациента старше 65 лет, наличие аутоиммунного заболевания, почечной недостаточности, гипоальбуминемия, прием более одного НПВП или прием НПВП в максимальной дозе, одновременное назначение большого числа лекарственных препаратов и, наконец, самое существенное – наличие исходной патологии печени. Следует заметить, что само по себе наличие острой патологии печени с синдромами цитолиза или холестаза, тем более осложненное печеночноклеточной недостаточностью, должно являться противопоказанием к назначению НПВП. Возможности проведения терапии НПВП на фоне хронического диффузного заболевания печени также весьма ограничены. Так, при наличии хронического диффузного заболевания печени перед назначением НПВП обязательным является исследование биохимических маркеров синдромов цитолиза гепатоцитов и холестаза: АлАТ, АсАТ, ГГТП, билирубина, ЩФ. Превышение данных показателей в 2 и более раза относительно верхней границы нормы указывает на невозможность проведение терапии НПВП. В случае наличия хронического диффузного заболевания печени, но незначительного отклонения (не превышающего норму более чем в 2 раза) вышеуказанных биохимических показателей терапия НПВП возможна, но при этом необходимо использовать препараты с минимальным гепатотоксическим потенциалом (напроксен, целекоксиб). При отсутствии у пациента факторов риска гепатоксичности теоретически возможно применение любого официально зарегистрированного НПВП. Однако на практике следует все же воздержаться от использования НПВП с доказанной гепатоксичностью – сулиндака, ибупрофена и нимесулида. Кроме того, вне зависимости от гепатотоксического потенциала применяемого в каждом конкретном случае НПВП, необходим динамический контроль биохимических маркеров печеночного цитолиза и холестаза, поскольку возникновение лекарственного повреждения печени – весьма труднопрогнозируемая ситуация. При длительной терапии НПВП периодичность такого контроля должна быть не меньше 1 раза в месяц.
В заключение считаем необходимым еще раз подчеркнуть, что в настоящее время, при практически сходной эффективности большинства современных НПВП, на первый план при выборе конкретного варианта терапии должен выходить критерий ее безопасности. Приоритет именно данного критерия, положенного в основу представленных алгоритмов, направленных на предупреждение или минимизацию побочных эффектов НПВП со стороны пищеварительного тракта, позволит избежать неуверенного балансирования на виртуальной грани «эффективность vs. безопасность» и проводить лечение в условиях максимального комфорта и для пациента, и для врача.
Список литературы:
- An Evidence-Based Approach to Prescribing Nonsteroidal Antiinflammatory Drugs. Third Canadian Consensus Conference. The Journal of Rheumatology 2006; 33:1.
- Bareille MP, Montastruc JL, Lapeyre-Mestre M. Liver damage and nonsteroidal anti-inflammatory drugs: case non-case study on the French pharmacovigilance database. Therpaie 2001; 56:51–5.
- Bjorkman D. Nonsteroidal anti-inflammatory drug associated toxicity of the liver, lower gastrointestinal tract and the esophagus. Am J Med 1998; 105:17–21S.
- Bombardier C. An evidence-based evaluation of the gastrointestinal safety of coxibs // Am. J. Med. — 2002. — № 89: (suppl.). — P. 3D-9D. 117
- Cochrane Database of Systemic Reviews, 2008, Issue 1.
- Crofford L. J., Lipsky P. E., Brooks P. et al. Basic biology and clinical application of specific cycloxygenase-2 inhibitors // Arthritis Pheum, 2000. — № 43. — P. 33 157-33 160.
- Deny S., Loke Y. K. Risk of gastrointestinal haemorrage with long term use of aspirin // BMJ. — 2000. — № 321. — P. 1183-1187.
- Fitzgerald G. A., Patrono C. The Coxibs, selective inhibitors of cyclooxygenase-2// New Engl. J. Med. — 2001. — Vol. 345. — P. 433-442.
- Fries J.F. NSAID gastropathy: the second most deadly rheumatic disease? Epidemiology and risk appraisal. J Rheumatol, 2000, 58(Suppl 28), 6-10.
- Garcia-Rodriguez L. A. t al. Risk of hospitalisation for upper gastrointestinal tract bleeding associated with Ketorolac, other NSAIDs, calcium antagonists, and other antihypertensive drugd // Arch. Intern. Med. — 1998. — № 158. — P. 33-39.
- Goldstein J.L., Silverstein F.E., Agrawal N.M. et al. Reduced risk of upper gastrointestinal ulcer complications with celecoxib, a novel COX-2 inhibitor. Am J Gastroenterol, 2000, 95, 1681-1690
- Goldstein J.L., Silverstein F.E., Agrawal N.M. et al. Reduced risk of upper gastrointestinal ulcer complications with celecoxib, a novel COX-2 inhibitor. Am J Gastroenterol, 2000, 95, 1681-1690
- Greaves RR, Agarwal A, Patch D, et al. Inadvertent diclofenac rechallenge from generic and non-generic prescribing, leading to liver transplantation for fulminant liver failure. Eur J Gastroenterol Hepatol 2001; 13:71–3
- https://www.emea.europa.eu/pdfs/human/press/pr/24732305en.
- https://www.fda.gov/cder/drug/infopage/cox2/
- Lanas A. et al. Am J Gastroenterol. 2005;100:1685 – 1693.
- Maddrey WC, Maurath CJ, Verburg KM, et al. The hepatic safety and tolerability of the novel cyclo-oxygenase-2 inhibitor celecoxib. Am J Ther 2000; 7:153–8.
- Merlani G, Fox M, Oehen HP, Cathomas G, Renner EL, Fattinger K, Schneeman M, Kullak-Ublick GA. Fatal hepatotoxicity secondary to nimesulide. Eur J Clin Pharmacol 2001; 57:321–6.
- Pincus T., Swearingen C., Cummins P. at al. Preference for nonsteroidal anti-inflammatory drugs versus acetaminophen and concomitant use of both types of drugs in patients with osteoarthritis. J Rheumatol, 2000, 27, 1020-1027.
- Rabinovitz M, Van Thiel DH. Hepatotoxicity of non-steroidal anti-inflammatory drugs. Am J Gastroenterol 1992; 87: 1696–704.
- Riley TR, Smith JP. Ibuprofen-induced hepatotoxicity in patients with chronic hepatitis C: A case series. Am J Gastroenterol 1998; 93:1563–5.
- Rodriguez-Gonzalez FJ, Montero JL, Puente J, et al. Orthotopic liver transplantation after subacute liver failure induced by therapeutic doses of ibuprofen. Am J Gastroenterol 2002; 97:2476–7.
- Sgro C, Clinard F, Ouazir K, et al. Incidence of drug-induced hepatic injuries: a French population-based study. Hepatology 2002; 36:451–5.
- Silverstein F.E., Faich G., Goldstein J.L. at al. Gastrointestinal Toxicity With Celecoxib vs Nonsteroidal Anti-inflammatory Drugs for Osteoarthritis and Rheumatoid Arthritis.The CLASS Study: A Randomized Controlled Trial JAMA, 2000, 284, 1247-1255.
- Simon L. S., Smolen J. S., Abramson S. B. et al Controversies in COX-2 selective inhibition // J. Rheumatol. — 2002. — № 29. — P. 1501-1510. Silverstein FE, et al. Ann Intern Med. 1998;123:241–249.
- Singh G, Lanes S, Triadafilopoulos G. The American Journale of Medicine, 2004, 100-106.
- Singh G., Fort J., Goldstein J. et al. Celecoxib versus naproxen and diclofenac in osteoarthritis patients: SUCCESS–1 study. Am. J. Med., 2006, 119, 255–266.
- Singh G., Rosen R.D. NSAID-induced gastrointestinal complications: the ARAMIS perspective-1997: Arthritis, Rheumatism, and Aging Medical Information System. J Rheumatol Suppl, 1998, 51, 8-16.
- Wongcharatrawee S, Groszmann RJ: Diagnosing portal hypertension. Baillieres Best Pract Res Clin Gastroenterol 2000 Dec; 14(6): 881-94.
Какие нестероидные противовоспалительные чаще всего назначают при артрозе
- Аспирин – показан на начальных стадиях лечения артроза и остеоартроза, однако пациентам с заболеваниями сердца, сосудов и ЖКТ необходима особая осторожность.
- Диклофенак – в таблетках или в форме мази.
- Ибупрофен – одно из наиболее распространенных средств, которое легче других переносится организмом.
- Индометацин – привлекает доступной ценой, хорошо снимает боль, однако у него много противопоказаний.
- Кетопрофен – в виде таблеток, инъекций, мазей, аэрозоля, геля, свечей и даже препарата для аппликаций.
- Мовалис – менее токсичный для ЖКТ, чем многие остальные, однако противопоказан пациентам с болезнями сердечно-сосудистой системы.
- Нимесулид – справляется с болью и воспалением, а также способствует приостановлению разрушения суставов.
- Эторикоксиб – требует строгого соблюдения дозировки, иначе возможны осложнения со стороны сердца и сосудов.
Препаратов группы НПВП очень много: назначать их должен врач
Нестероидные противовоспалительные препараты (НПВП) — эффективные средства контроля острой и хронической боли, широко используемые в комплексной терапии хронических ревматических заболеваний (РЗ). При этом большинство ревматологов рассматривают НПВП как необходимое, но при этом только симптоматическое средство, применение которого позволяет уменьшить страдания и повысить качество жизни пациентов, но не способно изменить течение заболевания [1, 2].
Подобное суждение в целом оправдано в отношении использования НПВП при таких РЗ, как ревматоидный артрит (РА) и остеоартроз (ОА). До сих пор отсутствуют клинические данные, подтверждающие способность НПВП замедлять деструкцию суставов при этих нозологических формах; более того, использование некоторых НПВП (например, индометацина) может способствовать прогрессированию ОА [3].
Однако есть РЗ, при которых НПВП оказывают не только симптоматическое, но и отчетливое патогенетическое действие. Это большая группа серонегативных спондилоартритов, в частности анкилозирующий спондилит (АС).
Патогенез АС связан с хроническим аутовоспалением, которое возникает на фоне наследственной предрасположенности и имеет в своей основе нарушение регуляции активности Т-лимфоцитов — цитотоксических клеток CD8+ (Т-киллеров). Главным плацдармом патологического процесса в дебюте АС становятся энтезисы — область прикрепления связок, сухожилий и фасций к кости. Инфильтрация этой области лимфогистиоцитарными клетками и гиперпродукция цитокинов — интерлейкинов (ИЛ) 1, 6, а также фактора некроза опухоли (ФНО) приводит к выраженному деструктивному воспалению костной ткани — остеиту [4-6]. Одновременно с воспалительным процессом (на фоне его стихания или даже в отсутствие выраженных воспалительных изменений) в области пораженных энтезисов развивается весьма характерный для АС процесс хондроидной метаплазии и дефектной эндохондральной оссцификации. Слияние отдельных участков дефектного остеогенеза приводит к формированию синдесмофитов и анкилоза, который проявляется прогрессирующим нарушением функции позвоночника [7-9].
Как и при других РЗ, современная концепция лечения АС предполагает целенаправленное воздействие на основные элементы патогенеза этого заболевания. Соответственно главными «мишенями» фармакотерапии при АС следует считать хроническое воспаление и эктопический остеогенез в области энтезисов и связок позвоночного столба.
Одним из наиболее мощных средств противовоспалительной терапии считаются генно-инженерные биологические препараты (ГИБП) — антицитокиновые средства, такие как ингибиторы ФНО (этанерсепт, инфликсимаб, адалимумаб и др.). Эти препараты эффективно подавляют системные и локальные проявления острого воспаления при АС; однако в отличие от РА их структурно-модифицирующее действие при этом заболевании отсутствует [10-12]. К настоящему времени показана способность ингибиторов ФНО тормозить образование синдесмофитов лишь при их длительном (6-8 лет) применении [13-15].
Как ни удивительно, но «старые добрые» НПВП в этом плане гораздо перспективнее: имеются серьезные основания считать, что длительный непрерывный прием этих препаратов в противовоспалительных дозах позволяет не только эффективно контролировать симптомы АС, но замедлять рентгенологическое прогрессирование этого заболевания [16-18].
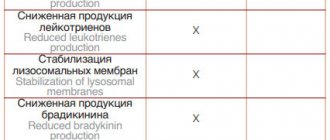
НПВП, основное действие которых связано с блокадой циклооксигеназы-2 (ЦОГ-2) и подавлением синтеза простагландинов (ПГ), способны задерживать развитие воспалительного повреждения ткани. Ведь ПГ не только медиаторы боли; эти активные вещества оказывают множество биологических эффектов, лежащих в основе воспалительной реакции. Они вызывают хемотаксис основных «агрессоров» — нейтрофилов и макрофагов, повышают проницаемость сосудов, стимулируют дегрануляцию тучных клеток, влияют на свертывающую систему крови, стимулируют катаболизм хрящевых и костных клеток и т.д. [1, 19].
Одним из важнейших биологических феноменов, определяющих хронизацию иммунного воспаления, является неоангиогенез — процесс активного формирования новых кровеносных сосудов, «врастающих» в область, затронутую патологическим процессом. Развитие грануляционной ткани, персистенция хронического синовита и формирование паннуса при РА, а также опухолевая прогрессия немыслимы без ангиогенеза. Этот процесс относится к числу ассоциированных с ЦОГ-2, поэтому НПВП, являющиеся ингибиторам ЦОГ-2, способны замедлять развитие новообразованной сосудистой ткани [20-23]. С этим фармакологическим эффектом, помимо влияния на хроническое иммунное воспаление, во многом связано антипролиферативное действие НПВП, определяющее их противоопухолевый потенциал [23].
Важно отметить, что многие этапы воспалительной агрессии, определяющие необратимые структурные изменения, связаны с экспрессией ЦОГ-2 и гиперпродукцией ПГ (прежде всего ПГЕ2). К таким элементам повреждения тканей относится синтез и активация металлопротеиназ — агрессивных ферментов, выделяемых макрофагами и нейтрофилами, которые ответственны за разрушение матрикса суставного хряща. Этот процесс опосредуется возбуждением поверхностных рецепторов к ПГЕ2 (ЕР1-ЕР4). Кроме того, с экспрессией ЦОГ-2 связано образование ядерного факторов транскрипции NF-xB, ответственного за стимуляцию синтеза оксида азота (NO) и активацию остеокластов. Необходимо отметить, что пролиферация иммунокомпетентных клеток, в частности В-лимфоцитов, стимулируется активацией рецепторов к ПГЕ2. Данный феномен отмечен, например при В-клеточных лимфомах [24-26].
В то же время НПВП могут подавлять развитие эктопической оссификации — процесса, столь важного для формирования синдесмофитов при АС. Влияние НПВП может определяться описанным выше механизмом торможения активации остеокластов и неоангиогенеза. Имеется неоспоримое доказательство данного фармакологического эффекта — практика применения НПВП для профилактики гетеротопической оссификации (ГО) после хирургических вмешательств.
ГО — патологический процесс, который характеризуется массивным отложением кристаллов кальция в мягких тканях после их обширного травматического повреждения. Эта патология нередко проявляется после «больших» ортопедических операций, таких как эндопротезирование коленных и тазобедренных суставов, правда, обычно в незначительной степени. Однако в отдельных случаях ГО очень выражена, что приводит к тяжелым функциональным нарушениям, вплоть до полного блока пораженного сустава. При этом спондилоартриты, в частности АС, — заболевания, прогрессирование которых сопровождается оссификацией элементов связочного аппарата, считается фактором риска (ФР) развития послеоперационной ГО [27, 28]. Применение НПВП в периоперационном периоде позволяет в существенной степени снизить вероятность развития этого осложнения, что подтверждается данными серии рандомизированных клинических испытаний. Так, согласно данным Кокрановского метаанализа 17 исследований, в которых изучался данный вопрос (всего 4763 больных, суммарная эффективность НПВП оказалась достаточно высокой: риск развития ГО на фоне приема средних и высоких (но не низких!) доз этих препаратов снизился на 59% [29].
Симптоматический эффект НПВП при АС не вызывает сомнений; эти препараты эффективно и быстро уменьшают боль и улучшают функцию суставов и позвоночника. При этом их терапевтический потенциал определяется в большей степени противовоспалительным, а не анальгетическим действием, что подтверждается значительным преимуществом в сравнении с плацебо и центральными анальгетиками.
Следует отметить, что эффект плацебо у пациентов с хронической болью очень выражен; что отчетливо видно при анализе действия различных анальгетиков при таких нозологических формах, как ОА и боль в нижней части спины. Так, согласно данным метаанализа R. Moor [30], эффективность НПВП при ОА превосходит результаты применения плацебо лишь на 20-30%.
При АС ситуация совершенно иная, особенно если речь идет о купировании симптомов, четко связанных с воспалением, таких, как ночные боли и утренняя скованность. В качестве иллюстрации можно привести данные 52-недельного исследования D. van der Heijde и соавт. [31], изучавших сравнительную эффективность эторикоксиба в дозе 90 и 120 мг, а также напроксена в дозе 1000 мг/сут у 387 больных АС. В начале исследования (первые 6 нед) одна из групп пациентов получала плацебо; на фоне такой «терапии» отмечалось уменьшение выраженности боли, в среднем на 12,6±2,3 мм (по 100-миллиметровой визуальной аналоговой шкале — ВАШ). Однако НПВП гораздо эффективнее: эторикоксиб снизил боль на 41,5±1,6 мм, а напроксен — на 33,7±2,3 мм. Различия особенно очевидны при анализе снижения ночной боли (шкала 0-3 балла): –0,18±0,06, –0,87±0,04 и –0,63±0,06, а также продолжительности утренней скованности: –5,5, –29,3 и –25,1 мин соответственно. Суммарно доля прерываний терапии из-за неэффективности составила в группе плацебо 47,3%, в группах эторикоксиба 7,8% (120 мг) и 9,8% (90 мг), напроксена — 20,2% [31].
Сходные результаты получены в работе M. Dougados и соавт. [32], проводивших 6-недельное сравнение эффективности целекоксиба, кетопрофена и плацебо у 246 пациентов с АС. Различие в снижении суммарной оценки боли (по ВАШ) оказалось не столь велико: в группе плацебо 3±29, кетопрофена 21±26, целекоксиба 27±30 мм. Однако в отношении ночной боли различие оказалось весьма значительным: –0,2±29,3, –16,0±31,7 и –17,7±39,3 соответственно, как и в отношении длительности утренней скованности: +7±128, –27±154 и –28±74 мин соответственно.
В последнее время накапливается все больше клинических данных, подтверждающих способность НПВП не только купировать симптомы, но и замедлять развитие АС.
Так, недавно опубликованы результаты исследования, показывающие способность НПВП существенно снижать активность АС, вплоть до развития ремиссии заболевания. J. Sieper и соавт. [33] сравнили эффективность комбинации инфликсимаб (5 мг/кг, классическая схема) + напроксен 1000 мг/сут и только напроксена 100 мг/сут у 156 больных АС. Комбинированная терапия ГИБП и НПВП оказалась более эффективной: частичная ремиссия по критериям ASAS через 6 мес лечения достигнута у 61,9% пациентов (p
=0,002). При этом в контрольной группе аналогичный результат (что стало сюрпризом) также достигнут у достаточно большого, хотя и меньшего числа больных — 35,3%.
Вероятно, одним из первых исследований, показавших благоприятное влияние НПВП на снижение темпов прогрессирования АС, была опубликованная в 1976 г. работа J. Boersma [34]. Это ретроспективный анализ применения фенилбутазона (производное пиразолона) — препарата, который в настоящее время не используется из-за риска развития гематологических осложнений, но ранее считался одним из наиболее «сильных» НПВП. Оценив результаты лечения у 40 больных АС, автор отметил наилучший результат (отсутствие или существенное замедление оссификации позвоночника) у больных, регулярно принимавших фенилбутазон; умеренные результаты были у пациентов, получавших этот препарат нерегулярно, и быстрое развитие оссификации — у лиц, не получавших терапии [34].
Наиболее важным подтверждением структурно-модифицирующего действия НПВП при АС следует считать работу A. Wanders и соавт. [35]. В ходе этого исследования 205 больных АС в течение 2 лет получали целекоксиб в дозе 200 мг/сут; 50% из них ежедневно, независимо от наличия симптомов, а вторые 50% — только при необходимости купировать боль («по требованию»). Основным критерием оценки действия препарата было рентгенологическое прогрессирование. Исследователи использовали модифицированную шкалу Стоук оценки рентгенологических изменений позвоночника при АС (modified Stoke ankylosing spondylitis spine score — mSASSS), который рассчитывался на момент включения в исследование и по его окончанию. Оказалось, что ухудшение рентгенологической картины при регулярном использовании целекоксиба отмечалось в 2 раза реже, чем при его применении «по требованию». Так, число больных с любыми негативными изменениями и тех, у кого отмечалась выраженная отрицательная динамика, составило 23 и 45%, а также 11 и 23% соответственно (p
<0,001).
Следует отметить, что замедление прогрессирования заболевания на фоне постоянного приема НПВП не ассоциировалось с более выраженным противовоспалительным эффектом: динамика индексов активности заболевания анкилозирующим спондилитом BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) и ASDAS (Ankylosing Spondylitis Disease Activity Score), а также лабораторных тестов в основной и контрольной группах не различалось [35].
В ноябре 2011 г. на конгрессе ACR представлены данные канадских ученых, которые провели аналогичное сравнение эффективности двух режимов назначения НПВП при АС. В эту работу включены лишь 40 пациентов, однако все они, и это принципиальная особенность, делающая полученные результаты особенно ценными, получали ГИБП (ингибиторы ФНО). Через 2 года у больных, получавших ГИБП без НПВП, средний счет mSASSS увеличился на 3,5 балла. При этом в группе пациентов, получавших комбинированную терапию, рентгенологические изменения практически не прогрессировали — mSASSS увеличился в среднем лишь на 0,2 балла. Как видно, НПВП в комбинации с ингибиторами ФНО обеспечивают существенно лучший патогенетический эффект при АС, чем ГИБП в виде монотерапии [36].
Столь же наглядно патогенетические возможности НПВП демонстрирует работа D. Poddubnyy и соавт. [37]. Исследуемую группу составили 164 больных (88 с достоверным АС и 76 с дорентгенологической стадией аксиального спондилоартрита), которые в течение 2 лет получали НПВП. Оказалось, что темпы рентгенологического прогрессирования у пациентов, регулярно принимавших НПВП в средних и максимальных дозах, достоверно ниже, чем у лиц, получавших эти препараты в небольших дозах «по требованию». Особенно четко это видно в подгруппе больных, исходно имевших синдесмофиты и у которых отмечалась явная системная воспалительная активность (повышение уровня С-реактивного белка — СРБ). Так, среднее значение mSSSA у регулярно принимающих НПВП составило лишь 1,81, в то время как у принимавших эти препараты «по требованию» 4,36 (р
=0,02) [37].
Эстафету доказательств патогенетической роли НПВП при лечении АС приняли французские ученые M. Blachier и соавт. [38]. Они наблюдали 475 больных АС DESIR (Devenir des Spondylarthropathies Indifferenci?es R?centes, «Исходы недифференцированных спондилоартропатий»), оценивая динамику рентгенологических признаков осевого скелета. Наличие явного повреждения отмечено у 180 (37,9%) пациентов. Дальнейший анализ позволил выявить факторы, влияющие на развитие патологии скелета. Так, с прогрессированием АС ассоциировались прием алкоголя, повышение уровня СРБ и наличие признаков сакроилеита по данным магнитно-резонансной томографии; единственным фактором, с которым связано отсутствие повреждения, был хороший ответ на терапию НПВП (взвешенное отношение шансов 0,44) [38].
Таким образом, имеются достаточно веские основания утверждать, что НПВП способны замедлять развитие АС. При этом, по всей видимости, данный эффект лишь отчасти определяется противовоспалительным действием НПВП; можно предполагать, НПВП способны подавлять патологическую пролиферацию кости с формированием синдесмофитов, лежащую в основе прогрессирования необратимых изменений позвоночника при этом заболевании [39, 40].
Поэтому регулярное использование НПВП должно считаться одним из главных направлений современной фармакотерапии АС [41]. Конечно, обсуждая возможность патогенетического применения НПВП, нельзя сбрасывать со счетов проблему побочных эффектов [42]. Структурно-модифицирующие свойства НПВП проявляются при их приеме в течение длительного срока в терапевтических дозах. В этой ситуации риск развития специфических для данного класса осложнений, прежде всего в виде нарушения структуры и функции желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой системы (ССС), может стать основным фактором, ограничивающим терапевтический потенциал этих препаратов [19].
У многих больных АС возможен умеренный или высокий риск развития осложнения в виде нарушения структуры и функции верхних отделов ЖКТ. На это указывают данные проведенного нами обследования 614 пациентов с различными формами спондилоартрита, находившихся на стационарном лечении в клинике НИИР с 1996 по 2004 г. и прошедших эндоскопическое исследование верхних отделов ЖКТ. Среди них было 60,1% мужчин молодого и среднего возраста: 85% — лица младше 50 лет.
У значительного числа обследованных имелись стандартные ФР: язвенный анамнез у 18,9%, диспепсия у 67,5%, прием высоких доз НПВП у 16,6%. При этом множественные эрозии (>10) и/или язвы ЖКТ выявлены у 16,5% пациентов [43].
J. Zochling и соавт. [44] оценили безопасность применения НПВП у 1080 больных АС, получавших эти препараты не менее 12 мес в условиях клинической практики. Наиболее часто использовали диклофенак, напроксен и индометацин. Согласно полученным данным не менее 25% пациентов отметили развитие различных побочных эффектов, наиболее часто — гастралгии, головной боли и головокружения, а также тошноты. О развитии опасных осложнений не сообщалось. Частота побочных эффектов существенно различалась в зависимости от используемых НПВП; у принимавших индометацин их число доходило до 31,4%, целекоксиб — лишь 10,5% [44].
Серьезные опасения может вызывать и известная ассоциация между АС и воспалительными заболеваниями кишечника (ВЗК). Речь может идти не только о клинически явных формах этой патологии; у многих больных АС (по разным данным, почти 50%) отмечается бессимптомное воспаление слизистой оболочки тонкой кишки, сопровождающееся повышением ее проницаемости. Эти изменения могут расцениваться как серьезный ФР развития энтеропатии, вызванной НПВП, обострения или осложнений ВЗК [45-47].
Существенное значение могут иметь и осложнения в виде нарушения структуры и функции ССС. Хотя больные АС, нуждающиеся в активной противовоспалительной терапии, в основном молодые люди, тем не менее у них отмечается повышение риска развития ССЗ. Это определяется более быстрым прогрессированием атеросклероза и протромботическими нарушениями гемостаза, связанными с системным воспалением [48, 49]. В этом плане очень важна работа Y. Huang и соавт. [50], изучавших риск развития ишемической болезни сердца (ИБС) у пациентов с АС. Эти ученые сравнили частоту развития ИБС в когорте 4794 больных АС и 23970 лиц без РЗ и соответствовавших по полу и возрасту за 3-летний период. Риск развития ИБС оказался отчетливо выше в когорте больных АС: отношение риска 1,47 (1,13-1,92) [50].
В то же время эффективное устранение основных симптомов АС (в первую очередь хронической боли) и подавление системного воспаления на фоне приема НПВП может положительно влиять на продолжительность жизни больных. Например, G. Bakland и соавт. [51], наблюдавшие когорту из 667 больных АС, отметили отсутствие регулярного лечения НПВП как важный фактор, снижающий выживаемость пациентов (стандартизованный риск смерти 4,35).
Тем не менее возможность развития осложнений требует серьезной ответственности врача и тщательного учета ФР в виде нарушения структуры и функции как ЖКТ, так и ССС [2, 19]. Рациональный выбор НПВП (например, использование селективных ингибиторов ЦОГ-2 у пациентов с сопутствующей патологией ЖКТ или, напротив, неселективных НПВП с наилучшей кардиоваскулярной переносимостью — напроксен, в комбинации с гастропротекторами) у лиц с риском развития сердечно-сосудистых осложнений способен в значительной степени снизить опасность побочных эффектов и повысить вероятность терапевтического успеха. При длительном использовании НПВП необходимы регулярные обследования пациентов (включая общий и биохимический анализ крови, при необходимости — эзофагогастродуоденоскопию) не реже 1 раза в 3-6 мес.
О чем нужно помнить, принимая препарат группы НПВП
Медикаменты этой категории оказывают достаточно быстрый обезболивающий эффект, поэтому многие пациенты не отказывают себе в «дополнительной таблетке». На самом деле такой подход очень опасен, поскольку передозировка чревата серьезными осложнениями. Поэтому медики настоятельно рекомендуют:
- принимать такие лекарства только по предписанию врача и в указанной им дозировке;
- не сочетать прием сразу нескольких средств этой группы;
- запивать медикаменты только водой, поскольку чай, кофе, сок или молоко искажают действие препарата;
- не заниматься самолечением.
Одновременный прием нестероидных средств и алкоголя несовместим и опасен для жизни
Лечение одними противовоспалительными средствами малоэффективно. Это лишь часть комплексной терапии при возрастном или посттравматическом артрозе. Для восстановления подвижности сустава необходимо пройти курс внутрисуставных инъекций, например «Нолтрекс», чтобы устранить дефицит синовиальной жидкости в суставной сумке и прекратить болезненное трение хрящей. В ряде случаев показан длительный прием хондропротекторов, физиотерапия и другие терапевтические методы. Только комплексный подход принесет результат.