В течение последнего десятилетия наблюдается заметный прогресс в лечении ревматоидного артрита, особенно в случаях, когда пациенты заболевают его формой, не реагирующей на традиционные противоревматические препараты.
Наибольшим достижением явилось создание группы лекарств, названных модификаторами биологического ответа или биопрепаратами.
Здесь представлены наименования лекарств, одобренных для безопасного лечения ревматоидного артрита. Ими являются:
- Actemra;
- Cimzia;
- Enbrel;
- Humira;
- Kineret;
- Orencia;
- Remicade;
- Rituxan;
- Simponi.
По теме:Как защитить суставы, если у вас ревматоидный артрит
Как биопрепараты помогают в лечении ревматоидного артрита?
Биопрепараты – генетически сконструированные белки, получаемые из человеческих генов. Они созданы, чтобы подавлять специфические компоненты иммунной системы, которые играют главную роль в образовании воспаления, являющегося ведущей особенностью ревматоидного артрита.
Биопрепараты используются для лечения ревматоидного артрита средней и тяжелой степени, который не поддаётся лечению уже существующими средствами.
Симптомы ревматоидного артрита
Они значительно отличаются от традиционных лекарств против данного заболевания тем, что вместо широкого воздействия на множество частей иммунной системы, биопрепараты нацелены на специфические компоненты иммунной системы.
Биопрепараты можно принимать по-отдельности, но обычно они назначаются вместе с другими медикаментами против ревматоидного артрита.
Биопрепараты назначаются, чтобы помочь замедлить развитие ревматоидного артрита, если лечение другими медикаментозными средствами оказалось безуспешным.
- Четыре действенных способа лечения ревматоидного артрита
Агрессивное лечение данного заболевания применяется, чтобы предотвратить пожизненную инвалидность, которую вызывает ревматоидный артрит.
К содержанию
1.Что такое ревматоидный артрит и его симптомы?
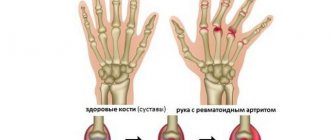
Артрит – это воспаление в суставе. Воспаление сустава вызывает покраснение, повышение температуры, отек и боль в суставе. Ревматоидный артрит является одним из видов хронического артрита, который затрагивает обе стороны тела (например, обе руки, оба запястья или оба колена). Эта симметрия помогает отличить ревматоидный артрит от других видов артрита.
Ревматоидный артрит может нанести вред не только суставам. Он способен повлиять на кожу, глаза, легкие, сердце, кровь и нервную систему.
Побочные эффекты биопрепаратов?
Наиболее распространённым побочным эффектом биопрепаратов является боль и сыпь в месте инъекции, хотя данные симптомы проявляются менее чем у 30% пациентов.
Если биопрепараты вводятся внутривенно, есть возможность появления аллергической реакции, поэтому во время вливания ведётся контроль состояния пациента.
Симптомами аллергической реакции на внутривенное вливание являются:
- лихорадка,
- озноб,
- тошнота,
- головная боль.
Так же, как и другие лекарства, подавляющие иммунную систему, биопрепараты способствуют усилению возможности заразиться инфекционным заболеванием или иными болезнями.
Пациенты, которые принимают биопрепараты, должны немедленно обратиться к врачу, если у них возникает не проходящий жар или необъяснимые симптомы.
Прививки, предотвращающие инфекции, следует делать до принятия биопрепаратов, так как во время курса биотерапии вакцинация исключена.
Биопрепараты также могут вызывать хронические болезни (например, туберкулёз), которые на ранних стадиях протекают незаметно.
Туберкулез: обзор темы
- Эффективные препараты нового поколения в лечении ревматоидного артрита
Они не рекомендованы людям с рассеянным склерозом и некоторыми другими заболеваниями, например, тяжелой сердечной недостаточностью. Всем пациентам нужно сделать кожную пробу на наличие туберкулёза перед тем, как начать курс биотерапии, многим также нужно пройти тесты на хронический гепатит.
Цена биопрепаратов выше в отличие от обычных лекарств. Однако, существуют доказательства, дающие возможность предположить, что они эффективней и вызывают меньший риск в сравнении с другими системными методами лечения.
Существенным недостатком биопрепаратов является то, что они должны быть введены в организм путем инъекции или внутривенной инфузии, за исключением Xeljanz, его принимают перорально.
Хотя исследования на животных не выявили какого-либо влияния биопрепаратов на рождаемость или ухудшение состояния плода, данные результаты не всегда могут предсказать эффект, который они будут оказывать на людей.
Беременным женщинам стоит принимать данные препараты только в случаях крайней необходимости, так как возможный эффект данных лекарств на развивающегося ребёнка недостаточно изучен.
Биотерапия временно прекращается перед операциями до тех пор, пока раны будут излечены, а риск инфекционного заражения пройдёт. По общему правилу, различные биопрепараты не следует принимать одновременно.
По теме:Как избавиться от боли при ревматоидном артрите?К содержанию
Обзор биопрепаратов от ревматоидного артрита
Здесь представлена некоторая информация о доступных сегодня биопрепаратах:
Actemra
Actemra вводят в организм ежемесячно в течение часовых инфузий или еженедельно (или раз в две недели) посредством инъекций. Препарат является первым ИЛ-6 ингибитором ревматоидного артрита. ИЛ-6 или Интерлейкин-6 — химический посланник иммунной системы.
Actemra применяют для лечения ревматоидного артрита средней и тяжёлой степени в тех случаях, когда он устойчив к одному или более ФНО ингибиторам, которые включают Cimzia, Enbrel, Humira, Remicade и Simponi.
- Некоторые вопросы лечения ревматоидного артрита с сопутствующим хроническим гепатитом В или С
Наиболее распространёнными побочными эффектами данного препарата являются:
- инфекции верхних дыхательных путей,
- воспаление носа или горла,
- головная боль,
- высокое кровяное давление,
- повышенный уровень ферментов печени.
Cimzia
Cimzia действует путём блокирования действия вещества организма, названного фактором некроза опухоли (ФНО). Препарат вводится в организм через инъекции.
Инструктаж медицинского работника позволит пациенту делать инъекции самостоятельно. После начальных доз данный биопрепарат может вводиться в организм в течение каждых 2-4 недель, в зависимости от назначенной лечащим врачом дозировки.
Вдобавок к боли в месте инъекции наиболее частые побочные эффекты Cimzia представлены:
- верхними респираторными инфекциями (например, гриппом),
- головной болью,
- высоким кровяным давлением,
- воспалением носа или горла,
- болью в спине.
Enbrel
Enbrel уменьшает воспаление суставов и вред, который наносит ревматоидный артрит, блокируя химический возбудитель воспаления, имеющий название фактор некроза опухоли (ФНО).
Enbrel также является инъекционным препаратом. Его вводят в организм подкожно дважды или один раз в неделю. Пациенты могут научиться самостоятельно делать инъекции или попросить членов семьи, сиделок, которые получили необходимые инструкции.
Препарат выпускается в виде раствора в шприцах для одноразового применения, что обеспечивает удобство для проведения самостоятельной инъекции.
Кроме боли в месте инъекции, наиболее распространёнными побочными эффектами являются:
- инфекции (такие как грипп),
- понос,
- сыпь и зуд кожи.
Humira
Humira уменьшает воспаление суставов и вред, который наносит ревматоидный артрит, блокируя химический возбудитель воспаления, имеющий название фактор некроза опухоли (ФНО).
Humira — инъекционный биопрепарат. Его вводят в организм подкожно дважды или один раз в неделю. Пациенты могут научиться самостоятельно делать инъекции или попросить членов семьи, сиделок, которые получили необходимые инструкции.
Препарат выпускается в виде раствора в шприцах для одноразового применения, что обеспечивает удобство для проведения самостоятельной инъекции.
К типичным побочным эффектам Humira, кроме боли в месте инъекции, относятся:
- верхние респираторные инфекции (включая синусит),
- головная боль,
- сыпь,
- тошнота,
- боли в спине.
Kineret
Kineret представляет собой белок, уменьшающий воспаление суставов, блокируя действие химического посланника интерлейкин-1. Данный биопрепарат вводят по одной инъекции в день (что можно сделать самостоятельно или с посторонней помощью).
Помимо боли в месте инъекции побочные эффекты Kineret представлены верхними респираторными инфекциями (включая синусит), головной болью, тошнотой и диареей.
Orencia
Orencia – белок, который блокирует сигналы, необходимые для активации Т-клеток иммунной системы. Активированные Т-клетки играют важную роль в развитии ревматоидного артрита.
Orencia можно вводить в организм внутривенным вливанием ежемесячно или инъекционно каждую неделю.
Основными побочными эффектами данного препарата являются:
- головная боль,
- воспаление носа или горла,
- головокружение,
- кашель,
- боль в спине.
Remicade
Подобно Enbrel и Humira, Remicade снижает воспаление и вред, который наносит ревматоидный артрит, блокируя химический активатор воспаления, фактор некроза опухоли (ФНО).
Remicade вводится в организм путём внутривенной инфузии в кабинете врача, центре инфузий или больнице. Проведение каждой инфузии занимает около 2 часов. Данная процедура повторяется 3 раза в течение первых шести недель терапии, затем каждые восемь недель.
Самые распространённые побочные эффекты Remicade представлены:
- инфекциями верхних дыхательных путей (включая синусит),
- тошнотой,
- головной болью,
- болями в животе,
- диарей.
Rituxan
Rituxan используется для лечения ревматоидного артрита, который не поддался лечению такими препаратами, блокирующим ФНО, как Enbrel, Humira или Remicade.
Данный биопрепарат представляет собой антитело — это белок, отслеживающий и уменьшающий количество специализированных белых клеток крови, названных В-клетками.
Rituxan вводится в организм двумя внутривенными инфузиями с промежутком в две недели. Повторный курс можно пройти через четыре или шесть месяцев.
Наиболее типичные побочные эффекты Rituxan:
- лихорадка,
- озноб,
- тошнота,
- головная боль,
- низкий уровень белых кровяных клеток (лейкопения).
Simponi
Этот биопрепарат блокирует ФНО, который вызывает воспаление. Simponi вводится раз в месяц путём инъекции или внутривенно.
Препарат выпускается в виде раствора в шприцах для одноразового применения, что обеспечивает удобство для проведения самостоятельной инъекции.
Кроме реакции в месте инфекции, побочными эффектами Simponi являются:
- инфекции верхних дыхательных путей,
- насморк,
- аномальные результаты тестов печени,
- высокое кровяное давление.
К содержанию
Глюкокортикоиды при ревматоидном артрите: за и против
Немного глюкокортикоидов, как стакан вина, могут быть полезными многим (пациентам), много глюкокортикоидов, как бутылка вина, вредны всем.
Т. Пинкус
М
есто глюкокортикоидов (ГК) в лечении ревматоидного артрита (РА) широко обсуждается ревматологическим сообществом уже более 50 лет [1–7]. Открытие чрезвычайно высокой эффективности ГК при РА явилось прорывом в лечении этого заболевания и послужило основанием для присуждения в 1950 году Нобелевской премии по медицине американским ученым Хенчу, Кендалу и Рейхстену [8]. Однако очень скоро стало очевидным, что неизбежно развивающиеся тяжелые токсические реакции при длительном приеме высоких (более 20 мг) доз ГК при РА, полностью нивелируют благоприятный эффект лечения [9]. Более того, согласно анализу базы данных (Arthritis, Rheumatism, and Aging Medical Information System –
ARAMIS
) у пациентов РА, леченных ГК, риск преждевременной летальности в 1,5 раза выше, чем у пациентов, не получавших ГК [10].
Уже начиная с конца 50–х годов, для ревматологов стало аксиомой, что назначение высоких доз ГК оправдано только по очень строгим показаниям:
- потенциально смертельные осложнения ревматоидного васкулита
- очень высокая активность ревматоидого процесса
- тяжелые осложнения терапии базисными противовоспалительными препаратами.
В остальных случаях назначение при РА высоких доз ГК и в течение длительного времени абсолютно противопоказано и может рассматриваться, как серьезная врачебная ошибка.
Однако вокруг вопроса о том, каково место «низких» доз ГК в лечении «раннего» РА, развернулись горячие дебаты [1–3,7]. Следует напомнить, что согласно современной номенклатуре под «низкими» подразумевают дозу ГК < 7,5 мг/сут (в пересчете на преднизолон), под «средними» > 7,5 мг/сут – 30 мг/сут и под «высокими дозами» – > 30 мг/сут [11], а под «ранним» РА – продолжительность заболевания не более 12 мес.
По современным представлениям РА – классическая модель хронического воспалительного заболевания человека, в основе патогенеза которого лежат тяжелые нарушения в системе иммунитета [12]. Условно выделяют два тесно взаимосвязанных, но частично протекающих независимо друг от друга патологических процесса – синовит (инфильтрация синовиальной ткани активированными лимфоцитами) и образование костных эрозий (инфильтрация синовиальной ткани активированными макрофагами). Будучи сугубо условным, это разделение имеет определенное патоморфологическое обоснование и важное клиническое значение. Если синовиальное воспаление в принципе может контролироваться нестероидными противовоспалительными препаратами (НПВП), то деструктивный процесс – только базисными противовоспалительными препаратами, а также, вероятно, ГК.
Обоснование применения ГК при раннем РА
ГК до сих пор являются наиболее эффективными противовоспалительными препаратами и потенциально обладают способностью подавлять большинство механизмов, лежащих в основе ревматоидного воспаления [3] (табл. 1).
Полагают также, что у пациентов с «ранним» РА и даже у условно здоровых людей с «доклинической» стадией РА, наблюдается «скрытая» недостаточность оси «гипоталамус–гипофиз–надпочечник», проявляющая в неадекватном синтезе эндогенного кортизола в ответ на «стрессорные» стимулы. Этот дефект может способствовать хронизации ревматоидного воспаления [13,14]. Поэтому лечение низкими дозами ГК может рассматриваться, как своеобразная форма «заместительной» терапии, направленная на корррекцию недостаточности надпочечников.
По современным представлениям ранняя агрессивная терапия позволяет существенно улучшить отдаленный прогноз при РА
[15]. При этом только ГК и, вероятно, ингибиторы фактора некроза опухоли (ФНО)–a, способны быстро подавить ревматоидное воспаление, в то время как для реализации эффекта «базисных» противовоспалительных препаратов требуется более длительное время (от нескольких недель до месяцев). Если действительно активная противовоспалительная терапия в ранней стадии РА («терапевтическое окно») имеет такое важное значение для улучшения отдаленного прогноза, это может быть дополнительным аргументом для назначения ГК в дебюте заболевания.
Таким образом, применение ГК при РА теоретически очень хорошо обосновано, однако практические результаты лечения ГК не столь обнадеживающие. До сих пор проведено очень мало контролируемых исследований, посвященных оценке эффективности ГК при раннем РА, соответствующих критериям «медицины, основанной на доказательствах» [1–4,16]. Частота, тяжесть побочных эффектов ГК и их негативный «вклад» в исходы заболевания изучены также недостаточно [1,7]. Фактически оценке истинного значения негативных эффектов ГК–терапии в зависимости от схем лечения и клинических особенностей РА посвящено значительно меньше исследований, чем изучению их эффективности.
Рассмотрим лишь некоторые аргументы «за» и «против» применения ГК при РА, а также современные рекомендации, касающиеся профилактики основных осложнений глюкокортикоидной терапии.
Клиническая эффективность
В 1997 году в обзоре Кокрейн, основанном на анализе 7 исследований, включавшем 253 пациента, о [17]. Результаты более поздних исследований также свидетельствуют о том, что назначение ГК в низких дозах (< 10 мг/сут) в сочетании с базисными противовоспалительными препаратами позволяют добиться быстрого клинического эффекта (по сравнению с плацебо). Однако эффект монотерапии ГК достаточно кратковременный и сохраняется не более 6 мес [18–20]. В рекомендациях Американской коллегии ревматологов (2002) [21] о.
Рентгенологическое прогрессирование
По современным представлениям важной «конечной точкой», позволяющей оценить отдаленный прогноз болезни, является рентгенологическое прогрессирование деструкции суставов. Замедление прогрессирования включено в официальные показания для назначения новых «базисных» противовоспалительных препаратов, таких как лефлюномид, этанерцепт и инфликсимаб. Поэтому вопрос о том, влияет ли ГК–терапия на деструкцию суставов, представляет особый интерес.
Начиная с 1980 года, проведено 10 контролируемых исследований (включавших более 700 пациентов), касающихся оценки «базисного» эффекта ГК. Результаты большинства исследований свидетельствуют о том, что ГК обладают способностью замедлять рентгенологическое прогрессирование деструкции суставов, причем этот эффект сохраняется в течение длительного времени после отмены ГК (табл. 2).
Особый интерес представляют результаты исследования
COBRA
[24], в котором у пациентов с «ранним» РА сравнивалась эффективность комбинированной терапии метотрексатом (МТ), сульфасалазином и преднизолоном (начальная доза 60 мг/сут с последующим снижением до 7,5 мг/сут в течение 7 нед) по сравнению с монотерапией сульфасалазином. В процессе проспективного наблюдения было убедительно показано, что хотя после отмены преднизолона сравниваемые группа не различались по клиническим критериям активности, у пациентов, получавших преднизолон, наблюдалось менее выраженное прогрессирование эрозивного процесса в суставах, причем этот эффект сохранялся, по крайней мере, в течение 5 лет проспективного наблюдения [26]. Сходные данные о «базисном» эффекте монотерапии ГК при «раннем» РА продемонстрированы в единственном двойном слепом плацебо–контролируемом исследовании [19].
Наши результаты свидетельствуют о том, что низкие дозы ГК в сочетании с МТ достоверно уменьшают клинико–лабораторные проявления активности при раннем РА, а эффективность терапии по критериям ACR к 12 мес. лечения достоверно выше, чем у пациентов, получавших монотерапию МТ [27] (рис 1). На фоне комбинированной терапии ГК и МТ отмечено достоверное замедление рентгенологического прогрессирования эрозивного процесса в кистях и стопах по сравнению с монотерапией МТ (p<0,05).
Рис. 1. Эффективность МТ и комбинированной терапии МТ и ГК при РА
Таким образом доказано, что при «раннем» РА применение ГК позволяет добиться следующих основных положительных эффектов [4]:
- уменьшить боли в суставах, улучшить функциональную активность
- замедлить рентгенологическое прогрессирование суставной деструкции, сохраняющееся после прекращения приема ГК
- снизить потребность в НПВП
- повысить эффективность базисной противовоспалительной терапии.
Побочные эффекты
Побочные эффекты ГК можно условно разделить на две группы – потенциально контролируемые и неконтролируемые (табл. 3), а также на «быстрые», «медленные» и «идиосинкразические».
При оценке «клинической значимости» побочных эффектов ГК следует подчеркнуть, что хотя большинство из них достаточно тяжелые и являются неизбежным последствием глюкокортикоидной терапии, некоторые развиваются реже, чем при лечении другими (симптоматическими и базисными) противовоспалительными препаратами. Необходимо принимать во внимание, что само неконтролируемое ревматоидное воспаление может приводить к развитию ряда тяжелых осложнений, которые в определенной степени напоминают побочные эффекты ГК. Это дает основание предположить, что некоторые осложнения РА, которые рассматриваются как следствие лечения ГК, на самом деле связаны с неадекватной глюкокортикоидной терапией. По нашему мнению, под неадекватной глюкокортикоидной терапией подразумевается применение слишком высоких или, напротив, слишком низких доз, неоправданная длительность лечения, монотерапия ГК без сочетанного применения эффективных базисных противовоспалительных препаратов, обладающих «стероид–сберегающей» активностью. Рассмотрим лишь несколько наиболее типичных, с нашей точки зрения, примеров.
ГК реже вызывают тяжелое поражение желудочно–кишечного тракта, чем нестероидные противовоспалительные препараты (НПВП). Двухкратное увеличение риска развития язв желудка, описанное на фоне лечения ГК, как полагают, связано с сочетанным приемом НПВП [28].
Противоречивы данные, касающиеся роли ГК в развитии атеросклеротического поражения сосудов. Поскольку воспалительная активность РА является важным «проатерогенным» фактором [29], подавление воспаления, в том числе и с помощью ГК, потенциально может снижать риск развития атеросклероза. В недавних исследованиях было показано, что ГК могут способствовать нормализации липидных нарушений, связанных с высокой воспалительной активностью РА [30].
Хотя лечение ГК может приводить к требующей коррекции гипергликемии, риск ее развития снижается по мере увеличения длительности приема ГК (с 1,7 в течение первых 45 дней, до 1,1 после 90 дней) [31]. Более того, имеются данные о том, что при РА развитие резистентности к инсулину коррелирует с активностью воспаления [32], а противовоспалительная терапия, включая глюкокортикоидную, приводит к восстановлению чувствительности к инсулину [33].
Лечение ГК ассоциируется с увеличением риска инфекционных осложнений, но это наблюдается в первую очередь у пациентов, получающих высокие дозы ГК. Например, по данным A.E. Stuck и соавт. [34], у пациентов с ревматическими заболеваниями, получающих преднизолон в дозе в среднем 8 мг/сут, увеличение частоты инфекционных осложнений не отмечается.
Не вызывает сомнения, что применение ГК даже в низких дозах (< 8 мг/сут) приводит к транзиторной супрессии оси гипоталамус–гипофиз–надпочечник. Однако в течение какого времени необходимо принимать ГК (и в каких дозах), чтобы вызвать стойкую надпочечниковую недостаточность, пока не известно. Более того, как уже отмечалось, развитие иммунопатологического процесса при РА ассоциируется с супрессией синтеза эндогенного кортизола [35].
Лечение ГК при РА, как правило, не сопровождается тяжелыми психическими нарушениями (стероидный психоз) [36], хотя и может приводить к нарушению функции на уровне гипокампа, проявляющемуся в нарушении памяти [37].
Одним из доказанных побочных эффектов ГК–терапии является развитие катаракты [38], однако влияние дозы и длительности терапии ГК на риск развития этого осложнения при РА до сих пор специально не анализировалось.
Глюкокортикоидный остеопороз
По современным представлениям наиболее неблагоприятным последствием длительной ГК–терапии является остеопороз
[39]. Риск остеопоретических переломов у пациентов РА, получавших относительно небольшие дозы ГК (в среднем 8,6 мг/сут), достигает 33% в течение 5 лет [40]. В другом исследовании было показано, что относительный риск остеопороза у пациентов с РА, леченных ГК, составляет 2,6 для бедренной кости и 2,7 для позвоночника [41]. В то же время, по данным ряда авторов, воспалительная активность РА и нарушение физической активности являются не менее важными факторами риска остеопороза, чем лечение ГК [42,43]. Поэтому у некоторых пациентов РА ГК фактически могут оказывать опосредованный благоприятный (антиостеопоретический) эффект на костную ткань, что связывают с подавлением воспалительного компонента патогенеза остеопороза [43]. По нашим данным, хотя у пациентов, получавших ГК в сочетании с МТ через 12 мес. значение МПКТ в позвоночнике и шейке бедра были ниже, чем у пациентов, получавших только МТ, эти различия (а также относительная выраженность отрицательной динамики МПКТ) были статистически не достоверны (p>0,05) (рис. 2).
Рис. 2. Динамика МПКТ в поясничном отделе позвоночника (А) и в шейке бедра (Б) на фоне лечения МТ и комбинированной терапии МТ и ГК
Тем не менее тот факт, что именно остеопоретические переломы являются наиболее тяжелыми последствиями неадекватной глюкокортикоидной терапии, не вызывает сомнения [44]. Другое потенциальное тяжелое осложнение глюкокортикоидной терапии – остеонекроз развивается значительно реже, чем остеопороз (менее, чем у 3% пациентов, принимающих ГК в низких дозах) [45].
Согласно международным рекомендациям определение МПКТ с помощью методов костной денситометрии следует проводить всем пациентам, которым планируется лечение ГК независимо от дозы в течение более 6 мес (категория рекомендаций для клинической практики А) [46]. У пациентов, не получающих антиостеопоретическую терапию, денситометрию следует повторять через каждые 6 месяцев, а у получающих эту терапию – не реже одного раза в год.
Для того чтобы снизить риск развития остеопороза, важное значение имеет изменение «стиля жизни», а именно отказ от курения и приема алкоголя, регулярные физические упражнения, прием пищи с высоким содержанием кальция и витамина D, регулярное пребывание на солнце. Рекомендации, касающиеся фармакотерапии остеопороза, суммированы в таблице 4 и на рисунке 3.
Рис. 3. Алгоритм фармакотерапии глюкокортикоидного остеопороза
Важное место в профилактике и лечении глюкокортикоидного остеопороза занимает применение
препаратов кальция и витамина D
, клиническая и фармакоэкономическая эффективность которых была подтверждена в многочисленных исследованиях [46–48]. Фактически прием препаратов кальция и витамина D рекомендуется всем пациентам РА, принимающим ГК [49]. Несомненной эффективностью обладают активные метаболиты витамина D (альфакальцидол), однако на фоне лечения этим препаратом необходим тщательный мониторинг гиперкальциемии и гиперкальциурии [50,51].
Одним из самых эффективных методов лечения ГК–остеопороза является фармакотерапия препаратами кальцитонина лосося (Миакальцик)
. Наряду с антиостеопоретической кальцитонин обладает выраженной анальгетической активностью, что делает его особенно привлекательным у пациентов с болями в позвоночнике, связанными с остеопоретическими переломами [52]. Уже после однократного применения Миакальцика назального аэрозоля у человека отмечается клинически значимая биологическая ответная реакция, которая проявляется повышением экскреции с мочой кальция, фосфора и натрия (за счет снижения их канальцевой реабсорбции) и снижением экскреции гидроксипролина. Длительное применение Миакальцика приводит к существенному и продолжительному (в течение 5 лет лечения) снижению уровня биохимических маркеров костного обмена, таких как сывороточные С–телопептиды (sCTX) и костные изоферменты щелочной фосфатазы. Применение Миакальцика назального аэрозоля приводит к статистически значимому повышению (на 1–2%) минеральной плотности кости в поясничных позвонках, которое определяется уже на первом году лечения и сохраняется до 5 лет. Миакальцик обеспечивает поддержание минеральной плотности в бедренной кости. Применение Миакальцика назального аэрозоля в дозе 200 МЕ в сутки приводит к статистически и клинически значимому снижению (на 36%) риска развития новых переломов позвонков в группе больных, получавших Миакальцик (в комбинации с препаратами витамина D и кальция), по сравнению с группой больных, получавших плацебо (в комбинации с теми же препаратами). Кроме того, в группе больных, лечившихся Миакальциком (в комбинации с препаратами витамина D и кальция), по сравнению с группой больных, получавших плацебо (в комбинации с теми же препаратами), отмечено снижение на 35% частоты множественных переломов позвонков.
Эффективными средствами при глюкокортикоидном остеопорозе являются бисфосфонаты
, которые являются мощными ингибиторами костной резорбции. На фоне лечения этими препаратами наблюдается не только существенное увеличение МПКТ, но и достоверное снижение риска остеопоретических переломов позвоночника. К недостаткам бисфосфонатов следует отнести тот факт, что их применение относительно противопоказано у женщин до менопаузы. Кроме того, имеются данные о том, что сочетанное применение бисфосфонатов и НПВП потенциально может существенно увеличивать риск язвенно–некротических поражений желудочно–кишечного тракта (пищевод, желудок).
Эффективность других препаратов (фториды, анаболические препараты, пептиды паратиреоидного гормона и др.) не является строго доказанной. Полагают, что «агрессивная» профилактика и лечение глюкокортикоидного остеопороза позволят существенно улучшить результаты лечения РА с помощью ГК и сделает применение ГК при РА более оправданным с точки зрения прогноза заболевания.
Таким образом, ГК по–прежнему остаются важным методом фармакотерапии РА. Однако лечение ГК может быть начато только после всесторонней оценки всех «за» и «против» глюкокортикоидной терапии и серьезного обсуждения с пациентом ее возможных последствий. Назначение ГК пациентам с РА – ответственное решение, которое может взять на себя только квалифицированный врач–ревматолог.
Литература:
1. Conn DL. Resolved: low–dose prednisone is indicated as a standard treatment in patients with rheumatoid arthritis. Arthritis Care&Res 2001; 45: 462–467
2. Saag KG. Resolved: low–dose glucocorticoids are neither safe nor effective for long–term treatment of rheumatoid arthritis. Arthritis Care&Res 2001; 45: 468–471
3. Moreland LW, O`Dell JR. Glucocorticoids and rheumatoid arthritis. Back to the future? Arthritis Rheum 2002; 40: 2553–2563.
4. Conn DL, Lim SS. New role for an old friend; prednisone is a disease–midifying agent in early rheumatoid arthritis. Curr Opin Rheumatol 2003; 15: 193–198
5. Насонов Е.Л. Лечение ревматоидного артрита: роль глюкокортикоидов. Клин медицина 1999;4: 4–8
6. Pincus T, Sakka T, Stein CM. Are long–term very low doses of prednisolon for patients with rheumatoid arthritis as helpful as high doses are harmful? Ann Intern Med 2002; 136; 76–78.
7. Bijsma JW, Boers M, Saag KG, Furst DE. Glucocorticoids in the treatment of early and late RA. Ann Rheun Dis 2003; 62: 1033–1037.
8. Hench PS, Kensall EC, Slocumb CH, Polley HF. The effect of a hormone of the adrenal cortex (17–hydroxy–11–dehydrocortisone; compound E) and the pituitary adrenocorticotropic hormone on rheumatoid arthritis. Proc Staff Meet Mayo Clin 1949; 24: 181
9. Bollet AJ, Black R, Bunim JJ. Major undesirable effects resulting from prednisolone and prednisone. JAMA 1955; 158: 459–463.
10. Wolfe F, Mitchell DM, Sibley JT, et al. The mortality of rheumatoid arthritis. Arthritis Rheum 1994; 37: 2529–2533.
11. Buttgereit F, Da Silva JAP, Boers M, et al. Standartized nomenclature for glucocorticoid dosage and glucocorticoid treatment regimes: current questions and tentative answers in rheumatology. Ann Rheum Dis 2002; 61: 718–722.
12. Firenstein GS. Evolving concepts of rheumatoid arthritis. Nature 2003; 423: 356–361
13. Dekker JC, Greenen R, Godaert GLR. Bjisma JWL. Diulnar rhythm of salivary cortisol in patients with RA. Arthritis Rheum 2000; 43: 465–467
14. Cutolo M, Foppiani L, Prete C, et al. Hypothalamic–pituitary–adrenocortical axis in premenopausal rheumatoid arthritis not treated with flucocorticoids. J Rheumatol 1999; 26: 282–288.
15. Насонов Е.Л. Почему необходима ранняя диагностика и лечение ревматоидного артрита? РМЖ 2002; 10 (22);1009–1014
16. Супоницкая ЕВ. Влияние низких доз глюкокортикоидов на деструкцию суставов и минеральную плотность костной ткани притраннем ревматоидном артрите. Научно–практическая ревматология 2003; 4: 78–81.
17. Criswell LA, Saag KG, Sems KM, Welch V, et al. Moderate–term, low–dose corticosteroids for rheumatoid arthritis. Cochrane Database Syst Rev 2000; CD01158.
18. Hansen M, Podenphant J, Florescu A, et al. A randomized trial of differentiated prednisolone treatment in active rheumatoid arthritis. Clinical benefits and skeletal side effects. Ann Rheum Dis. 1999; 58: 713–718
19. Van Everdinger AA, Jacobs JWG, et al. Low dose prednisolone therapy for patients with early active rheumatoid arthritis; clinical efficacy, disease modifying propwerties and side effects: a randomizes double0blind placebo–controlled trial. Ann Intern Med 2002; 136: 1–12
20. Kirwan JR. Arthritis and Rheumatism Council Low–dose glucocorticoid study group. The effect of glucocorticoids on joint destruction in rheumatoid arthritis. N Engl J Med 1995; 333; 142–145.
21. ACR Subcomitte on Rheumatoid Arthritis Guidelines. Guidelines for management of RA; 2002 update. Arthritis Rheum 2002; 46: 328–246.
22. Harris ED Jr, Emkey RD, Nichols JE, Newbwerg A. Low dose prednisolon therapy in rheumatoid arthritis.: a double blinf study. J Rheumatol 1983; 19: 1520–1526.
23. Milliom R, Poole P, Kellegren JH, Jayson MI. Long–term study management of rheumatoid arthritis. Lancet 1984; 1: 812–816
24. Boers M, Verhoeven AC, Markusse HM, et al. Randomized comparison of combined step–down prednisolon, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis. Lancet 1997; 350: 309–318.
25. Paulus HE, di Primeo D, Sanda M, et al. Progression of radiographic joint erosion during low dose corticosteroid treatment of rheumatoid arthritis J Rheumatol 2000; 27: 1632–1637.
26. Landewe RB, Boers M, Verhoeven AC, et al. COBRA combination therapy in patients with early rheumatoid arthritis: long–term structural benefits of a brief intervention. Arthritis Rheum 2002; 46: 347–356.
27. Suponitskay EV, Nassonov EL, Smirnov AV, Demin NV. Effects of low dose glucocorticoids in the treatment of early active rheumatoid arthritis. Resuls of the 1–st year srudy. Ann Rheum Dis 2003; 62 (Suppl 1): THUO190:167 (abst).
28. Piper JM, Ray WA, Daugherty JR, Griffin MR. Corticosteroid use and peptic ulcer: role non–steroidal anti–inflammatory drugs. Ann Intern Med 1991; 114: 735–740.
29. Sattar N, McCarey DW, Capell H, McInnes IA. Explaining how « high–grade» systemic inflammation accelerated vascular risk in rheumatoid arthritis. Circulation 2003; 108: 2957–2963.
30. Boers M, Nurmahamed MT, Doelman CJA, et al. Influence of glucocorticoids and disease activity on total and high density lipoprotein cholesterol in patients with rheumatoid arthritis. Ann Rheum Dis 2003; 62: 842–845.
31. Gurwitz JH, Bohn RL, Glynn RJ, et al. Glucocorticoids and the risk for initiation of hypoglycemic therapy. Arch Intern Med 1994; 154: 97–101.
32. Dessein PH, Stanwix AE, Joffe BI. Cardiovascular risk in rheumatoid arthritis versus osteoarthritis: acute phase response related decrease insulin sensitivity and high–density lipoprotein cholesterol as well as clustering of metabolic syndrome features in rheumatoiod arthritis. Arthrits Res 2002; 4:R5–R12.
33. Halgren R, Berne C. Glucose intolerance in patients with chronic inflammatory diseases is normalized by glucocorticoids. Acta Med Scand 1983; 213: 351–355.
34. Stuck AE, Minder CE, Frey FJ. Risk of infectious complications in patients taking glucocorticosteroids. Rev Infect Dis 1989; 11: 954–963.
35. Bijsma JWJ, Straub RH, Masi AT, et al. Neuroendocrine immune mechanisms in rheumatic disease. Trends Immunol 2002; 23: 59–61
36. Wolkowitz OM, Reus VI, Canick J, et al. Glucocorticoid medication. Memory and steroid psyhosis in medical illness. Ann N Y Acad Sci 1997; 823: 81–96.
37. Keenan PA, Jacobson MW, Soleymani RM, et al. Commonly used therapeutic doses of glucocorticoids impair explicit memory. Ann N Y Acad Sci 1995; 761: 400–402
38. Carnahan MC, Goldstein DA. Ocular complications of topical, peri–ocular, and systemic cortocosteroids. Curr Opin Ophtalmol 2000; 11: 478–483
39. Насонов Е.Л. Глюкокортикоидный остеопороз: современные рекомендации. Консилиум, 2002; 4(8): 403–408
40. Michel BA, Bloch DA, Fries JF. Predictors of fracture in early rheumatoid arthritis. J Rheumatol 1991; 18: 804–808.
41. Haugeberg G, Orstavic RE, Uhlig T, et al. Bone loss in patients with rheumatoid arthritis: results from a population–based cohort of 366 patients followed up for two years. Arthritis Rheum 2002; 46: 1720–1728.
42. Jolles BM, Boloch ER. Current consensus recommendations for rheumatoid arthritis therapy: a blind spot for osteoporosis prevention and treatment J Rheumatol 2002
43. Verhoeven A, Boers M. Limited bone loss due to cortocosteroids: a systemic review of prospective studies in rheumatoid arthritis and other disease. J Rheumatol 1997; 24: 1495–1503.
44. Van Staa T, Leufkens H, Abenhaim L, et al. Use of oral corticosteroids and risk of fracture. J Bone Miner Res 2000; 15: 993–1000.
45. Vreden SG, Hermus AR, van Liessum PA, t al. Aseptic bone necrosis in patients on glucocorticoid replacement therapy. Neth J Med 1991; 114: 735–740
46. Аmerican College of Rheumatology ad Hoc committie on glucocorticoid–induced osteoporosis. Recommendation for the prevention of glucocorticoid–induced osteoporosis. Arthritis Rheum 2001; 44: 1496–1503
47. Brown JP, Josse RG, for the Scientific Advisory Council of the Osteoporosis Society of Canada. Canadian guidelines for osteoporosis. CMAJ 2002; 167 (Suppl 10): S1–S34
48. Yeap SS, Hosking DJ. Management of corticoid–induced osteoporosis. Rheumatology 2002; 41: 1088–1094.
49. Amin S, LaValley MP, Simms RW, Felson DT. The role of vitamin D in corticosteroid–induced osteoporosis: a meta–analytic approach. Arthritis Rheum 1999; 42: 1740–51
50. Jehle PM. Steroid–induced osteoporosis: how can it be avoided? Nephrol Dial Transplant 2003; 18: 861–864.
51. Насонов ЕЛ, Гукасян ДА. Применение альфакальцидола (альфв–D3–Тева) для профилактики и лечения остеопороза. Терапевт. архив 2000, 11, 71–73.
52. Cranney A, Welch V, Adachi JD, Homik J, Shea B, Suarez–Almazor ME, et al. Calcitonin for the treatment and prevention of corticosteroid–induced osteoporosis Cochrane review. In: The Cochrane Library. Issue 2. Oxford (UK): Update Software; 2000
Что такое биопрепараты
Биопрепараты могут вводиться в организм посредством самоинъекций
Около двадцати лет назад Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило первый биопрепарат для лечения ревматоидного артрита. С тех пор организация разрешила использовать врачам ещё 8 похожих препаратов, а также новые синтетические средства.
Если говорить упрощённо, то биологические препараты или биологические агенты — это белки, которые были генетически модифицированы для нейтрализации тех клеток иммунной системы, которые атакуют здоровые ткани и тем самым вызывают симптомы ревматоидного артрита.
Биологические агенты принадлежат к числу средств целевой или таргетной терапии. Этим они отличаются от других лекарств от РА, которые в медицинской практике принято называть традиционными. Примером таких средств может послужить метотрексат, который не атакует специфические клетки.
Авторы статьи, опубликованной в 2021 году научным журналом Clinical Pharmacology & Therapeutics, указали, что биопрепараты способны замедлять прогрессирование повреждений в суставах, вызванных ревматоидным артритом.
Биологические препараты не всегда предлагаются в качестве первой линии лечения РА. У многих пациентов при данном состоянии симптомы возникают на фоне проблем с несколькими типами иммунных клеток, а биологические агенты могут воздействовать только на один тип.
Притом что врачи могут выписывать сразу несколько биопрепаратов, с каждым новым лекарством растёт количество проявляемых побочных эффектов.
Иногда врач назначает лечение биологическими препаратами вместе с приёмом традиционных лекарственных средств. В таких ситуациях поиск наиболее эффективной комбинации для борьбы с уникальными симптомами может занять некоторое время.
Кто может заболеть ревматоидным артритом?
По статистике, ревматоидный артрит встречается примерно у 1% людей. Это аутоиммунное заболевание, при котором иммунная система организма атакует собственные здоровее клетки и ткани. Ревматоидный артрит в два-три раза чаще встречается у женщин, чем у мужчин, но симптомы у мужчин, как правило, симптомы артрита гораздо серьезнее. Ревматоидный артрит, как правило, развивается в среднем возрасте, но у маленьких детей и пожилых людей это заболевание тоже встречается.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Виды биопрепаратов
Одним из примеров биологических препаратов является ритуксимаб
Врачи классифицируют биологические агенты по типу клеток, с которыми они взаимодействуют. Ниже перечислены названия фармацевтических групп с кратким описанием.
Ингибиторы B-лимфоцитов
- Пример. Ритуксимаб (Ритуксан).
- Принцип действия. Препараты из этого класса уничтожают B-лимфоциты, вызывающие воспаление. Они должны вводиться внутривенно за два сеанса каждые 6–12 месяцев. Один сеанс длится от 4 до 6 часов. Пациенты, которые подвергаются лечению ингибиторами B-лимфоцитов при помощи внутривенных вливаний, связаны с риском развития инфекций и .
Блокаторы интерлейкина-1
- Пример. Анакинра (Кинерет).
- Принцип действия. Блокаторы интерлейкина-1 или ИЛ-1-блокаторы взаимодействуют с интерлейкином — воспалительным соединением, которое присутствует в организме. Такие средства выписываются реже, чем другие биологические агенты, предназначенные для лечения ревматоидного артрита. ИЛ-1-блокаторы пациенты вводят самостоятельно на ежедневной основе.
Ингибиторы интерлейкина-6
- Примеры. Сарилумаб (Кевзара), тоцилизумаб (Актемра).
- Принцип действия. Эти препараты предотвращают взаимодействие белков интерлейкин-6 с клетками и таким образом не допускают воспаления. Сарилумаб — это инъекционный препарат, который люди должны получать каждые две недели. Тоцилизумаб — ещё одно средство из этой группы, вводимое внутривенно один раз в месяц.
Ингибиторы T-лимфоцитов
- Пример. Абатецепт (Оренция).
- Принцип действия. Такие препараты прикрепляются к поверхности T-лимфоцитов, то есть белых кровяных клеток, вызывающих воспалительный процесс. Врачи вводят ингибиторы T-лимфоцитов внутривенно в течение 30 минут каждую вторую неделю на протяжении полутора месяцев. После этого пациенты начинают подвергаться вливаниям каждые четыре недели.
Ингибиторы фактора некроза опухоли (ФНО-ингибиторы)
- Примеры. Адалимумаб (Хумира), цертолизумаб (Симзия), голимумаб (Симпони); инфликсимаб (Ремикейд).
- Принцип действия. Эти препараты способны подавлять активность фактора некроза опухоли (ФНО), который ответственен за начало стадий воспаления. ФНО-ингибиторы выписываются врачами чаще других средств, поскольку они уже достаточно давно используются для лечения ревматоидного артрита. Инфликсимаб вводится в организм внутривенно, а другие препараты можно использовать посредством самоинъекций.
Ещё один биопрепарат — тофацитиниб (Яквинус). Он взаимодействует с белками, которые вызывают ревматоидный артрит и имеют название янус киназы. Однако указанное средство нацелено на белки, которые находятся внутри клеток, в то время как все остальные препараты воздействуют на белки, расположенные за пределами клеток.
В отличие от других биопрепаратов, которые должны вводиться внутривенными инъекциями, тофацитиниб можно принимать в форме таблеток два раза в день.
3.Диагностика и лечение болезни
Диагностика ревматоидного артрита
Для диагностики ревматоидного артрита используются несколько методов:
- Анализ симптомов артрита – симметричность болезненных суставов, жесткость суставов по утрам, боль и т.д. Образование под кожей ревматоидных узелков;
- Рентгеновское исследование;
- Анализы крови.
У большинства людей с ревматоидным артритом (но не у всех) в крови присутствуют особые антитела (ревматоидный фактор). Этот ревматоидный фактор может быть в крови и у тех людей, у которых нет артрита. Поэтому диагноз ревматоидный артрит нельзя ставить на основании одного этого анализа. Другие антитела, обнаруженные в крови, могут указывать на агрессивную форму ревматоидного артрита или, например, на аутоиммунное заболевание в целом.
При артрите может развиваться умеренная анемия, а значит, при анализе крови это тоже будет видно, как и воспаление.
Лечение ревматоидного артрита
Есть много способов лечения ревматоидного артрита. Оно может включать сочетание лекарств, режима отдыха и физических нагрузок, хирургические вмешательства для коррекции повреждения суставов. Конкретная схема лечения артрита зависит от возраста пациента, общего состояния здоровья, истории болезни и тяжести артрита.
Многие лекарства способны помочь при болях в суставах, отеке и воспалении. Какие-то из препаратов способны предотвратить или замедлить прогрессирование болезни. Врач может рекомендовать как противовоспалительные обезболивающие препараты типа аспирина или ибупрофена, так и обезболивающие мази (кремы), кортикостероиды или наркотические обезболивающие. Применяются для лечения ревматоидного артрита и сильнодействующие противоревматические препараты, которые подавляют иммунную систему и ее атаку на суставы.
Если лекарственная терапия не дает нужных результатов, для лечения артрита может понадобиться хирургическая операция на суставах
.
Как используются биологические препараты
За исключением тофацитиниба, большинство биологических препаратов вводятся в организм при помощи внутривенных вливаний или самоинъекций.
Такие средства не выпускаются в форме таблеток, поскольку они содержат молекулы, которые считаются слишком маленькими для того, чтобы достигать кровотока. Поэтому врачи вводят их непосредственно в кровь или в те участки тела, которые расположены близко к кровотоку. Врач может обсудить с пациентом метод введения лекарства, а также график приёма вливаний или выполнения инъекций.
Одни биопрепараты оказывают воздействие на организм практически сразу же после проникновения в организм, другие — проявляют свой эффект через продолжительное время.
Побочные эффекты биопрепаратов
Самый распространённый побочный эффект инъекционных или инфузионных биологических агентов — развитие инфекции. Введение таких средств может раздражать кожные покровы и обуславливать проникновение в организм бактерий и вирусов, которые являются потенциальными возбудителями инфекционных заболеваний.
К числу очень редких побочных эффектов биопрепаратов относятся отёки лодыжек и кистей рук
Кроме того, биологические агенты затрагивают клетки иммунной системы, в результате чего способность организма противостоять инфекциям может ухудшаться.
К числу очень редких побочных эффектов биопрепаратов относится следующее:
- синдром демиелинизации, который характеризуется повреждением нервных волокон и иногда вызывает зрительные нарушения;
- развитие симптомов, характерных для волчанки;
- реактивация гепатита B у людей, которые перенесли гепатит B;
- отёчность рук и лодыжек, одышка или внезапное развитие сердечной недостаточности;
- воздействие на ферменты печени.
Перед назначением любых лекарственных средств врачи обсуждают их потенциальные побочные эффекты с пациентами. Некоторые биологические агенты связаны с более высоким риском развития инфекций по сравнению с другими препаратами из этой группы.