Болезнь Педжета – это опасная патология, при которой замедляется восстановление костных тканей, а на их месте возникает аномальное образование. Болезнь может прогрессировать на любых костях человеческого скелета и, как правило, затрагивает 3 или более костей. В случае отсутствия своевременной диагностики и оперативного обращения за квалифицированной медицинской помощью, лечение будет проходить с максимальной сложностью и потребует очень большого отрезка времени.
Причины возникновения
Содержание
скрыть
1 Причины возникновения
2 Болезнь Педжета: симптомы
3 Схожесть с остеоартритом 3.1 Болезнь Педжета: способы диагностики 3.1.1 Способы лечения болезни Педжета
До сегодняшнего дня причина возникновения этого заболевания не известна современной медицине. При этом существует теория, что она возникает благодаря наличию у пациента генетической предрасположенности. Также в ряде источников упоминается, что это заболевание может образовываться ввиду наличия в организме неправильной работы фосфорного и кальциевого метаболизма. В качестве третей причины появления заболевания называются вирусные инфекции, например такие, как корь. Чаще всего от этой болезни страдают сильные представители человечества, имеющие возраст более 40 лет. Если говорить о детях, то необходимо отметить, что у них данное заболевание практически не встречается.
1.Общие сведения
Болезнь Педжета – редкая самостоятельная форма рака молочной железы с локализацией очага в соске или ареоле. Данное заболевание впервые было описано знаменитым анатомом и хирургом А.Вельпо (Франция, 1856), однако названо по имени английского хирурга Джеймса Педжета, который детально исследовал эту разновидность рака (1874), акцентировав его патогенетическую связь с возникающей в дальнейшем карциномой молочной железы.
Следует отметить, что именем Дж.Педжета названо еще два онкозаболевания, – неоплазии кости и женских гениталий, – поэтому в каждом случае приходится уточнять, о какой именно болезни Педжета идет речь.
Эпидемиологические оценки варьируют в пределах 0,5-5% от общего объема рака молочных желез. В абсолютном большинстве случаев (свыше 95%) при болезни Педжета диагностируются и другие неоплазии молочной железы. Заболевают как женщины, так и мужчины (обычно в более позднем, по сравнению с женщинами, возрасте и в более агрессивной форме). Средний возраст выявления болезни Педжета – около 65 лет; у молодых людей эта форма рака является спорадической редкостью.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Болезнь Педжета: симптомы
На сегодняшний день медицина отмечает прямую взаимосвязь между симптоматикой, тяжестью болезни, а также поражённостью костями. Наиболее часто от этой болезни страдают кости ног и рук, черепа, таза и позвоночника. Если говорить о симптомах формирования и развития болезни, то они могут протекать по-разному:
В ряде случаев заболевание протекает без наличия каких-либо симптомов.
Наличие у болезни высокой тяжести, при которой присутствуют сильные болевые ощущения и происходит деформация костей.
Однако чаще всего медицина отмечает наличие у пациентов промежуточного варианта течения болезни. Данному варианту присущи следующие характеристики:
- Болезненные ощущения при проведении пальпации.
- Присутствие на костях утолщённых участков, которые легко обнаружить путём простого прощупывания.
- Присутствие тупой ноющей боли в области поражённой кости.
Деформирующий остит: через 100 лет после Дж. Педжета
В
1999 г. исполнилось 100 лет со дня смерти английского хирурга и патолога Джеймса Педжета (род. в 1814 г.), с именем которого в медицине связано 3 заболевания:
деформирующий остит
(osteitis deformans; другие названия: костная болезнь Педжета, деформирующий остоз, деформирующая остеопатия), а также
рак Педжета
(экземоподобный рак молочной железы) и
синдром Педжета–Шреттера
(острый тромбоз подключичной вены). В 1876 г. (за 20 лет до открытия рентгеновских лучей) Дж. Педжет сообщил (в 1877 г. опубликовал статью) о 5 пациентах с распространенным поражением скелета, преимущественно черепа и длинных костей нижних конечностей, сопровождающимся их утолщением, размягчением и деформацией, и назвал это заболевание деформирующим оститом, предполагая, что в его основе лежит воспаление костной ткани. К 1882 г. он наблюдал уже 23 случая болезни и подробно описал не только клиническую картину, но и секционные данные.
Воспалительная природа заболевания была отвергнута в 20-е годы нашего столетия, после чего костную болезнь Педжета (КБП) некоторое время относили к разновидности фиброзных остеодистрофий, куда включали также фиброзный остит – системное поражение костной ткани, описанное немецким патологом Ф. Реклингхаузеном в 1891 г., и фиброзную дисплазию костей. Но уже в 30-е годы каждое из этих заболеваний было признано самостоятельным. При фиброзном остите установлена гиперфункция паращитовидных желез (одним из первых в 1925 г. эту связь выявил А.В. Русаков), а фиброзная дисплазия костей была отнесена к врожденным аномалиям (предположение о дефекте развития остеобластов при этом заболевании первым в 1927 г. высказал В.Р. Брайцев). КБП была обособлена после классических работ Г. Шморля (1930–1932 гг.). В нашей стране патоморфологию КБП впервые подробно описал А.И. Абрикосов (1926 г.).
Костная болезнь Педжета – приобретенное хроническое заболевание, обусловленное локальными нарушениями ремоделирования костной ткани
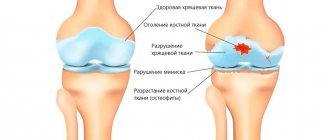
(см. схему). Считается, что патологический процесс инициируется усиленной резорбцией, осуществляемой остеокластами, что приводит к компенсаторному увеличению образования новой костной ткани. При этом синтезируется избыточное количество коллагеновых волокон, располагающихся разнонаправленно, не упорядоченно, что приводит к формированию не пластинчатой, как в норме, а грубоволокнистой, избыточно васкуляризированной костной ткани, которая закономерно образуется в эмбриональном периоде, а в зрелом возрасте наблюдается только в местах заживления переломов и при гиперпаратиреозе. Многократно повторяющиеся процессы резорбции и новообразования приводят к дезорганизации архитектоники костной ткани. Структура кости в очагах поражения при КБП напоминает мозаику, где хаотично расположены зоны аномальной, вновь образованной волокнистой костной ткани, очаги пластинчатой кости и участки резорбции. Мозаичность структуры нередко наблюдается на значительном протяжении пораженной кости.
Характерной чертой этого заболевания является локальность поражения скелета:
изменения отмечаются в какой-либо одной кости (монооссальная форма), в нескольких костях (обычно несимметрично) или во многих отделах скелета. Преимущественными локализациями “педжетовских очагов” являются (в нисходящем по частоте порядке): позвоночник (чаще поясничный отдел), череп (почти всегда мозговой), таз и длинные трубчатые кости конечностей (чаще других бедренная, большая берцовая и плечевая). Реже изменения можно обнаружить со стороны костей верхних конечностей, ключиц, лопаток, ребер, лицевого черепа, кистей и стоп, а иногда даже в сесамовидных косточках. В пределах одной кости может быть несколько зон поражения. Типичен их медленный рост (не более нескольких миллиметров в год), но встречаются и случаи более интенсивного прогрессирования. Число очагов поражения, по общему мнению, со временем не увеличивается. Патологический процесс, как правило, не распространяется на суставы. Исключением являются крестцово-подвздошные сочленения, которые могут быть полностью уничтожены пластом новообразованной бесструктурной костной ткани; известны также случаи перехода изменений с тела позвонка на межпозвонковый диск.
Распространенность
При целенаправленном патологоанатомическом и рентгенологическом исследовании КБП выявляется часто, причем у пациентов старше 55–60 лет шанс обнаружить эту патологию явно возрастает. При невыборочном рентгенологическом исследовании скелета у 4603 умерших G. Schmorl установил типичные для КБП изменения в 138 (3%) случаях, а D.H. Collins отметил, что частота деформирующего остита в преклонном возрасте (после 80 лет) достигала 10%. Существует много описаний отдельных случаев КБП в среднем и даже молодом возрасте, но раннее начало заболевания все же считается нетипичным.
Известны географические различия в распространенности заболевания. Заболеваемость КБП наиболее высока в Англии (4,6%), Австралии и Новой Зеландии (3–4%), Франции (2,4%), несколько меньше в Ирландии (0,7–1,7%), Испании и Германии (1,3%) и существенно ниже в Италии, Греции (0,5%) и особенно в Норвегии и Швеции (0,3%). Крайне редко КБП встречается в Центральной Африке (0,01-0,02%) и почти неизвестна в странах Азии.
В Великобритании при анализе большого массива рентгеновских снимков скелета в 1993–1995 гг. отмечено снижение частоты КБП более чем в 2 раза по сравнению с аналогичным исследованием, проведенным в 1974 г.
В нашей стране изучение распространенности КБП не проводилось, однако известно, что в свое время отдельные рентгенологи располагали значительным числом наблюдений (600 случаев и более).
Этиология
В 1974 г. при ультраструктурном исследовании остеокластов, полученных из зон “педжетовских очагов”, в ядрах и цитоплазме были выявлены вирусоподобные включения, сходные с нуклеокапсидом парамиксовирусов, а позже установлено, что в них содержатся антигены белков нуклеокапсида вирусов кори и респираторного синцитиального вируса. В 80-е годы из остеокластов и других клеток костной ткани у больных деформирующим оститом были выделены последовательности мРНК вируса кори. Показано, что транскрипты вируса кори присутствуют не только в остеокластах “педжетовской кости”, но и в стволовых гемопоэтических клетках, в более дифференцированных клетках-предшественниках остеокластов и даже в циркулирующих периферических мононуклеарных клетках. В ряде других исследований были обнаружены признаки наличия вируса собачьей чумы, также относящегося к классу парамиксовирусов, и установлено, что риск развития КБП увеличивается в случае содержания в домашних условиях беспородных собак, особенно если животные не были вакцинированы против вируса собачьей чумы.
Следует отметить, что попытки выявить признаки вирусной инфекции у больных деформирующим оститом удавались не всегда, а вирусные включения, напоминающие те, что были обнаружены при КБП, наблюдаются в клетках костной ткани при гигантоклеточной опухоли, пикнодизостозе, остеопетрозе и первичном оксалозе. Выделить вирус при КБП пока не удалось.
Наследственная предрасположенность
Возможность существования КБП у близких родственников известна давно. С помощью изотопного сканирования скелета показано, что бессимптомные изменения хотя бы у одного из родственников первой степени родства выявляются очень часто
, примерно у 40% обследованных. Семейно-генетические исследования позволили установить, что риск возникновения КБП у родственников первой степени родства увеличен в 7 раз.
Поиски генов предрасположенности сначала ограничивались исследованием системы гистосовместимости. В целом эти попытки не увенчались успехом, хотя существуют сообщения о некотором учащении выявляемости при КБП тех или иных антигенов системы HLA (DQw1, DR1, DR2, Drw6, DPw4). В последние годы внимание было привлечено к одному из локусов (q21–22), расположенных на 18-й хромосоме. Причиной этого было установление связи между данным локусом и очень редкой дисплазией костей – семейным распространенным остеолизом, имеющим черты сходства с КБП. Удалось показать, что ассоциация с этим локусом имеется и при деформирующем остите. Высказано предположение о том, что КБП и семейный распространенный остеолиз могут возникать в случае разных мутаций одного гена или семейства генов. Отсутствие обязательной ассоциации с локусом 18q21–22 указывает, однако, что генетическая предрасположенность к КБП, скорее всего, гетерогенна, и, возможно, существует как минимум еще один локус предрасположенности, который предстоит открыть.
Клиническая картина и диагностика
Заболевание диагностируется в преобладающем большинстве случаев после 40 лет, чаще около 60 лет и очень редко раньше 25 лет, примерно с одинаковой частотой у мужчин и женщин.
Можно выделить два крайних варианта КБП: бессимптомный и клинически ярко выраженный, характеризующийся стойкими жалобами и множественными деформациями костей. Бессимптомный
вариант отмечается примерно в 1/4 всех случаев заболевания и, если выявляется при жизни, то обычно случайно, при анализе рентгеновских снимков, сделанных по другому поводу, или в процессе поиска объяснений повышенного уровня щелочной фосфатазы.
Генерализованный, полиоссальный
вариант патологии, с которым столкнулся Дж. Педжет, встречается редко. У таких больных, жалующихся на боли в костях и крупных суставах постоянного характера, развиваются примечательные деформации скелета: выраженный кифоз с укорочением туловища и О-образное искривление нижних конечностей, приводящие к “обезьяньей” походке, а также увеличение размеров черепа, что у пожилого пациента позволяет заподозрить диагноз КБП с первого взгляда. При генерализованном варианте заболевания можно выявить единственное системное проявление КБП – сердечную недостаточность, обусловленную увеличением сердечного выброса вследствие повышенной васкуляризации измененной костной ткани.
Обычно наблюдается “промежуточный”
вариант КБП, для которого характерны локальные, преимущественно неспецифические жалобы и симптомы, определяющиеся топикой заболевания.
Заболевание позволяют заподозрить жалобы на боли в костях (хотя ночной характер болей нетипичен), болезненность при их пальпации и обнаружение гипертермии тканей над пораженной областью. Двумя другими своеобразными симптомами КБП, отмечающимися при поражении черепа, считаются расширение и набухание вен в области свода и ангиоидные полоски на сетчатке (следствие местной интенсификации костного кровотока). Превалируют жалобы, обусловленные вторичными дегенеративными изменениями со стороны суставов, позвоночника, а также деформациями скелета. По данным R.D. Altman и B. Collins , самой частой жалобой у 290 больных деформирующим оститом была боль в нижней части спины (у 34% пациентов); вторичный остеоартроз тазобедренных суставов выявлен у 30%, коленных суставов – у 11% больных; деформации бедренных и большеберцовых костей обнаружены у 45% пациентов.
При КБП закономерно развиваются неврологические нарушения, особенно при поражении черепа и позвоночника. Перестройка височной кости (а также изменения слуховых косточек) приводит к глухоте, размягчение и деформация основания черепа может сопровождаться его уплощением и базилярной инвагинацией позвоночника, приводящей к компрессии ствола мозга, гидроцефалии и повышению внутричерепного давления. Разрастание костной ткани в области дужек позвонков может вызвать сдавление спинномозговых корешков. Возможно сужение канала позвоночной артерии, сопровождающееся соответствующими ишемическими симптомами. Выпячивание увеличенного в размерах тела позвонка в спинномозговой канал может приводить к миелопатии, а поражение крестца – к развитию синдрома конского хвоста.
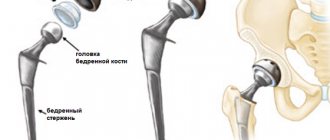
При КБП повышается частота переломов длинных костей, особенно бедренной и большеберцовой кости. Примерно в 1/3 случаев переломов бедренной кости отмечаются подвертельные или шеечные переломы. Типичным переломам могут предшествовать так называемые щелевые, неполные переломы. В большинстве случаев процесс сращения происходит без отклонений от нормы, в обычные сроки. При лечении переломов шейки бедренной кости часто приходится производить протезирование тазобедренного сустава.
Еще одной особенностью КБП является возможность развития сарком (преимущественно остеосарком, но также фибросарком и хондросарком). Саркомы возникают менее чем у 1% больных, развиваясь в старых “педжетовских очагах “, расположенных в костях таза, бедренной и плечевой кости.
При КБП закономерно, в зависимости от степени активности и распространенности процесса, повышаются суточная экскреция оксипролина с мочой и активность щелочной фосфатазы (ЩФ) в крови, отражающие, соответственно, интенсивность резорбции и образования костной ткани. У пациентов с наиболее высокими величинами ЩФ (они могут превышать нормальный уровень в 5–10 раз), как правило, отмечается полиоссальная форма заболевания с поражением черепа. Регулярное наблюдение за этими параметрами позволяет оценивать течение заболевания и эффективность терапии.
Диагноз КБП устанавливается исключительно с помощью рентгенографии
. Характерные изменения в разных отделах скелета описаны исчерпывающим образом, в том числе и в отечественной литературе. Для уточнения степени распространенности КБП ориентировочное значение имеет сцинциграфия скелета.
Лечение
В течение последних 20 лет в терапии КБП произошли радикальные перемены: на смену симптоматическим средствам пришли лекарственные препараты, способные ингибировать резорбцию костной ткани
:
бисфосфонаты, кальцитонины и пликамицин. Эти препараты способны устранять костную боль, гипертермию тканей над пораженными отделами костей и, главное, замедлять избыточную скорость ремоделирования костной ткани, о чем свидетельствуют снижение уровней ЩФ в крови, суточной экскреции гидроксипролина, а также нормализация структуры костной ткани в “педжетовском очаге”.
При КБП лечение требуется не во всех случаях. Показаниями к применению антирезорбционных средств считаются
:
• необходимость облегчения болевых ощущений (обусловленных самим заболеванием, а не его осложнениями)
• полиоссальная форма заболевания
• моно- и олигооссальные формы КБП в случае прогностически неблагоприятной локализации патологического процесса (вблизи крупных суставов, в костях нижних конечностей, в телах позвонков, при обширном поражении черепа с вовлечением височной кости или основания) и при наличии активности заболевания (повышение уровня ЩФ в крови и/или оксипролина в суточной моче)
• необходимость предупреждения переломов
• проведение ортопедических операций (с целью подавления повышенного кровоснабжения соответствующей области кости и устранения повышенного риска послеоперационной кровопотери); данное показание признается не всеми.
Уже возникшие осложнения – деформации костей, глухота, другие компрессионные неврологические осложнения (радикулопатия, миелопатия) – данной терапии обычно не поддаются.
Если размеры костных изменений невелики и не создается непосредственная угроза развития деформаций или неврологических осложнений, а также отсутствуют болевые ощущения и биохимические признаки активности болезни, придерживаются выжидательной тактики.
Эффект антирезорбционной терапии оценивается по динамике болевых ощущений, вызванных непосредственно КБП, но главным образом по степени снижения активности ЩФ. Анальгетическое действие обычно отмечается уже в первые недели, тогда как “биохимический эффект” развивается медленнее, его максимальная выраженность выявляется в течение 3–6 мес.
Бисфосфонаты
В последние годы предпочтение отдается бисфосфонатам, вследствие их избирательного действия на костную ткань, способности длительно в ней сохраняться и стойкости вызываемого эффекта. Нужно отметить, что фармакология бисфосфонатов продолжает активно развиваться. Сейчас известны как минимум 3 поколения этих препаратов (см. табл.). Самые новые из них обладают по сравнению с первым препаратом этой группы, этидронатом, в 1000 раз большей антирезорбционной активностью. Уже при создании бисфосфонатов 2-го поколения (тилудронат, памидронат и алендронат)
удалось расширить “терапевтическое окно” – диапазон между величиной лечебной и токсической дозы – он слишком небольшой у этидроната, что приводило у ряда больных к возникновению нарушений минерализации вновь образующейся костной ткани (остеомаляция).
Эффект бисфосфонатов при КБП зависит от степени выраженности болезни, а также от величины дозы.
Ее подбирают (это особенно касается бисфосфонатов, применяемых внутривенно) индивидуально, ориентируясь на распространенность поражения скелета, прогностическую значимость локализации “педжетовских очагов”, характер рентгенологических изменений (преобладание признаков костной резорбции указывает на необходимость более интенсивной терапии), степень повышения биохимических маркеров активности заболевания.
Все бисфосфонаты, принимаемые внутрь, имеют существенный недостаток – плохую, нестабильную всасываемость (всего около 1–10% от величины принимаемой дозы) и существенное отрицательное влияние на нее ряда пищевых продуктов и даже напитков. Это вынуждает рекомендовать принимать бисфосфонаты за 30 мин до приема пищи (обычно перед завтраком) и не употреблять в ближайшие часы молочные продукты, препараты кальция и железа. Для предотвращения “химического” эзофагита рекомендуют также запивать препарат не менее 100 мл воды и находиться в вертикальном положении около 30 мин. Это особенно важно в случае приема этидроната и алендроната и менее существенно при использовании бисфосфоната 3-го поколения резидроната.
Более успешные результаты в лечении КБП достигаются при внутривенном введении бисфосфонатов. Лечение обычно осуществляют курсами, длительность каждого из них составляет от 3 до 6 мес. В отношении внутривенно применяемых бисфосфонатов существует мнение, что большее значение имеет суммарная доза, а не длительность воздействия. К 6-му месяцу лечения, когда обычно выявляется максимальный “биохимический” эффект избранного режима терапии, подводят предварительный итог. После этого принято делать перерыв в лечении, регулярно (1 раз в месяц) контролируя биохимические показатели скорости ремоделирования костной ткани. Показанием к проведению повторного курса считается возобновление костных болей и/или новое повышение активности ЩФ, превышающее достигнутый ранее уровень на 25%.
У ряда пациентов со временем развивается резистентность к применяемому препарату, которую приходится преодолевать либо повышением дозы, либо назначением другого бисфосфоната. Существуют пациенты, у которых и с помощью новых бисфосфонатов не удается достигнуть нормализации биохимических маркеров активности заболевания, но у многих из них уровень этих показателей все же уменьшается или снижается в большей степени, чем при лечении “старыми” препаратами.
Пока не проведено долгосрочных исследований, доказывающих снижение частоты отдаленных осложнений КБП при длительной терапии бисфосфонатами, не выяснено влияние на динамику рентгенологических изменений и риск развития сарком. Однако надежда на это существует, так как при повторных биопсиях, полученных после успешного лечения, установлена нормализация структуры в отложениях новой костной ткани в пораженных участках скелета.
Основным нежелательным действием бифосфонатов при назначении их внутрь является “раздражение” верхних отделов желудочно-кишечного тракта, в том числе эрозивный эзофагит, а при внутривенном введении – кратковременная лихорадка, сопровождающаяся ознобом, и миалгии (так называемая острофазовая реакция, которую связывают с повышением уровня интерлейкина 6 в крови).
Этидронат
– первый, наиболее испытанный при КБП и, что существенно, самый дешевый препарат. Суточную дозу подбирают, рассчитывая ее на 1 кг массы тела пациента (5 мг/кг). Доза этидроната, составляющая 10 мг/кг в день, может вызывать остеомаляцию (хотя более эффективно тормозит костную резорбцию), а дозы меньше 5 мг/кг неэффективны. Примерно у трети больных деформирующим оститом лечебный эффект не отмечается, что во многом обусловлено плохим всасыванием этидроната. Эффективность этидроната может снижаться во время повторных курсов его применения, не так редко развивается резистентность. По мнению E.S. Siris (1998), этидронат (так же как и кальцитонины) способен нормализовать нарушенный метаболизм костной ткани лишь у небольшого числа больных КБП, преимущественно при нерезко выраженной форме заболевания.
Развитие остеомаляции при лечении этидронатом может проявляться болями и слабостью в проксимальных отделах мышц, артралгиями, иногда артритом, как правило, голеностопных суставов, энтезопатиями в области пяток, повышением уровня ЩФ и (в редких случаях) патологическими переломами костей. Этидронат может иногда вызывать алопецию, панцитопении и реакции гиперчувствительности (ангионевротический отек, сыпь, зуд, синдром Стивенса–Джонсона).
Клодронат
также относится к бифосфонатам 1-го поколения, но его эффективность по сравнению с этидронатом выше. Применяется как внутрь, так и внутривенно. При внутривенном введении обычно не наблюдается острофазовой реакции, свойственной другим бисфосфонатам. Предшествующее лечение бисфосфонатами может ухудшать эффект клодроната.
Тилудронат.
В двойном слепом сравнительном исследовании показано, что тилудронат в суточной дозе 400 мг, применявшийся 3 мес, был достоверно эффективнее этидроната (400 мг в день), использовавшегося в течение 6 мес. Снижение уровня ЩФ как минимум на 50% через 6 мес достигалось у 70% больных, принимавших тилудронат, и только у 25% больных, лечившихся этидронатом. Резистентность отмечалась значительно чаще у больных, принимавших этидронат (соответственно в 51,9 и 19,5% случаев). Эффект лечения тилудронатом в отличие от этидроната не зависел от предшествующего применения бифосфонатов.
Памидронат.
Эффективность памидроната при КБП
превосходит ранее созданные препараты
, особенно при относительно умеренной активности или монооссальной форме заболевания. В этих случаях однократная инфузия препарата (60–90 мг) часто приводит к многолетней ремиссии. Известны наблюдения, в которых памидронат был эффективен у больных, ранее безуспешно лечившихся этидронатом. Нормализации или почти нормального уровня ЩФ удается достичь и при значительном (в 5–10 раз) исходном повышении уровня этого фермента, но для этого требуется применение многократных инфузий препарата с недельными или 2-недельными интервалами.
Памидронат (а также резидронат) в редких случаях может приводить к развитию переднего увеита и склерита. Патогенез этого побочного явления неясен.
Алендронат.
Данные о применении алендроната при КБП ограничены. Терапия в течение 6 мес у пациентов с умеренной или значительной степенью активности заболевания сопровождалась нормализацией уровня ЩФ в 48–63% случаев, при увеличении сроков лечения до 9 мес иногда отмечался дополнительный эффект.
Резидронат
– один из самых новых бисфосфонатов. Применяется внутрь, в отличие от других бисфосфонатов может приниматься после еды (не ранее чем через 2 ч). В одном из исследований положительный эффект (снижение уровня ЩФ как минимум на 50%) отмечен у 90% пациентов с умеренной или значительной степенью активности КБП, он не снижался в случае отмечавшейся ранее резистентности к другим бисфосфонатам. В другом исследовании показано, что достигнутое после применения резидроната снижение уровня ЩФ сохранялось у всех пациентов до 33 мес. Побочные явления со стороны верхних отделов желудочно-кишечного тракта наблюдались у 15% пациентов, но не вынуждали отменять препарат; эрозивный эзофагит был выявлен эндоскопически только у 1 пациента.
Препараты кальцитонина
Хотя эффективность кальцитонинов при КБП сравнима с результатами применения этидроната, их в настоящее время используют только по ограниченным показаниям. Это обусловлено отсутствием у препаратов кальцитонина эффекта последействия (они не накапливаются в костной ткани) и возможностью развития вторичной резистентности (по обзорным данным, частота этого феномена составляет от 5–6 до 40%). Кальцитонинам отдают предпочтение
только в тех случаях,
когда имеются выраженные признаки остеолиза
, угрожающие развитием переломов костей, а также при необходимости получить как можно более быстрый эффект: при сильных болях, появлении первых признаков неврологических расстройств, сердечной недостаточности.
Пликамицин
Пликамицин (прежнее название митрамицин) относится к группе противоопухолевых антибиотиков. Предполагается, что этот препарат оказывает селективное и выраженное действие на остеокласты. Характеризуется мощным и быстро наступающим эффектом
. Анальгетическое действие наступает через несколько дней. После 10-дневного курса лечения уровень ЩФ снижается примерно на 60%, в последующие 1–2 мес “биохимический эффект” нарастает и сохраняется от нескольких месяцев до нескольких лет. Степень выраженности этого воздействия зависит от величины дозы и частоты введения препарата.
По общему мнению, пликамицин должен применяться при КБП как резервный препарат в самых тяжелых, резистентных случаях, или когда необходимо достичь эффект как можно быстрее (например, при недавнем развитии компрессии нервных стволов). Это обусловлено гепатотоксическим и нефротоксическим действием препарата, а также возможностью развития тромбоцитопении.
Пликамицин применяется внутривенно (в виде длительных инфузий) в дозе 10–15–25 мкг/кг в течение не более 10 дней. Известен болюсный способ введения (по 25 мкг/кг каждые 2–3 нед).
Литература:
1. Абрикосов А.И. К патологической анатомии распространенного фиброзного остита (ostitis fibrosa s. deformans generalisata). Русская клиника, 1926;(5): 343–74.
2. Брайцев В.Р. Osteodystrophia fibrosa localisata. Труды XIX съезда хирургов. Л.,1927.
3. Косинская Н С. Фиброзные дистрофии и дисплазии костей. Л., Медицина, 1973.
4. Лагунова И.Г. Клинико-рентгенологическая диагностика дисплазий скелета. М., Медицина, 1989.
5. Рейнберг С.А. Рентгенодиагностика заболеваний костей и суставов. М., Медгиз, 1955; 523–34.
6. Русаков А.В. К вопросу о гисто- и патогенезе ostitis fibrosa Recklingausen’а. В кн.: Второй Всероссийский съезд патологов. М., 1925.
7. Altman R.D., Collins B. Musculoskeletal manifestations of Paget’s disease of bone. Arthr. Rheum. 1980; 23: 1121–7.
8. Barry H.C. Orthopedic aspects of Paget’s disease of bone. Arthr. Rheum. 1980; 23: 1128–30.
9. Basle M.F., Fournier J.C., Rozenblatt S. et al. Measles virus mRNA detected in Paget’s disease bone tissue by in situ hybridization. J. Gen.Virol. 1986; 67: 907–13.
10. Birch M.A., Taylor W., Fraser W.D. et al. Absence of paramyxovirus RNA in cultures of pagetic bone cells and in pagetic bone. J. Bone Miner. Res.1994; 9: 11–6.
11. Brown J.P., Hosking D.J., Ste-Marie L.-G. et al. Residronate, a highly effective, short-term oral treatment for Paget’s disease: a dose-response study. Calcif. Tissue Int. 1999; 64: 93–9.
12. Collins D. H. Paget’s disease of bone. Incidence and subclinical forms. Lancet 1956; 271: 51.
13. Cooper C., Schafheutle K., Dennison E. et al. The epidemiology of Paget’s disease in Britain: Is the prevalence decreasing? J. Bone Mineral. Res. 1999; 14: 192–7.
14. Fraser W. D. Pagetic disease of bone. Current Opinion in Rheumatology. 1997; 9: 347–54.
15. Gordon M.T., Anderson D.C., Sharpe P.T. Canine distemper virus localized in bone cells in patients with Paget’s disease. Bone 1991; 12: 195–201.
16. Haslam S.I., Van Hul W., Morales-Piga A., Balemans W. et al. Paget’s disease of bone: Evidence for a suspectibility locus on chromosome 18q and for genetic heterogenecity. J. Bone Mineral. Res. 1998;13: 911–7.
Схожесть с остеоартритом
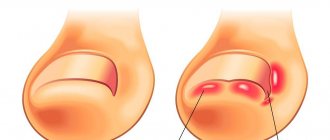
В связи с тем, что по своей симптоматике это заболевание напоминает остеоартрит, их довольно часто путают. Однако на самом деле между двумя этими заболеваниями имеется большая разница. Так, например, основное отличие болезни Педжета от остеоартрита заключается в следующем:
- Наличие сильных болевых ощущений, даже в том случае, если пациент находится в состоянии полного покоя.
- Снижение двигательных способностей у суставов.
- Наличие у суставов высокой жёсткости после нахождения их в состоянии покоя.
- Возникновение на костях утолщений, которые приводят к их хрупкости и последующему полному разрушению.
- У человека, страдающего данным заболеванием, существенно повышается риск получения переломов даже в случае незначительных ушибов.
- В результате протекания в организме патологических процессов существенно возрастают шансы появления защемлений нервных окончаний.
Болезнь Педжета: способы диагностики
Основным способом диагностики данного заболевания является проведение рентгена, а также лабораторного исследования крови. При этом нужно отметить, что именно лабораторное исследование крови позволяет выявить степень и сложность заболевания. В процессе проведения анализа крови выполняется исследование щелочной фосфатазы, благодаря чему удаётся определить уровень прогрессивности заболевания. Также проведение щелочной фосфатазы необходимо всем людям, у кого родственники страдают этим заболеванием.
Способы лечения болезни Педжета
Несмотря на наличие высокой сложности и тяжести, это заболевание поддаётся лечению. Однако чтобы лечение протекало в кратчайшие сроки, необходимо обратиться за квалифицированной помощью при первых болевых ощущениях в области костей. Кроме того, при диагностике болезни Педжета пациенту необходимо минимизировать уровень нагрузки на повреждённые кости. В некоторых особо тяжёлых случаях протекания болезни во избежание разрушения костей и переломов больному на повреждённые участки накладываются шины. Помимо этого, для того чтобы обеспечить сохранность костей, повысить их уровень прочности, а также предотвратить их разрушение, больному прописываются медицинские препараты, имеющие в своём составе кальций. Также в ряде случаев вместе с кальцием больному может быть рекомендован для употребления витамин D. Если лечение проходит при наличии костей, имеющих сильное разрушение, то в этом случае будет необходимо хирургическое вмешательство. В результате такого хирургического вмешательства будет проведена остеотомия или установлен искусственный сустав. Выполняя системные хирургические вмешательства, можно провести восстановление деформированной в результате болезни части тела.
2.Причины
Этиопатогенез болезни Педжета по сей день нуждается в уточнении. Доминируют две основные гипотезы. Согласно первой, специфические раковые клетки Педжета являются продуктам злокачественной мутации клеток самого соска. Вторая гипотеза заключается в том, что клетки с отключенным апоптозом («часовым механизмом» клеточной гибели после определенного числа делений) мигрируют в сосок из протоков, где к тому моменту уже развивается проточная карцинома – таким образом, рак соска представляет собой нечто вроде атипичного метастаза.
Факторы риска, по-видимому, те же, что и для онкозаболеваний вообще, однако в данном случае определенную роль играет также постоянная травматизация соска и ареолы, длительно незаживающие трещинки, а также генетический фактор.
Посетите нашу страницу Онкология
3.Симптомы и диагностика
Первым проявлением болезни Педжета обычно становится покрасневший участок с тенденцией к образованию чешуек. Это место на соске или ареоле может быть практически бессимптомным или немного раздраженным; поскольку высока вероятность спонтанной псевдоремиссии (периода, когда онкопроцесс продолжает развиваться в латентной форме), мало кто из пациентов обращает внимание на измененный очаг и, тем более, обращается на этом этапе к врачу.
В дальнейшем заболевание принимает экземоподобный характер и дает о себе знать ощущениями жжения, болезненно повышенной тактильной чувствительности, зуда, боли. Встречаются гормон-зависимые опухоли Педжета, при которых из соска могут появляться заметные выделения. Иногда экземоподобная сыпь распространяется с соска на окружающие участки. Примерно в половине случаев при маммологическом обследовании обнаруживаются уплотнения в груди.
Предварительный диагноз устанавливают клинически, подтверждают гистологически, – при появлении на соске или ареоле описанных выше экземоподобных очагов обязательно должна назначаться биопсия. Из методов дополнительной инструментальной диагностики наиболее информативными являются маммография, УЗИ и МРТ.
О нашей клинике м. Чистые пруды Страница Мединтерком!
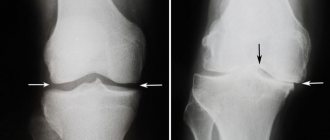
Рентгенологические изменения.
Рентгенологические данные отражают характер основного патологического процесса и фазу заболевания, преобладающую в момент исследования. Чаще всего поражаются кости таза, затем следуют бедренные кости, череп, большие берцовые кости, пояснично-крестцовый и грудной отделы позвоночника, ключицы и ребра (именно в таком порядке). Мелкие кости поражаются реже. Литическая фаза заболевания обнаруживается не всегда, если только не поражаются кости черепа, как при ограниченном остеопорозе, с появлением резко очерченных рентгенопроницаемых участков в лобной, теменных и затылочных костях. В длинных костях участки лизиса обычно выявляются сначала с одного конца, откуда они распространяются к другому в виде растущего V-образного края. Повреждение может сопровождаться разрастанием коркового слоя и другими признаками злокачественного роста. Обычно за областью лизиса следует зона повышенной плотности, отражающая процесс новообразования кости в смешанной фазе заболевания. В целом кость представляется увеличенной и более плотной с неравномерно расширенным шершавым и исчерченным корковым слоем; иногда эти изменения имеют очаговый характер. Часто наблюдаются поперечные рентгенопроницаемые линии (корковые надломы) на выпуклой стороне изогнутых длинных костей, особенно бедренных и больших берцовых. Могут иметь место и полные переломы, причем некоторые из них начинаются в местах корковых надломов. Реконструкция пораженной кости осуществляется обычно по направлению тянущей мышечной силы или силы тяжести, которые определяют характерные боковые изгибы бедренных костей или передний изгиб больших берцовых костей, а также отложение основной массы плотной кости на выпуклой стороне изгибов. На смешанной стадии поражения черепа отмечаются увеличение и утолщение наружных костных пластин с неравномерными участками повышенной плотности, часто в виде пятен. Обычно наблюдается базилярная инвагинация с вовлечением основания черепа. Изменения тазовых костей также отражают сочетание процессов резорбции и новообразования кости; последнему часто сопутствует характерное утолщение тазовой арки. В склеротической фазе заболевания плотность кости может быть равномерно увеличенной; очерченность часто отсутствует. Это обычно наблюдается в лицевых костях, но иногда и в позвонках, которым гомогенность и плотность придают вид «слоновой кости», сходный с таковым при типичной болезни Ходжкина, хотя в последнем случае пораженные позвонки не увеличены.
Что такое болезнь Педжета и почему она развивается
- Чаще встречается в Западной Европе, Северной Америке и Австралии.
- Синонимы: остеит деформирующий, деформирующая остеодистрофия, деформирующий остоз
- Болезнь Педжета (деформирующий остеит) – хроническое заболевание, характеризующееся повышенной резорбцией костной ткани (разрушением), приводящей к ослаблению, деформации и болезненности костей.
- Частота: 3% людей в возрасте после 40 лет
- 90% пациентов с диагнозом деформирующий деформирующий остоз имеют возраст старше 40 лет Мужчины поражаются в 1,5-2,1 раза чаще, чем женщины
- Точная этиология болезни Педжета не установлена;
- обсуждается связь с инфицированием остеокластов парамиксовирусами и вследствие этого ускорение разрушения костной ткани и ремоделирования.
Лечение болезни Педжета за рубежом в Израиле, Германии и других странах
Лечение деформирующей остеодистрофии направлено на подавление активности разрушающих костную ткань клеток, устранение болей, профилактику осложнений и злокачественного перерождения.
Симптоматическая терапия
Направлена на устранение болевого синдрома, ликвидацию местной воспалительной реакции. С этой целью используются НПВС (парацетамол, ибупрофен, баралгин, диклофенак натрия и пр.), гормоны, блокады.
Патогенетическая терапия
Для подавления активности процесса, израильские специалисты назначают лекарства, которые препятствуют распаду костной ткани, способствуют полноценному формированию кости:
- Азотсодержащие бисфософонаты
- Кальцитонин
Хирургическая коррекция
Уровень развития израильской ортопедии позволяет не только выполнять остеотомию в лечебных целях, но и проводить ортопедическую пластику при выраженных деформациях для восстановления функции суставов или в косметических целях. Ежедневно выполняются:
- Остеотомия с целью исправления деформации
- Хирургическая коррекция переломов с фиксацией частей кости пластинами или штифтами
- Эндопротезирование суставов
При незначительных деформациях оперативное вмешательство выполняется эндоскопическим методом, что значительно легче переносится больным и уменьшает длительность восстановления.
При сдавливании структур спинного мозга может потребоваться проведение нейрохирургической операции.
Симптомы деформирующей остеодистрофии
В начальной стадии болезнь Педжета может протекать бессимптомно. Больные жалуются на частые тупые боли в костях, спине, которые усиливаются в покое. По мере прогресса заболевания, отмечается деформация костей. Если в процесс вовлекаются суставы, больные жалуются на скованность движений. Часто возникают патологические переломы при обычной повседневной нагрузке.
Иногда деформированные кости черепа могут сдавливать зрительные, слуховые нервы, лицевой или тройничный нерв, что вызывает специфическую симптоматику.
При поражении позвоночника в процесс вовлекается несколько позвонков, при этом может наблюдаться миелопатия и синдром конского хвоста.
Выраженные деформации позвонков вызывают компрессию сосудов и нервов.