Невралгия затылочного нерва – заболевание, при котором происходит повреждение нервов, которые отходят от верхней части спинного мозга и проходят снизу вверх под кожей головы в затылочной области. В результате возникают боли.
Наш эксперт в этой сфере:
Лащ Наталия Юрьевна
Врач-невролог высшей категории, к.м.н., доцент. Лауреат Премии города Москвы в области медицины.
Позвонить врачу Отзывы о докторе
Почему возникает заболевание?
Возможные причины затылочной невралгии:
- Острая травма задней части шеи и головы.
- Постоянное напряжение мышц шеи. Например, у офисных работников, которые проводят большую часть дня сидя за компьютером.
- Протрузии и грыжи шейных межпозвоночных дисков.
- Остеохондрома (доброкачественная опухоль) позвонков.
- Инфекционные заболевания и воспалительные процессы.
- Сахарный диабет.
- Подагра.
- Рассеянный склероз.
- Редкая причина – метастаз злокачественных опухолей в позвоночник.
Иногда врачу так и не удается до конца разобраться, почему возникло заболевание.
Мы вам перезвоним
Сообщение отправлено!
ожидайте звонка, мы свяжемся с вами в ближайшее время
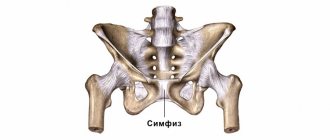
Причины цервикальной радикулопатии
Любое патологическое состояние, которое каким-то образом сжимает или раздражает нервный корешок в шейном отделе позвоночника, может вызвать цервикальную радикулопатию.
Наиболее распространенными причинами являются:
- Грыжа диска. Если внутренний материал межпозвонкового выпячивается и раздражает близлежащий корешок в шейном отделе, то возможно развитие корешкового синдрома (цервикальной радикулопатии). Если у молодого человека (20 или 30 лет) имеется цервикальная радикулопатия, наиболее вероятной причиной является грыжа межпозвоночного диска.
- Цервикальный стеноз позвоночника. Как часть дегенеративного процесса шейного отдела позвоночника, изменения в спинномозговых суставах могут привести к уменьшению пространства в позвоночном канале. Спинальный стеноз является распространенной причиной симптомов корешкового синдрома в шейном отделе позвоночника шейки у людей старше 60 лет.
- Остеохондроз (дегенеративное заболевание дисков). По мере дегенерации дисков в шейном отделе позвоночника, диски становятся более плоскими и жесткими и не поддерживают позвоночник. У некоторых людей этот дегенеративный процесс может привести к воспалению или поражению близлежащего нервного корешка. Цервикальная дегенеративная болезнь дисков является общей причиной радикулопатии у людей старше 50 лет.
- Цервикальная радикулопатия может быть вызвана другими состояниями, при которых возникают условия для компрессионного воздействия на нервные корешки или вызывать повреждение шейных нервных корешков, такими как: опухоли, переломы, инфекции или саркоидоз, синовиальная киста, синовиальный хондроматоз фасеточных суставов, гигантоклеточный артериит корешковых сосудов.
- К факторам, связанным с повышенным риском развития корешкового синдрома шейного отдела позвоночника, относятся: тяжелый ручной труд, требующий подъема более чем 10 кг, курение и длительное вождение или работа с вибрационным оборудованием.
Симптомы невралгии затылочного нерва
Основное проявление заболевания – головные боли. Они возникают в задней и верхней части головы, в основании черепа, в шее. Болевые ощущения могут распространяться на надбровья, позади глаз.
Обычно боль напоминает сильные уколы, удар электрическим током. Она может быть пульсирующей, стреляющей, сопровождаться жжением. У некоторых больных при этом повышается чувствительность к свету, звукам. Боль могут провоцировать движения в шее.
Обычно боль начинается в шее и нижней части головы, распространяется вверх. Чаще всего она возникает с одной стороны, но затылочные нервы могут быть поражены и с двух сторон.
Хронические головные боли возникают при разных заболеваниях. Зачастую люди, которые испытывают симптомы невралгии затылочного нерва (и даже их лечащие врачи) считают, что у них головные боли напряжения или мигрень.
Антиконвульсанты в лечение невропатической боли
Около 20% случаев хронических болей относится к невропатической боли, которая снижает качество жизни больных, трудоспособность, возможность их социальной адаптации и во многих случаях плохо поддается лечению. Это свидетельствует о высокой социальной и медико-экономической значимости проблемы диагностики и лечения невропатической боли. Согласно современной патофизиологической классификации болевых синдромов, основанной на выделении основного механизма формирования боли, невропатическая боль, по определению Международной ассоциации изучения боли (МАИБ – IASP), вызывается первичным повреждением или дисфункцией структур периферической или центральной нервной систем, обеспечивающих проведение болевых сигналов. Таким образом, в основе невропатической боли лежит патологическая активация путей проведения боли, что может быть связано с повреждением или дисфункцией нервной системы на уровне периферических нервов и задних корешков (периферическая невропатическая боль) или спинного и головного мозга (центральная невропатическая боль). Типичными примерами периферической невропатической боли, связанной с поражением периферических нервов, являются болевая диабетическая невропатия и боли при невромах, а при поражении нервных корешков – дискогенная радикулопатия и постгерпетическая невралгия. Центральная невропатическая боль развивается, например, при поражении спинного мозга у больных с травматическим повреждением и сирингомиелией, при поражении головного мозга у больных рассеянным склерозом и после инсульта. Следует отметить, что вопрос о критериях включения конкретных болевых синдромов в разряд «невропатической боли» продолжает обсуждаться. Существует точка зрения, что только случаи с доказанным повреждением или патологией ноцицептивных структур можно относить к невропатической боли.
Исследования, проведенные в различных странах, показали, что невропатическая боль наблюдается у 6-8% населения. Факторами риска развития невропатических болей являются хронические болевые синдромы, а также женский пол, пожилой возраст больных и невысокий уровень социального положения. Невропатическая боль ассоциируется с большей интенсивностью болевого синдрома и частым обращением за медицинской помощью и обусловлена широким спектром повреждений, заболеваний и дисфункций периферической и центральной нервной системы, из которых наиболее известными и широко распространенными являются болевая диабетическая полиневропатия и постгерпетическая невралгия.
Клинические варианты невропатической боли:
1. Поражения периферической нервной системы:
- травматическое поражение нерва (включая ятрогенное повреждение при оперативном вмешательстве);
- ишемические невропатии;
- компрессия нерва;
- полиневропатии (наследственные, дисметаболические, токсические, воспалительные, инфекционные, паранеопластические, при амилоидозе и васкулитах);
- компрессия корешка нерва (радикулопатия);
- постгерпетическая невралгия;
- невралгия тройничного и языкоглоточного нервов;
- невропатии, связанные с онкологическим заболеванием (полиневропатия, вызванная химио- и лучевой терапией, прорастание нерва опухолью);
- комплексный региональный болевой синдром.
2. Поражения центральной нервной системы:
- постинсультный болевой синдром;
- рассеянный склероз;
- травма спинного мозга;
- сирингомиелия;
- объемные образования головного и спинного мозга;
- эпилепсия.
Диабетическая полиневропатия наблюдается примерно у 50% больных сахарным диабетом, в то время как невропатическая боль отмечается у 11-24% больных с полиневропатией, что зависит от длительности заболевания сахарным диабетом и полиневропатией, а также типа диабета. Частота герпетического поражения колеблется от 10 до 20% в популяции, причем у этих больных постгерпетическая невралгия отмечается у 15-22% пациентов. Наиболее часто невропатическая боль отмечается у больных с травматическим поражением спинного мозга и при поражении спинного мозга в случаях сирингомиелии.
Клинические проявления невропатической боли, независимо от уровня поражения и этиологического фактора, характеризуются спонтанными (стимулонезависимыми) и вызванными различными стимулами в повседневной жизни пациента или при его осмотре врачом (стимулозависимыми) болями. Возникновение спонтанных и стимулозависимых болей связано с различными механизмами изменения возбудимости, передачи болевого стимула и торможения возбуждения в ноцицептивной системе.
При периферическом повреждении ноцицептивных волокон механизмы формирования болевого синдрома могут быть связаны с изменением возбудимости болевых рецепторов, что приводит к их активации и при низкопороговых стимулах, чего не наблюдается в условиях нормы. Таким образом, усиливается болевая афферентация, которая в дальнейшем приводит к изменению возбудимости ноцицептивных нейронов ганглия заднего корешка и заднего рога. Основными механизмами, объясняющими повышение возбудимости ноцицептивных волокон периферического нерва в условиях патологии, являются образование новых ионных каналов, являющихся источником эктопической активности периферических нервов с развитием болевых ощущений, и появление возможности передачи возбуждения с одного волокна на другое – феномен эфаптического возбуждения. При механическом повреждении нерва возможно образование невром, являющихся результатом компенсаторной реиннервации (спраутинга), что может быть источником патологической ноцицептивной афферентации.
Задние рога спинного мозга являются центром модуляции нормального болевого сигнала, именно здесь открываются или закрываются «ворота для боли». В связи с этим изменения, происходящие в заднем роге в условиях патологии, во многом являются определяющими для развития невропатической боли. Беспорядочная избыточная афферентация по Aδ- и С-волокнам приводит к повышенной возбудимости ноцицептивных нейронов заднего рога (центральная сенситизация) с развитием феномена взвинчивания, когда в ответ на один болевой стимул нейрон отвечает пачкой импульсов. Повышенная возбудимость ноцицепторов заднего рога связана не только с избыточной постоянной ноцицептивной афферентацией, но и с тем, что длительная деполяризация вызывает активацию глутаматных NMDA-рецепторов (N-methyl-D-aspartate). Активация NMDA-рецепторов приводит к поступлению в нейрон ионов кальция и натрия, что вызывает дальнейшее повышение его возбудимости. Формирование невропатической боли связано не только с глутаматной активностью, но также с уменьшением ГАМК-обусловленных тормозных влияний на ноцицептивные нейроны и снижением содержания активных опиоидных рецепторов в заднем роге.
Ноцицептивные сигналы от нейронов заднего рога поступают в зрительный бугор и далее в соматосенсорную кору, где происходит осознание ощущения боли. Нейроны центральных сенсорных структур также могут менять свою возбудимость с формированием феномена сенситизации. Все центральные структуры проведения и перцепции боли имеют тесные связи с нисходящими тормозными и активирующими путями. Основные тормозные (антиноцицептивные) влияния связаны с нисходящими путями из околоводопроводного серого вещества и ростро-вентральных отделов продолговатого мозга к заднему рогу. Эти нисходящие тормозные влияния реализуются через норадреналиновую и серотониновую нейротрансмиттерные системы.
В клинической практике диагностика невропатического характера боли часто бывает затруднена. Ощущение боли всегда субъективно, его нельзя точно измерить и не существует абсолютных критериев, позволяющих выделить невропатическую боль. Судить о патофизиологических механизмах, лежащих в основе болевого синдрома, можно только ориентировочно, основываясь на характеристиках болевых ощущений, данных неврологического осмотра и результатах нейрофизиологического исследования. Причем выявление клинических признаков и изменений электрофизиологических показателей, показывающих патологическое изменение состояния ноцицептивной системы, достоверно не доказывает наличие невропатической боли. Невропатическая боль может возникать сразу после повреждения ноцицептивной системы, например, при острой невропатии тонких волокон при сахарном диабете, а может развиваться спустя годы и даже десятилетия после повреждения, например при постинсультной боли.
Диагностировать невропатический характер боли можно в случае подтверждения нарушения функции ноцицептивной системы при наличии: 1) спонтанных сенсорных симптомов; 2) результатов клинического осмотра с выявлением симптомов поражения нервной системы: позитивной невропатической симптоматики (стимулозависимой боли) и негативной невропатической симптоматики (неврологического дефицита); 3) данных нейрофизиологических исследований (ЭМГ, количественного сенсорного тестирования, вызванных соматосенсорных потенциалов). При этом выбор методов исследования определяется результатами неврологического осмотра.
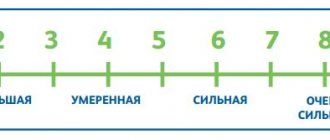
Одним из наиболее важных позитивных симптомов при невропатической боли является аллодиния, выявление которой при обследовании служит веским доводом в пользу невропатического характера боли. Аллодиния – это болевое ощущение, возникающее при нанесении стимула неболевой модальности. Больные с аллодинией часто жалуются на возникновение боли, связанной с прикосновением одежды, постельного белья к области локализации аллодинии. Гипералгезия – повышенная болевая реакция на нормальный болевой стимул, представляет собой количественное изменение болевого сигнала. Она, как и аллодиния, типична для невропатической боли, особенно в случаях хронических болевых синдромов. Особым вариантом гипералгезии является гиперпатия, при которой, после нанесения болевого стимула, отмечается усиленное восприятие боли, при этом боль продолжается и даже может усилиться в течение нескольких секунд после прекращения болевой стимуляции.
Неврологическая симптоматика позволяет определить наличие, степень и локализацию поражения нервной системы. Для диагностики феномена невропатической боли врач в первую очередь должен оценить состояние сенсорной системы. В зависимости от периферической или центральной локализации патологического процесса, большое значение для диагностики имеет исследование общего неврологического статуса, включая двигательную и вегетативную системы, в этом случае к негативной симптоматике будут относиться, например, снижение рефлексов, силы мышц, наличие атрофии мышц, сухость и изменение окраски кожи. При выявлении поражения сенсорной системы для диагностики невропатической боли ориентируются на состояние чувствительности, связанной с активацией тонких слабомиелинизированных Aδ-волокон (реакция на холодовые стимулы и тупой укол) и тонких немиелинизированных С-волокон (реакция на болевые и тепловые стимулы). При этом следует помнить, что невропатическая боль обычно возникает в зоне снижения или отсутствия чувствительности, т.е. зона болей и нарушений чувствительности в этих случаях совпадает.
Лечение невропатической боли базируется на современных представлениях о патофизиологических механизмах ее развития. Используются фармакологические воздействия, направленные на уменьшение периферической афферентации, поддерживающей изменение возбудимости ноцицептивных структур спинного и головного мозга, препараты, уменьшающие возбудимость ноцицептивных нейронов, и препараты, усиливающие супраспинальные нисходящие тормозные антиноцицептивные влияния. В тяжелых случаях используется введение фармакологических препаратов близко к центральным рецепторам (интрадурально). Возможно применение электростимуляции периферических нервов, в первую очередь проприоцептивных волокон, для усиления тормозных влияний на возбудимость ноцицептивных нейронов спинного мозга и иглорефлексотерапии. Хирургическое лечение в случаях, резистентных к фармакотерапии, может включать использование вживляемых в головной или спинной мозг электродов, освобождение нерва из спаек или его декомпрессию, химическое разрушение или перерезку нерва. В таблице представлены европейские рекомендации по лечению невропатической боли, основанные на анализе базы данных контролируемых исследований, начиная с 1966 г.
Введение локальных анестетиков приводит к уменьшению невропатической боли, особенно в тех случаях, когда ее развитие обусловлено в первую очередь патологическими изменениями периферических нервов. Вместе с тем препараты, за счет всасывания и системного эффекта, могут воздействовать на вышерасположенные ноцицептивные структуры. Наиболее широко из всех местных анестетиков применяется лидокаин, обладающий ингибирующим действием на натриевые каналы. При накожном применении 5% лидокаина с использованием пластыря его всасывание минимально, действие на другие структуры не проявляется и, соответственно, практически отсутствуют возможные системные побочные эффекты. Таким образом, его применение оправданно при невропатической боли, сопровождающейся аллодинией. Длительность уменьшения болей и аллодинии при накожном применении лидокаина составляет от нескольких часов до нескольких дней.
Клинический эффект при внутривенном введении лидокаина в виде 5% раствора подтвержден при многих вариантах невропатической боли, например, при болевой диабетической полиневропатии. Интересно, что длительность периода уменьшения или исчезновения боли составляет в этом случае от одной до нескольких недель, что значительно превышает время выведения препарата. Вместе с тем к значительным неудобствам использования внутривенного введения лидокаина относится необходимость проведения лечения в условиях реанимационного отделения под постоянным мониторингом ЭКГ, т.к. возможны побочные эффекты со стороны сердечной деятельности.
Капсаицин – крем, в состав которого входит красный перец в концентрации 0,025 или 0,075%, обладает способностью активизировать синтез и выделение специфического альгогена – субстанции Р как в ноцицепторах кожи, так и при перенесении действующего вещества аксональным током, в нейронах дорзального ганглия и даже заднего рога. Препарат наносится на кожу в месте локализации болей, что сначала приводит к увеличению интенсивности болей, но затем боли уменьшаются из-за истощения субстанции Р. Препарат рекомендуется применять в случае периферического генеза невропатической боли и небольшой зоны ее локализации. Основными недостатками лечения капсаицином является часто возникающий очень интенсивный болевой синдром с аллодинией, который больные не в состоянии перенести.
В случаях наличия симпатически поддерживаемых болей возможно трансдермальное применение клонидина, препарата, обладающего эффектом агониста α2-адренорецепторов, причем возможно как местное, так и системное действие препарата на вышележащие симпатические образования.
Несомненный эффект на периферические механизмы невропатической боли оказывают антиконвульсанты и трициклические антидепрессанты, но основой их противоболевого действия при невропатическом характере боли являются все же другие механизмы.
Нестероидные противовоспалительные препараты, уменьшающие периферические воспалительные процессы, не используются для лечения невропатической боли в связи с их неэффективностью. Вместе с тем их использование оправдано при комбинации ноцицептивных и невропатических болей, например при болях в спине, или при КРБС, где в развитии болевого синдрома большую роль играет периферическое воспаление.
Кетамин – основной препарат группы блокаторов NMDA-рецепторов был разработан как диссоциативный анестетик и в дальнейшем стал применяться в небольших дозах для лечения невропатических болей различной этиологии, в т.ч. при онкологических болях. Основным механизмом действия кетамина является блокирование ионных каналов NMDA-рецепторов в задних рогах спинного мозга. Таким образом, кетамин уменьшает возбудимость ноцицептивных нейронов, в частности уменьшая феномен взвинчивания. Его можно вводить парентерально, внутривенно или перорально. В клинических исследованиях показана эффективность кетамина при постгерпетической невралгии, послеоперационных болях, а также при центральных невропатических болях (постинсультные, боли после травмы спинного мозга). В нескольких исследованиях было показано, что при онкологических болях кетамин усиливает действие опиоидов (морфина). Основным недостатком препарата являются выраженные побочные эффекты его применения, что, возможно, связано с дополнительным действием кетамина на опиоидные и мускариновые рецепторы, натриевые и калиевые каналы и ингибирование обратного захвата серотонина и допамина. Более 40% больных, получавших кетамин, отмечали психотомиметические эффекты, вплоть до галлюцинаций.
В настоящее время при лечении невропатической боли различной этиологии наиболее широко используются антидепрессанты. Трициклические антидепрессанты (ТЦА), которые начали использоваться с 50-х гг. прошлого века, в первую очередь амитриптилин, высокоэффективны при невропатической боли.
При диабетической болевой полиневропатии назначение ТЦА уменьшает боль или приводит к ее исчезновению более чем в 80% случаев. Основным механизмом их действия является блокирование обратного захвата норадреналина и серотонина в пресинаптическую терминаль за счет действия на натриевые и кальциевые каналы, что приводит к повышению активности центральных антиноцицептивных структур, зависящих от норадренергической и серотонинергической нейромедиации. Селективные блокаторы обратного захвата серотонина (пароксетин, флуоксетин) не оказывают действия на постсинаптические рецепторы, в связи с чем имеют меньше побочных эффектов, но они существенно уступает ТЦА в способности уменьшать невропатические боли. Амитриптилин изучен в многочисленных контролируемых исследованиях при постгерпетической невралгии и болевой диабетической полиневропатии, наиболее распространенных формах невропатической боли, и его эффективность не нуждается в дальнейших исследованиях. Стандартная доза амитриптилина, с которой начинают лечение, составляет 25 мг, затем она может быть увеличена до 75-150 мг. ТЦА ограничены в использовании при невропатической боли, особенно у пожилых пациентов, из-за наступления многочисленных и иногда тяжелых побочных эффектов: ортостатической гипотонии, задержки мочи, запоров, тахикардии, «сухого синдрома». Противопоказанием для назначения ТЦА являются глаукома и аденома предстательной железы. Кроме того, доказано, что длительное применение ТЦА в 2,2 раза увеличивает риск развития инфаркта миокарда.
К дополнительным недостаткам амитриптилина можно отнести нелинейность фармакокинетики, т.е. при приеме небольших доз концентрация вещества в плазме может быть больше, чем при приеме больших доз. В связи с этим возникла необходимость создания новых высокоэффективных препаратов, не имеющих столь выраженных побочных эффектов. В последнее время активно разрабатываются т.н. сбалансированные ингибиторы обратного захвата норадреналина и серотонина, имеющие меньше побочных эффектов. Препарат этой группы дулоксетин используется в США для лечения невропатической боли при диабетической полиневропатии и других форм хронической боли. Вместе с тем надо отметить, что дулоксетин все же уступает амитриптилину в эффективности уменьшения невропатической боли.
Антиконвульсанты стали применять для лечения болевых синдромов в 40-х гг. прошлого века, когда была показана эффективность фенитоина (дифенина) при лечении тригеминальной невралгии. В 1962 г. для лечения невралгии тройничного нерва впервые был использован антиконвульсант карбамазепин (финлепсин), препарат, близкий по своей структуре к ТЦА, который до настоящего времени остается препаратом первой линии в лечении этого варианта невропатической боли. Основным механизмом действия фенитоина и карбамазепина является блокирование вольтаж-зависимых натриевых каналов, т.е. они обладают периферическим механизмом действия. Основным направлением развития препаратов первого поколения является создание препаратов, близких по структуре, обладающих аналогичной эффективностью, но меньшими побочными эффектами, в т.ч. гепато- и нефротоксичностью. Типичным примером такого нового препарата является окскарбазепин (трилептал), близкий по структуре к карбамазепину.
Наиболее эффективным препаратом для лечения невропатической боли различной этиологии зарекомендовал себя препарат нового поколения антиконвульсантов – габапентин (тебантин). Антиконвульсанты последнего поколения обладают более широким спектром действия, что обеспечивает их эффективность при невропатической боли.
Габапентин близок по своей структуре к гамма-аминомасляной кислоте (ГАМК), однако он не взаимодействует с рецепторами к ГАМК. Тебантин уменьшает сенситизацию центральных ноцицепторов, в основном за счет связывания с α2δ субъединицей потенциалзависимых кальциевых каналов мембраны ноцицептивных нейронов, что приводит к блокированию каналов и уменьшению возбудимости нейронов. Кроме того, габапентин сохраняет блокирующее действие на натриевые каналы и дополнительно оказывает стимулирующее влияние на синтез и выделение ГАМК. Побочных эффектов у препарата немного. При изучении 2216 пациентов сонливость наблюдалась у 15,2%, головокружение – у 10,9% и атаксия – у 6,0% больных, однако тяжесть побочных эффектов была незначительной, а их длительность не превышала 2-3 нед. даже при продолжении приема препарата. Препарат не метаболизируется в печени и выводится в виде целой молекулы через почки, но должен применяться с осторожностью у больных с нарушением функции почек.
Эффективность тебантила показана в двойных слепых плацебо-контролируемых исследованиях в случаях невропатической боли у больных диабетической полиневропатией, постгерпетической невралгией, тригеминальной невралгией, рассеянным склерозом. В 2002 г. в рамках контролируемого исследования было проведено изучение эффективности габапентина при постампутационной фантомной боли у 19 больных и показано, что прием препарата в дозе 2400 мг в течение 6 нед. статистически достоверно уменьшал выраженность болевого синдрома по сравнению с эффектом плацебо. В этих исследованиях габапентин назначался мужчинам и женщинам в возрасте от 20 до 90 лет с широким спектром синдромов невропатической боли, обусловленных различными заболеваниями и поражениями периферической и центральной нервной системы, и показал свою эффективность и хорошую переносимость при минимальных побочных эффектах. На основании этих исследований была создана система титрования дозы препарата, позволяющая уменьшить частоту и выраженность побочных эффектов, и определены максимально возможные дозы его назначения. Габапентин назначают начиная с дозы 300 мг в день (вечером, на ночь), затем дозу увеличивают до 600 мг (300 мг днем и 300 мг вечером) и, наконец, дозу увеличивают до 900 мг (300 мг 3 раза в день). На фоне приема препарата в дозе 900 мг в день анализируют динамику болевого синдрома, а при отсутствии эффекта ее повышают до 1800 мг/сут. (увеличивая по 300 мг/сут.). Максимальные дозы габапентина в некоторых исследованиях, при которых была показана высокая эффективность препарата при лечении невропатической боли, достигали 2700 или 3600 мг. При этом большинство исследователей отмечали уменьшение болевого синдрома при различных вариантах невропатической боли уже на первой неделе лечения габапентином. Препарат имеет высокую (более 60%) биодоступность, максимальная концентрация в плазме достигается через 2-3 ч после приема препарата. Прием пиши не влияет на фармакодинамику габапентина.
Появление тебантина позволило значительно увеличить возможности врачей при лечении синдрома невропатической боли, т.к. при назначении препарата боли купируются у большинства больных, эффект наступает быстро, отсутствуют значительные побочные явления, и при необходимости его можно принимать в течение длительного периода. В отношении других антиконвульсантов нового поколения – топирамата, ламотриджина – необходимо уточнить, что хотя в некоторых контролируемых исследованиях была показана их эффективность при лечении невропатической боли, однако они не зарегистрированы в России как ЛС для лечения болевого синдрома.
Из новых антиконвульсантов, эффективность которых при лечении невропатической боли была исследована в последние годы, обращает на себя внимание прегабалин (лирика). Было проведено 10 двойных слепых, плацебо-контролируемых исследований, в которых приняли участие почти 10000 больных, в основном с болевой диабетической полиневропатией и постгерпетической невралгией. В результате было показано, что препарат, близкий по структуре к ГАМК, высокоэффективен при невропатической боли. Важным является также меньшая частота приема (2 приема в день) и меньшая доза препарата по сравнению с габапентином (от 75 до 600 мг), что приводит к снижению выраженности побочных эффектов. В остальном препарат имеет те же достоинства, что и габапентин, т.е. быстрое наступление эффекта (после первых 3 приемов), малое число побочных эффектов, возможность длительного применения, отсутствие взаимодействия с другими препаратами и независимость от приема пищи.
Источник: журнал «Медицинский совет» №3-4 2008.
Диагностика
Во время приема невролог расспрашивает пациента о том, когда его начала беспокоить боль, где она возникает, что её провоцирует, просит описать ощущения, которые возникают во время приступа. Затем проводится неврологический осмотр. Врач просит пациента повернуть, наклонить голову, нажимает на определенные точки на шее, пытаясь вызвать боль.
Если после осмотра остаются сомнения в диагнозе, обнаруживаются необычные симптомы, невролог назначает обследование. Оно может включать анализы крови, МРТ и другие методы диагностики.
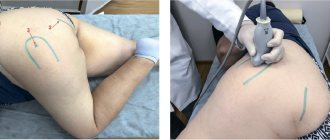
Хирургическое лечение
Если консервативные методы лечения не обеспечивают снижение боли или если такие неврологические симптомы, как онемение и слабость рук, продолжают прогрессировать, то тогда можно рассмотреть вопрос о хирургическом вмешательстве.
Наиболее часто в лечении цервикальной радикулопатии применяются следующие оперативные методики:
Передняя цервикальная дискэтомия и фиксация
. Эта операция проводится через небольшой разрез в передней части шеи для удаления грыжи диска , а затем проводится фиксация этого двигательного сегмента шейного отдела позвоночника, что позволяет обеспечить стабильность позвоночника . Это наиболее распространенная операция для декомпрессии корешка .
Замена межпозвонкового диска на искусственный диск
. Эта методика позволяет заменить фиксацию позвонков. Потенциальным преимуществом этой методики является то, что она направлена ??на поддержание мобильности на этом уровне шейного отдела позвоночника, а не на сращивание двух позвонков.
Хирургическое лечение корешкового синдрома в шейном отделе позвоночника позволяет эффективно снизить симптоматику и восстановить проводимость по нервным волокнам. По данным статистики коэффициент эффективности составляет от 80% до 90% . Как и при любой операции, есть некоторые риски, но чаще всего польза оперативного лечения перевешивает риски.
Лечение невралгии затылочного нерва
Многим пациентам помогают простые мероприятия: отдых, тепло на шею, обезболивающие препараты (ибупрофен, напроксен). Полезны курсы массажа: они помогают размять напряженные шейные мышцы.
Если это не помогает, врач может назначить другие лекарства: миорелаксанты (препараты, расслабляющие напряженные мышцы), некоторые противосудорожные препараты, антидепрессанты. Иногда требуются блокады затылочного нерва – инъекции препаратов, которые прерывают передачу болевых нервных импульсов.
В редких случаях бывает необходимо хирургическое лечение. Если боль обусловлена тем, что нерв пережат кровеносным сосудом, проводят микроваскулярную декомпрессию. Иногда для того чтобы заблокировать болевые импульсы, применяют специальное устройство – нейростимулятор.
В целом невралгия затылочного нерва не представляет опасности, у большинства пациентов с ней удается справиться. Но для того чтобы назначить подходящее лечение, нужно установить правильный диагноз. Запишитесь на консультацию в наш неврологический центр по телефону.
Материал подготовлен врачом-неврологом международной клиники Медика24, кандидатом медицинских наук Лащ Натальей Юрьевной.