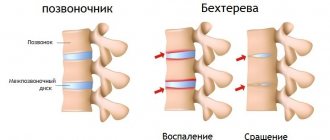
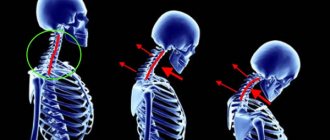
Спондилит
— это заболевание позвоночника воспалительной этиологии. В первую очередь оно затрагивает тело позвонка, разрушая его и снижая высоту. В тяжелых случаях возможно образование горба, окостенение реберных суставов и смещение внутренних органов. Но это — не единственная опасность
спондилита
. В долгосрочной перспективе он приводит к осложнениям на сердце, печень, почки и нервную систему. Болезни подвержен и стар, и млад. Нередко патология наблюдается у подростков в возрасте от 15 лет. К счастью,
спондилит
распространен не слишком широко — от него страдает не более 0,6% людей.
Но если болезнь уже есть — можно ли избежать деформации позвоночника и ухудшения состояния? Разберемся в природе спондилита
.
Самое главное, спондилоартрит НЕ РАВНО болезни Бехтерева!
Спондилоартриты – это группа воспалительных заболеваний,
для которых характерно поражение позвоночника и/или суставов. Они объединены по механизмам их развития и похожим клиническим проявлениям. Делится эта группы на две подгруппы – аксиальный и периферический спондилоартрит. Разница в том, что при первом поражается только крестцово-подвздошные суставы и/или позвоночник, а при втором – может поражать также суставы верхних и нижних конечностей.
Кроме того, подгруппа аксиального спондилоартрита делится на анкилозирующий спондилит (это и есть болезнь Бехтерева) и не рентгенологический аксиальный спондилоартрит. Разница между ними – наличие /отсутствие поражения крестцово-подвздошных суставов на рентгенографии. Рентгенологические изменения происходят очень медленно, иногда для появления признаков «сращения» должно пройти 7-8 лет, поэтому до сих пор идут горячие споры о том, являются ли эти две формы стадиями одного процесса, или разными заболеваниями из одной группы.
Для лучшего понимания ниже будем говорить о группе аксиального спондилоартрита (АС).
Причины заболевания
Точная причина заболевания неизвестна. Спондилоартриты в отличие от ревматоидного артрита, относятся в большей степени не к аутоиммунным, а к гипервоспалительным заболеваниям. Они редко вызывают системные воспалительные реакции, а поражают определённые органы и ткани – суставы, кожу, кишечник, глаза.
Один из ключевых факторов развития АС — наличие антигена HLA-B27. Несмотря на 40-летнюю историю его изучения, роль антигена остаётся не до конца ясной. По одной теории, запускающим воспаление процессом могут явиться микробы, у которых часть генов настолько схожа с генами пациента – носителя HLA B-27, что организм человека «путает» их и начинает работать против своих.
Однако, когда заболевание уже проявило себя, не ищите эти таинственные микробы – скорее всего организм уже давно избавился от них, а воспаление будет продолжаться.
Другая теория основана на возможности аномального строения HLA-B27, который сам активирует развёрнутый иммунный ответ. Любой фактор (травма, инфекция) могут оказаться фактором – «триггером» — для активации «неправильной работы» этого антигена. Как бы то ни было, но у 95% пациентов с АС может быть обнаружен этот пресловутый HLA B-27.
А далее разворачивается каскад реакций: последовательно активируются Т-лимфоциты – клетки иммунной системы и увеличивается образование белковых молекул, «медиаторов воспаления» (цитокинов). Они и приводят к изменениям, характерным для всей группы спондилоартритов и АС в частности. В отличие от ревматоидного артрита, где главный механизм разрушения сустава — образование эрозий – «изъеденность» — хряща и разрушение кости, при АС процесс воспаления заканчивается костной пролиферацией – образованием новой «избыточной» костной ткани. В результате – анкилоз (сращение) суставов и оссификация (окостенение) связок позвоночника с исходом в неподвижность.
Мужчины страдают чаще, дебют приходится на возраст младше 45 лет. Возможно развитие АС в детском возрасте с переходом во взрослое состояние, который обычно протекает достаточно тяжело.
Симптомы
Наиболее типичный симптом заболевания — боль в нижней части спины (в области крестца и по бокам от него) воспалительного характера, т.е. возникающая ранним утром или после неподвижного положения.
Боль может быть неявной, по типу дискомфорта или ощущения тяжести, часто сопровождается утренней скованностью (тугоподвижностью), может отдавать в ягодицы, но очень часто боль вынуждает просыпаться пациента в 4-5 часов утра.
Симптомы обычно прогрессируют очень медленно (годами и даже – десятилетиями), и пациенты часто наблюдаются с диагнозом «остеохондроз». Насторожить врача или пациента должен непреходящий характер болей, молодой возраст (до 45 лет) и отсутствие улучшения после отдыха.
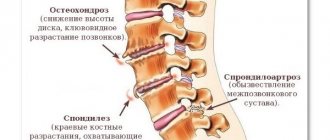
Следующим после поражения крестцово-подвздошных суставов, АС затрагивает позвонки. Обычно процесс идет «снизу вверх», но реже может быть и иной порядок. При этом сначала наблюдаются воспалительные изменения в телах позвонков, а затем развиваются межпозвонковые «костные мостики» — синдесмофиты. Вместе с кальцифицикацией связок позвоночника это создает на рентгенограмме характерную картину «бамбуковой палки», а при внешнем осмотре врач наблюдает «позу просителя»: позвоночные изгибы сглажены, голова пациента наклонена вперёд, боковые движения в позвоночнике возможны только при повороте всего туловища. Такого пациента врачу-ревматологу видно «издалека», но, к сожалению, в этой стадии возможности терапии крайне ограничены. Поэтому современные диагностические критерии направлены на возможно более раннюю диагностику АС.
«Классическим» инструментальным исследованием является рентгенография таза, на которой выявляется двусторонний сакроилиит – воспаление крестцово-подвздошных суставов. Но симптомы на рентгенографии появляются не ранее, чем через 4-5 лет, поэтому для ранней диагностики, как залоге эффективного лечения, применяется метод МРТ. В случае, если сакроилииит выявляется на МРТ, а на рентгенографии его нет, он называется нерентгенологический. Основной признак сакроилиита – отек костного мозга в зоне, прилежащей к крестцово-подвздошным суставам.
Лабораторный критерий АС — антиген HLA-B27. Помните, что в отличие от МРТ, это не признак заболевания, а маркёр ПРЕДРАСПОЛОЖЕННОСТИ к нему. Наличие HLA B-27 – это не приговор! В целом в популяции HLA B-27 может быть обнаружен у 8-15% населения, а какие-либо проявления, ассоциированные с данным геном, будут только у каждого двадцатого его носителя.
Другие традиционные воспалительные изменения – повышение СОЭ и С-реактивного белка можно наблюдать только у 30% пациентов с АС, поэтому нормальные показатели этих анализов не исключают и не подтверждают наличие заболевания.
К сожалению, наличие HLA B-27 может ассоциироваться не только с АС, но и с поражением других органов. Классической памяткой для ревматолога является «опорно-двигательный аппарат – кожа – глаза — кишечник». И как у кого из пациентов сложится эта мозаика – неизвестно. А поскольку этот ген наследуемый, то у одного члена семьи возможны кожные проявления, а у другого, например, сочетание — АС и поражения кишечника.
Помимо поражения позвоночника патология опорно-двигательного аппарата, связанная с HLA B-27, может проявляться так называемыми «энтезитами» — воспалениями в области прикрепления сухожилия в кости. Любимой локализацией в этом случае является боль в области пятки (сбоку или со стороны стопы) в месте прикрепления пяточной связки или Ахиллова сухожилия.
Еще одним проявлением со стороны опорно-двигательного аппарата может быть дактилит (в переводе-«воспаление пальца»), хотя воспаляются только сухожилия, но не суставы. При этом палец приобретает вид сосиски. Непосредственно воспаление суставов – артриты: чаще асимметричные с большим вовлечением нижних конечностей, также являются тем симптомом, который сориентирует врача на поиск HLA B-27. Кстати, если «мозаика» у конкретного пациента сложится так, что будут воспалены только периферические суставы без вовлечения позвоночника, то заболевание приобретет название «периферический спондилоартрит».
Иногда проявлением заболевания становится передний увеит – воспаление передней камеры глаза. Симптомы: выраженная боль и покраснение глаза, слезотечение, нарушение зрения (помутнение), светобоязнь. Сочетанием с АС может быть поражение кишечника, сопровождающееся болями в животе, послабленным или жидким стулом, в котором могут быть примеси слизи или крови. При колоноскопии может быть диагностирована болезнь Крона или язвенный колит. Еще одним органом-мишенью для HLA B-27 может стать кожа, поэтому врач непременно спросит про наличие псориаза.
Таким образом, сочетание жалоб и анамнеза пациента, проведение специфических тестов, анализ инструментальных и лабораторных данных позволяет врачу поставить диагноз АС и начать терапию.
Аутоиммунная болезнь внутреннего уха и аксиальный вариант анкилозирующего спондилита
Введение
Нарушения слуха, по данным многочисленных клинико-эпидемиологических исследований, встречаются у 6–8% населения земного шара. При этом 68–80% нарушений слуха составляет нейросенсорная тугоухость (НСТ) [1]. В 1979 г. B. McCabe на основании клинико-диагностического обследования и попыток лечения 18 пациентов очертил новый клинический симптомокомплекс, названный им аутоиммунной сенсоневральной потерей слуха. Одной из ключевых особенностей болезни являлся быстрый положительный эффект иммуносупрессивной терапии (дексаметазон, циклофосфамид) [2]. К сожалению, концепция аутоиммунности на протяжении долгого времени не была принята научным сообществом. Тем не менее исследования последних десятилетий показали, что наряду с бактериальной, вирусной, сосудистой и другими причинами возникновения НСТ выявляется большое количество случаев идиопатической формы заболевания. Данный вид патологии, по мнению многих исследователей, может быть отнесен к аутоиммунной болезни внутреннего уха (АБВУ) [3]. В настоящее время АБВУ привлекает все большее внимание практических врачей, т. к. это заболевание является одной из немногих потенциально излечимых форм НСТ. К АБВУ принято относить часть идиопатической НСТ, болезни Меньера, поражения лабиринта при отосклерозе, болезни Лайма, вирусных гепатитах, сифилисе, поражение контралатерального, ранее здорового уха после односторонних латеробазальных переломов, всевозможных травм, в т. ч. оперативных, деструктивного лабиринтита [4–6]. В настоящее время АБВУ разделяют на 2 основных типа: 1-й тип – ассоциированный с системным заболеванием соединительной ткани (СЗСТ), 2-й тип – локализованная форма болезни, наблюдаемая в т. ч. и при содружественном лабиринтите [7, 8]. Сочетание АБВУ с СЗСТ встречается не менее чем в 30% случаев. Описаны сочетания АБВУ с ревматоидным артритом, системной красной волчанкой (СКВ), анкилозирующим спондилитом, болезнью Бехчета, ANCA-ассоциированными васкулитами (гранулематоз с полиангиитом), рецидивирующим полихондритом, узелковым периартериитом, воспалительными заболеваниями кишечника (болезнь Крона) и др. [7, 9–14]. Ряд исследователей обращают внимание на то, что вероятность возникновения АБВУ увеличивается при длительном течении СЗСТ. Например, при СКВ и гранулематозе с полиангиитом развитие НСТ в дебюте заболевания встречается у 20% пациентов, а при длительном течении те или иные проявления НСТ выявляются уже у каждого второго больного [14, 15].
Этиология и патогенез
Этиология АБВУ остается невыясненной, однако в настоящее время по аналогии с другими аутоиммунными заболеваниями выдвинуто несколько теорий их развития. Случайное повреждение.
Повреждение внутреннего уха вызывает высвобождение цитокинов, которые отсроченно провоцируют развитие дополнительного иммунного ответа. Данная теория может объяснить цикл обострение/ремиссия у таких заболеваний, как, например, болезнь Меньера.
Механизм молекулярной мимикрии.
Антитела или мигрирующие Т-клетки вызывают внезапное повреждение внутреннего уха, т. к. антигены уха похожи на потенциально патогенные для организма субстанции, вирусы или бактерии. В настоящее время данная теория наиболее популярна [16].
Нарушение толерантности.
Ухо, как и глаз, возможно, является только частично иммунопривилегированным локусом. Организм может не знать обо всех антигенах внутреннего уха, и при их высвобождении (после оперативного вмешательства или перенесенной инфекции) иммунная система реагирует на них, как на чужеродный антиген [17].
Генетические факторы.
Генетические аспекты формирования иммунного ответа могут быть ассоциированы с повышенной восприимчивостью к обычным заболеваниям органа слуха, такими как болезнь Меньера. Систематический обзор литературы с 1961 по 2011 г. выявил, что около 1/3 всех случаев заболевания болезнью Меньера клинически связаны с иммунологическими причинами и отличаются позитивным ответом на терапию ГКС. Существуют исследования, в которых показано, что у пациентов с болезнью Меньера с аллельным вариантом MICA*4 главного комплекса гистосовместимости (ГКГС) медленнее прогрессирует потеря слуха, чем у больных с другими типами ГКГС. В подтвержденных случаях аутоиммунной внезапной потери слуха кохлин, наиболее значительный белок тканей внутреннего уха, может вызывать Т-клеточный ответ и рассматривается как антиген, ответственный за воспаление и повреждение внутреннего уха [18]. Помимо этого, к косвенным доказательствам относятся семейный анамнез аутоиммунных болезней, сочетание с другими аутоиммунными заболеваниями (СКВ, болезнь Бехчета, гранулематоз с полиангиитом, рецидивирующий полихондрит), частое выявление определенных аллелей главного комплекса гистосовмеcтимости (DR4-, cw7+, cw4+, B35), повышенные титры IgG антител и клинический ответ на иммуносупрессивную терапию. У пациентов с АБВУ невозможно выявить такие доказательства заболевания, как наличие мононуклеарного инфильтрата или отложение антиген-антительных комплексов во внутреннем ухе ввиду невозможности проведения биопсии внутреннего уха, хотя подобные признаки выявляются на моделях болезни у животных.
Эпидемиология
Распространенность АБВУ полностью неизвестна, т. к. отсутствуют определенные диагностические критерии, а также из-за недостаточной информированности врачей. Тем не менее АБВУ встречается реже, чем внезапная глухота, с частотой 1 случай на 5000–10 000 человек в год. Как и другие аутоиммунные заболевания, АБВУ наблюдается чаще у женщин, обычно манифестирует в возрасте 20–50 лет и редко встречается в детском возрасте [19]. Приблизительно 50% больных с диагностированным АБВУ имеют те или иные проявления синдрома Меньера [20].
Клиника
Клиническая картина заболевания неспецифична и может включать в себя симптомы почти всех заболеваний внутреннего уха. АБВУ чаще всего выглядит как быстропрогрессирующее, асимметричное, чаще двустороннее, флюктуирующее снижение слуха с атипичной (басовой) конфигурацией аудиограмм, сопровождаемое шумом, чувством полноты в ушах, заложенности и нередко головокружением. Реже в начале болезни АБВУ может быть односторонним. Результаты аудиологических исследований (речевая аудиометрия, отоакустическая эмиссия, вызванные и микрофонные потенциалы и т. п.) могут не соответствовать степени снижения слуха по данным тональной пороговой аудиометрии [21]. Особенно сильно страдает разборчивость речи [22, 23]. Головокружение наблюдается практически в 50% случаев, что вызывает определенные сложности проведения дифференциальной диагностики с болезнью Меньера [24]. В случае если правильный диагноз не удается установить вовремя и, соответственно, начать адекватную терапию, АБВУ может распространиться на оба уха и прогрессировать с исходом в глухоту.
Диагностика
Быстрая установка диагноза и назначение адекватной терапии определяют слуховой прогноз у пациентов с АБВУ. Этот факт способствует поиску специфических маркеров воспаления внутреннего уха. Выявление аутоантител обычно является первым шагом в определении аутоиммунной природы заболевания. К сожалению, специфичных и чувствительных иммунологических маркеров АБВУ в настоящее время не выявлено [25]. За время изучения АБВУ было предложено огромное количество диагностических тестов: антитела к коллагену 2-го типа, эндотелиальным клеткам, сульфаглюкоронозил гликолипидам, основному периферическому миелиновому протеину 0 и т. д. Также изучалось значение иммунных комплексов и изменений популяций лимфоцитов в периферической крови [26]. Наиболее изученным является аутоантитело, связывающее антиген весом 68 кДа, выделенное из экстракта височной кости быка, – индуцируемая форма белка теплового шока 70 (HSP-70) [27]. HSP-70 экспрессируется при различных патологиях внутреннего уха, является ранним маркером повреждения клеток, однако он не специфичен. В исследовании Yeom R. et al. (2003) частота выявляемости антител к HSP-70 не различалась между пациентами с АБВУ и группой контроля, следовательно, HSP-70 не может использоваться для диагностики АБВУ [28]. У мышей, иммунизированных HSP-70 и продуцирующих антитела к HSP-70, не наблюдается потеря слуха, что свидетельствует о том, что эти антитела непосредственно не участвуют в патогенезе АБВУ. Однако эти антитела могут использоваться в качестве маркеров активности заболевания и маркеров ответа на терапию. Аутоантитела к специфическим кохлеарным антигенам обладают низкой специфичностью для быстропрогрессирующей сенсоневральной потери слуха. Осложняет диагностику АБВУ невозможность проведения биопсии тканей внутреннего уха, т. к. данная манипуляция приводит к разрушению органа и необратимой потере его функции. Таким образом, в настоящее время диагностика АБВУ строится преимущественно на основании особенностей клинической картины, признаках прогрессирующей сенсоневральной потери слуха при повторных аудиограммах и ответе на иммуномодулирующие препараты, такие как ГКС. Для диагностики АБВУ предложены диагностические критерии, представленные в таблице 1. Наличие АБВУ вероятно при наличии 3-х больших или 2-х больших и 2-х малых диагностических критериев [25]. При выявлении признаков АБВУ крайне важным, помимо исключения инфекционной, сосудистой причин заболевания, является активный поиск системных аутоиммунных заболеваний.
Лечение
Эффективное лечение НСТ вирусной или сосудистой этиологии возможно только в острый период – до 2-х нед. от начала заболевания. После этого срока, независимо от вызвавшей причины и проводимого лечения, слух, как правило, не улучшается. При АБВУ терапевтическое «окно» может быть расширено до ≥3–6 мес. В связи с этим лечение АБВУ должно проводиться независимо от сроков давности возникновения заболевания [7, 29, 30]. Кортикостероиды
(ГКС). Являются препаратами выбора в терапии АБВУ. Инициация лечения: используется схема дозировки 1мг/кг/сут преднизолона или 6-метилпреднизолона в течение 1 мес. При использовании более коротких курсов и низких дозировок снижается эффективность и повышается риск рецидива [15]. При быстропрогрессирующих формах дозировка 1 мг/кг/сут сохраняется до достижения стабильной аудиограммы со снижением дозы в течение следующих 8 нед. до 10–20 мг/сут. Достигнутая сниженная дозировка сохраняется в течение следующих 6 нед. При тяжелой потере слуха (более 70 дБ) проводится пульс-терапия: 3 пульса по 500 мг с переходом на пероральный прием по указанной ранее схеме. Необходимо отметить, что у ряда пациентов улучшение слуха отмечается лишь к 4-й нед. с момента начала терапии. Некоторые пациенты не отвечают на ГКС или нуждаются в применении более высоких дозировок для контроля заболевания. В таких случаях предпринимались попытки назначения других иммуносупрессантов, таких как метотрексат и циклофосфан. Эмпирическим основанием для их использования в определенных случаях является тот факт, что они потенцируют эффект ГКС, тем самым достигается ремиссия в отношении одного или нескольких симптомов, которая не достигалась при использовании ГКС изолированно. Также иммуносупрессанты могут назначаться со стероид-сберегающей целью. Средний уровень ответа на терапию ГКС составляет 60%. У большинства пациентов доза ГКС может быть снижена вплоть до полной отмены без рецидива заболевания, однако у ряда пациентов развивается стероид-зависимая потеря слуха. Также может развиваться стероид-резистентность, что требует назначения других иммуносупрессантов.
Метотрексат
. Метаанализ не выявил никаких преимуществ при назначении комбинированного лечения по сравнению с монотерапией ГКС [31]. Однако в отношении головокружения или неустойчивости при ходьбе, возможно, требовалось более длительное лечение. Наиболее часто метотрексат применялся в дозе 7,5 мг/нед. После достижения ответа препарат назначался перорально в дозе 15 мг/нед. на срок 12 мес.
Циклофосфамид
. Циклофосфамид изначально применялся B. McCabe в его первом исследовании [2] и считался препаратом выбора. Однако ввиду его побочных эффектов препарат используется не часто и преимущественно у пациентов, резистентных к терапии ГКС. Перорально циклофосфан назначается в дозе 1–2 мг/кг/сут в течение 4–6 нед. При в/в введении начальная доза составляет 0,75 мг/м2 или – в случае сниженной более чем на 1/3 от нормы СКФ – 0,5 мг/м2. Введения выполняются каждые 1–3 мес. Необходим тщательный контроль лейкоцитов и нейтрофилов периферической крови. При одновременном назначении ГКС и циклофосфана с целью профилактики пневмоцистной пневмонии может назначаться ко-тримоксазол.
Плазмаферез
. В длительном исследовании пациентов с АБВУ у 50% больных наблюдалось улучшение или стабилизация показателей слуха на фоне плазмафереза [32]. В исследовании Т.А. Сичкаревой (2010), включившем в себя 121 пациента с острой или хронической НСТ, положительный эффект при острой НСТ был достигнут в 73,3% случаев, при хронической НСТ – в 59% [33]. Необходимо отметить целесообразность использования данного вида терапии в сочетании с ГКС во избежание развития синдрома «рикошета».
Интратимпанальная терапия.
Использование ГКС интратимпанально является привлекательным методом терапии ввиду минимальной инвазивности, целенаправленного действия препарата на пораженное ухо и уменьшения системных побочных эффектов ГКС. Однако не разработано общих рекомендаций относительно дозировок и продолжительности подобного лечения. Особенностью интратимпанальной терапии является невозможность контролировать, какое именно количество препарата достигает внутреннего уха (часть препарата абсорбируется в среднем ухе, часть выводится через евстахиеву трубу). Таким образом, эффективность данной терапии не может быть определена полностью [34].
Этанерцепт
. Результаты первых попыток применения этанерцепта являются многообещающими, но не окончательными ввиду малого количества проведенных исследований [35]. Существуют данные об успешном применении этанерцепта совместно с метотрексатом, что может позволить воздержаться от назначения ГКС [36]. Стандартной дозировкой считается 25 мг п/к 2 р./нед. на протяжении неопределенного времени. Адалимумаб назначается п/к в дозе 40 мг каждые 2 нед. на неопределенный срок. Дозировка может быть увеличена до 40 мг/нед., если наблюдается снижение ответа. Препарат успешно использовался у 1 пациента с аутоиммунной сенсоневральной тугоухостью и ревматоидным артритом [37].
Инфликсимаб
. Стандартным протоколом применения препарата является медленное в/в введение (около 2 ч) в дозе 3 мг/кг в начале, на 2-й и 6-й нед. лечения с переходом на поддерживающую схему каждые 8 нед. Интратимпанальное введение инфиликсимаба может применяться со стероидсберегающей целью у пациентов с АБВУ [38].
Анти-В-клеточная терапия.
В нескольких исследованиях было продемонстрировано успешное использование ритуксимаба у пациентов с АБВУ [39, 40]. Для формирования окончательного мнения требуется проведение дополнительных исследований. Рекомендованный режим дозирования – 1000 мг в/в капельно с последующим повторным введением 1000 мг через 2 нед.
Кохлеарные имплантаты
применяются при АБВУ на конечной стадии заболевания [41]. Они являются чрезвычайно дорогостоящими, но тем не менее не имеют аналогов при полной глухоте. Они могут выступать важной альтернативой иммуносупрессантам ввиду отсутствия таких побочных эффектов, как развитие серьезных инфекций и онкологических заболеваний. В большинстве случаев контрольная аудиограмма проводится на 2-й нед. с момента начала терапии. Улучшение слуховой чувствительности после проведенного лечения считается достоверным при уменьшении порогов звуковосприятия на 10–15 дБ не менее чем на 3-х частотах.
Клиническое наблюдение
Пациентка, 33 года,
поступила в отделение планово, впервые с жалобами на боли воспалительного характера в шейном, грудном отделах позвоночника, плечевых суставах, повышение температуры до 37,2 °С без озноба, катаральных явлений; прогрессирующее двухстороннее снижение слуха. В течение многих лет беспокоят боли воспалительного характера слабой/умеренной интенсивности в шейном, грудном отделах позвоночника. Выставлялся диагноз дорсопатии. В мае 2013 г. (через 3 мес. после рождения второго ребенка) – приступ системного головокружения, выраженного снижения слуха на левое ухо длительностью около 1 нед. с дальнейшим постепенным частичным улучшением на протяжении последующих 3-х нед. В августе 2014 г. – повторный приступ со снижением слуха на правое ухо, с дальнейшим восстановлением на протяжении 1 мес. Ухудшение осенью 2015 г. – прогрессирующее снижение слуха на оба уха. В январе – феврале 2016 г. обследована в ГКБ по месту жительства. В общем анализе крови: лейкоциты – 14,2×109/л, эритроциты – 4,77×1012/л, гемоглобин – 132 г/л, гематокрит – 35,9%, тромбоциты – 337×109/л, СОЭ – 14 мм/ч, общий белок – 71 г/л, креатинин – 75 мкмоль/л, мочевина – 5,2 ммоль/л. В общем анализе мочи: белок не обнаружен, лейкоциты – 0–3–5 в п/зр., эритроциты, цилиндры не обнаружены. МСКТ височных костей придаточных пазух, рентген органов грудной клетки – без патологических изменений. Аудиометрия: двухсторонняя нейросенсорная тугоухость 4 ст. справа, 2 ст. слева. На фоне терапии дексаметазоном (дозы неизвестны) – положительная динамика в виде улучшения общего самочувствия, слуха, уменьшения шума в ушах. МРТ от 17.02.2016 г.: признаки конического сужения и снижения кровотока в левой позвоночной артерии сегментов V3 и V4; признаки снижения кровотока по левой позвоночной артерии в сегментах V3 и V4. Около 1 мес. до поступления – усиление болей в суставах, повышение температуры до 37,2 °С без озноба, катаральных явлений (ранее температуру не измеряла). В лабораторных анализах за 1 мес. до поступления (амбулаторно): лейкоциты – 11,63–7,69×109/л, нейтрофилы – 7,51–4,16×109/л, гемоглобин – 120–122 г/л, эритроциты – 4,72–4,72×1012/л, гематокрит – 37,7–37,9%, тромбоциты – 354–330×109/л, СОЭ – 17–16 мм/ч; СРБ – 17,1–20,3 мг/л, IgG – 9,7 г/л, IgA – 1,47 г/л, IgM – 1,6 г/л, РФ, АНФ, С3, С4, кальций, фосфор, паратгормон, остеокальцин – в пределах нормальных значений. ВПГ 1, 2, 6 типов (ДНК) – не обнаружены. HLA-B27-антиген (ИФА) – обнаружен. Консультирована ревматологом. На момент поступления состояние относительно удовлетворительное. Повышенного питания, вес 80 кг, стабильный. Температура – до 37,1 °С. Лимфоузлы, доступные пальпации, не увеличены. В отсутствие дополнительного приема НПВП – минимальные артриты плечевых суставов. Кожа над ними не изменена. Утренняя скованность в шейном, грудном отделах позвоночника до обеда. Сила в кистях не снижена. Симптом сжатия кистей, стоп – отрицательный с обеих сторон. Синдром доброкачественной гипермобильности суставов (5 баллов по критериям Бейтона). Уплощение физиологических изгибов позвоночника, небольшой сколиоз грудного отдела с вторичным гипертонусом прямых мышц. Симптомы натяжения отрицательные. Пальпация паравертебральных точек безболезненна. Вторичный гипертонус мышц воротниковой зоны. Миалгий нет. Небольшая пальпаторная болезненность правого илеосакрального сочленения. Экскурсия грудной клетки – 4 см. Тест «подбородок – грудина» – 1 см. Симптомы Отта, Томайера – в норме. Височные артерии визуально не изменены, пульсация сохранена, пальпация безболезненна. В лабораторных анализах: клинический анализ крови: гемоглобин – 125 г/л, эритроциты – 4,99×1012/л, лейкоциты – 13,8×109/л, тромбоциты – 380×109/л, СОЭ – 17 мм/ч (по Вестергрену). Иммунология крови: СРБ – 9,9 мг/л (0-1 мг/л), АНФ – 1:320, гомогенный, РФ – 10,3 (≤15), p-ANCA – 1:320, с-ANCA – нет, АТ к дс-ДНК – нет, IgG – 8,2 г/л, IgA – 1,47 г/л, IgM – 1,56 г/л, криоглобулины – нет. Клинический анализ мочи – протеинурия 130–150 мг/л. По данным рентгенологического исследования выявлены признаки спондилита шейного, грудного отделов позвоночника, энтезиты седалищных, подвздошных костей. Признаки поражения илеосакральных сочленений, деструктивного поражения периферических суставов не найдены (в т. ч. при МРТ с в/в контрастированием). Также при проведении гастро-, колоноскопии с биопсией не получено данных о наличии у пациентки воспалительных заболеваний кишечника (НЯК, болезнь Крона). Выявлена слабоположительная реакция на амилоид на уровне собственной мышечной пластинки тонкой кишки. На аудиограмме – признаки двухсторонней нейросенсорной тугоухости 4 ст. справа, 2 ст. слева. При МСКТ органов грудной клетки – очаговых и инфильтративных изменений легочной ткани не получено. Таким образом, в ходе обследования клиническая, лабораторно-инструментальная картина свидетельствует о наличии у пациентки достоверного (по критериям ASAS) HLA-B27-позитивного аксиального спондилоартрита, ассоциированного с аутоиммунной болезнью внутреннего уха. Течение заболевания осложнено развитием двухсторонней нейросенсорной тугоухости. С учетом результатов биопсии толстой кишки, наличия небольшой протеинурии нельзя исключить наличия вторичного амилоидоза, что требует дальнейшего тщательного динамического наблюдения. Данных о наличии активного инфекционного, специфического, паранеопластического процессов, воспалительных заболеваний кишечника, системных васкулитов (в т. ч. ANCA-ассоциированных) в настоящее время не получено. С учетом скорости прогрессирования нейросенсорной тугоухости, отмечаемой во время нахождения пациентки в отделении, в отсутствие абсолютных противопоказаний принято решение о проведении пульс-терапии метилпреднизолоном (250 мг № 3) с последующим переходом на его пероральный прием (60 мг в преднизолоновом эквиваленте). Лечение перенесла удовлетворительно, существенные нежелательные реакции не отмечались. На фоне терапии отмечалось практически полное исчезновение артритов, воспалительных болей в шейном, грудном позвоночнике, уменьшилась выраженность шума в ушах, периферического головокружения, что позволило расширить двигательный режим пациентки. Субъективно пациентка также отметила существенное улучшение слуха. При контрольной аудиограмме – умеренная положительная динамика. В контрольных лабораторных анализах – нормализация концентрации С-реактивного белка, увеличение показателей красной крови. Через 1 мес. начато снижение дозы кортикостероидов до поддерживающей (7,5 мг в преднизолоновом эквиваленте). На этом фоне на протяжении последующих 6 мес. состояние пациентки сохраняется стабильным.
Заключение
АБВУ является сравнительно редким заболеванием, диагностика которого достаточно сложна и требует целенаправленного поиска СЗСТ. Тем не менее своевременное начало агрессивной иммуносупрессивной терапии позволяет сохранить слух у большинства пациентов.
Лечение
Пациенту необходимо получить от врача максимум информации и строго следовать клиническим рекомендациям. Несмотря на то, что список групп препаратов, влияющих на течение заболевания невелик, вполне возможно избежать анкилоза позвоночника и развития внесуставных осложнений со стороны других органов и систем. Очень важная роль отводится ежедневной гимнастике, которая показана абсолютно всем вне зависимости от активности заболевания и развития анкилоза. Её цель – замедление прогрессирование, профилактика и лечение деформаций, улучшение общего самочувствия. Основные упражнения – растяжение позвоночника и укрепление околопозвоночных мышц.
Если оценивать арсенал препаратов, доказанных в отношении АС (Внимание! Сейчас мы говорим только про позвоночник), то существует два основных класса лекарств.
В первую очередь, это нестероидные противовоспалительные препараты (НПВП). Они должны быть назначены пациенту сразу после установления диагноза, независимо от стадии заболевания, должны приниматься длительно и без перерывов, и способны не просто уменьшать боль, но и замедлять прогрессирование АС.
Иначе говоря, срастание позвонков между собой происходит в четыре раза медленнее по сравнению с теми пациентами, кто использовал НПВП только «по требованию». Подбор НПВП осуществляется лечащим врачом с учётом многих факторов, в том числе сопутствующих заболеваний пациента, особенностей назначения препарата и его возможных побочных эффектов.
Генно-инженерная терапия
– это блокаторы ФНО-α (инфликсимаб, голимумаб, адалимумаб, цертолизумаба пэгол, этанерцепт) и антитела к интерлейкину-17 (секукинумаб, нетакимаб). Эффективны на любой стадии развития АС (но на ранней больше, чем на поздней) и для снижения активности, и для профилактики деформаций. Как правило, назначаются в том случае, если эффект от НПВП недостаточный. С учетом наличия нескольких препаратов из группы генно-инженерной терапии у врача появляются возможности «переключать» пациента на другой лекарственный препарат в случае неэффективности первого.
В том случае, если возникают внесуставные поражения глаз, кишечника или кожи, то арсенал врача в плане эффективной терапии расширяется еще больше.
Тяжелые осложнения возникают либо при позднем обращении пациента, либо при игнорировании им рекомендованного лечения.
В наше время терапия позволяет избежать быстрого и выраженного прогрессирования анкилозирующего спондилита и сделать классическую «позу просителя» достоянием истории
Препараты при спондилите
Медикаментозная терапия — это основной способ лечения при спондилите. Помимо антибиотиков для устранения основного заболевания, ведущими препаратами считаются нестероидные противовоспалительные средства (НПВП). Они позволяют снять симптомы воспаления, убрать отечность и полностью или частично устранить болевые ощущения. НПВП нельзя принимать постоянно — их назначают только на время обострений, поскольку они негативно влияют на слизистую ЖКТ.
При сильном воспалении и обширном некрозе тканей позвоночника назначают глюкокортикоидные стероиды. Эта группа препаратов также предназначена для краткосрочного симптоматического применения, поскольку длительный их прием может лишь усугубить спондилит.
При инфекционной интоксикации организма показано капельное внутривенное введение растворов для вывода токсинов. Для защиты здоровых тканей и улучшения обменных процессов применяются витамины группы В, корректоры микроциркуляции крови, вазопротекторы.
Из-за того, что пораженный позвоночник не может выполнять свою опорную функцию в полном объеме, часть нагрузки принимают на себя мышцы спины. Постоянное перенапряжение вызывает сильные спазмы — для их снятия больным назначают спазмолитики и миорелаксанты.
Единственная группа медикаментов, которая действительно помогает восстановить разрушенные ткани — это хондропротекторы. Хондропротективные средства для лечения спондилита помогают ускорить процессы регенерации в позвоночнике, защищают здоровые клетки от неблагоприятного воздействия токсинов и ферментов, а также значительно замедляют прогрессирование болезни. Наиболее эффективны они при медленном или обостряющемся течении болезни, а также в восстановительный период после лечения септического спондилита. При спондилитах различной этиологии врачи рекомендуют курс Артракама. Этот хондропротектор в саше достаточно принимать 2-4 месяца в год, чтобы предотвратить или замедлить переход спондилита на новые суставы. Артракам уменьшает боли, помогает продлить ремиссию, а главное — позволяет реже прибегать к приему небезопасных для здоровья противовоспалительных средств. Будучи натуральным продуктом на основе глюкозамина, Артракам не имеет противопоказаний для применения в любом возрасте.
И пусть спондилит пощадит Ваши суставы!