иглотерапия 2100 руб.
массаж 1800 руб.
113 отзывов
Если вам «слегка за …дцать», и вы женщина, шансов испытывать боли в коленях у вас 1:5. Возможно, вам ортопед или хирург сказал, что у вас «деформирующий гонартроз коленного сустава», рекомендовал лечение, присвоил болезни 1, 2 или 3 степень, назвал возможные причины, подтвердил симптомы. И скорее всего, вы уже знаете, как это, когда боли не дают уснуть по ночам, трудно передвигаться, да и просто жить. Давайте разберемся, что такое гонартроз, почему вам не повезло им заболеть, и как можно повернуть процесс вспять без лекарств и вреда для здоровья.
Анализируя человека как целостную систему, специалисты считают гонартроз коленного сустава страданием всего организма. Наиболее частая причина гонартроза – это гормональный сбой работы внутренних органов. Как правило, все начинается с почек. Почки – это фильтр организма. Их задача – фильтрация крови, освобождение крови от солей. Если почки не справляются со своей функцией, кровь не очищается, соли остаются. Чтобы защититься от попадания крови с солью в мозг, организм «складирует» соли в суставах (гонартроз) и позвоночнике (остеохондроз).
Когда процесс зашел далеко, присоединяется артриты. Потом сужаются сосуды, тоже чтобы не пускать соли. Все это ведет к плохому кровоснабжению мышц, растет нагрузка на скелет – позвоночник, суставы, межпозвоночные диски. Далее присоединяется печень, желчный пузырь, поджелудочная железа. Суставы утрачивают гибкость, мышцы атрофируются. Дальше организм «изнашивается», и болезнь прогрессирует.
Для лечения гонартроза в «Ист Клиник» используется:
Скорее всего, уже пытались лечить гонартроз. Принимали лекарства, ходили на физиотерапию, делали массажи. Получали временный эффект или не получали его совсем. А побочные эффекты получали на «полную катушку», верно? И вот уже на горизонте маячит операция по замене сустава. Конечно, в последней стадии другого выхода нет. В ваших силах не допустить такую ситуацию и начать борьбу с гонартрозом по правилам. В «Ист Клиник» мы используем комплексное лечение, которое дает результаты с первых сеансов у большинства пациентов.
Лечебный массаж, остеопатия, мягкие мануальные техники.
Сначала мышцы разогревают массажем. Обычно работают по биологически активным точкам. Врач находит болезненные области и выполняет определенные движения, глубоко прорабатывая мышцы, восстанавливая правильное положение сустава. Благодаря такой работе, можно восстановить объем движений, снять боли, устранить деформации. Конечно, первые сеансы довольно болезненны. Однако по мере выздоровления боли исчезают, а возможность жить полноценно без боли — возвращается.
Иглоукалывание от «букета» болезней.
Иглы вводят в специальные точки в зависимости от состояния. Каждая из более чем 400 биологически активных точек связана с каким-либо органом, поэтому перед процедурой проводят диагностику, чтобы определить, какие точки нужны для работы. С помощью иглоукалывания можно снять воспаление, улучшить питание тканей и обмен веществ, восстановить иммунитет. А еще — лечить сопутствующие болезни, улучшить сон и настроение.
Гирудотерапия.
Пиявки устраняют спазмы в мышцах, восстанавливают лимфо- и кровообращение в зоне больного сустава, стимулируют восстановление поврежденных хрящевых тканей.
Прогревание от боли и спазмов — моксотерапия.
Прогревание определенных точек полынной сигарой — моксой — дает быстрый результат. Эффект, как и во время иглоукалывания, появляется не только в месте воздействия. Прогревание моксой ускоряет кровоток и обмен. Дает возможность двигаться свободнее, чувствовать себя бодрее и активнее.
Лазер по точкам — лазеротеропунктура.
Это сочетание эффекта лазера низкой интенсивности и эффекта акупунктуры. Такая комбинация помогает начать восстановление поврежденного хряща, убрать отек, боли и воспаление. И все это комфортно, без боли. Поэтому лазер можно тем, кому не подходят другие методы.
Гомеопатические уколы от гонартроза — гомеосиниатрия.
Традиционно для лечения этим методом используют инъекционные препараты фирмы Хеель. Это комплексные препараты из трав, минералов, веществ животного происхождения и многого другого. В некоторых препаратах – десятки компонентов. Врач подбирает схему и сочетание лекарств. При деформирующем гонартрозе гомеосиниатрия – один из наиболее действенных методов.
И, конечно, каждый пациент с гонартрозом получает рекомендации по питанию и комплекс физических упражнений. Для суставов движение — это жизнь в прямом смысле.
Лечение гонартроза коленного сустава 2 степени
Медикаментозное лечение
Этот вид лечения состоит из назначения и употребления различных лекарственных средств под постоянным наблюдением специалиста. Именно от вашего врача зависит какие из препаратов будут наиболее успешны в выполнении своих функций.
Противовоспалительные препараты
Эти лекарства предназначены для устранения боли. Они скорее уменьшают симптомы и оказывают полезное лечебное действие.
Лечение хондропротекторами
Употребление хондропротекторов помогает восстановить хрящ. Хондропротекторы натуральны, легко принимаются организмом и хорошо стимулируют синтез коллагена. Однако, необходимо знать, что данные препараты рекомендуют принимать регулярно. Лечение проводится достаточно длительно. К хондропротекторам относятся также препараты, содержащие гиалуроновую кислоту.
Все эти медпрепараты действуют медленно и выпускаются, в основном, в виде инъекций. Именно этот способ применения препарата в данном случае имеет наилучший эффект.
Обезболивающие средства
Обычно для этой цели назначаются так называемые внутрисуставные инъекции. Для этого используются кортикостероиды. Вот их-то нужно принимать короткими курсами и использовать только при ярко выраженных симптомах и достаточно сильных болях.
Физиотерапия при гонартрозе
Для прохождения этого курса используется несколько видов мазей. Они, в большей степени, относятся к согревающим препаратам, чем носят противовоспалительный характер. Цель этих средств заключается в усилении кровообращения и в устранении воспаления.
Ортопедическое лечение
Ортопедическое лечение предполагает назначение ортопедом и использование определенных обувных стелек, наколенников, а также тростей, которые снимают лишнюю нагрузку с больных коленей, способствуя облегчению ходьбы.
Массаж
Одним из очень важных дополнительных методов лечения является массаж. Курс лечения назначает врач. Обычно он состоит из 5-10 сеансов и прописывается при полном отсутствии воспалений. Эффективно работает также лимфодренажный массаж. Он предотвращает скопление жидкости в коленном суставе. Мануальная терапия объединяет в себе растирание и поглаживание. Наибольший эффект эта процедура имеет после проведения сеанса лечебной физкультуры.
Уколы
Инъекции при лечении гонартроза коленного сустава 2 степени помогают быстро и эффективно доставить лекарственное средство к поврежденным тканям. Они показаны при острой боли в суставах, но сами по себе не являются основой терапии. Уколы можно рассматривать лишь как очень удачное дополнение к общему курсу лечения. Тем не менее, именно они помогают быстрее всего снять болевые ощущения. Кроме этого, инъекции для коленных суставов позволяют уменьшить дозы пероральных препаратов. А это очень важно при возникновении побочных эффектов с нарушением работы ЖКТ.
Лечение народными средствами
Как лечить гонартроз коленного сустава 2 степени, знает также народная медицина. В качестве главного средства здесь выступает глина.
Рецепт: протрите сустав влажной салфеткой, разбавьте глину водой до консистенции сметаны. Разложите глину на хлопчато-бумажной ткани слоем в 2см. Приложите этот компресс к больному колену и забинтуйте. Утеплите сустав с помощью шерстяного шарфа. Выдержите компресс в течение 2 часов. После помойте колено теплой водой. Скорее всего, вам потребуется делать около 5-ти таких процедур ежедневно.
Упражнения при гонартрозе коленного сустава 2 степени
Перед лечением гонартроза коленного сустава 2степени упражнениями, необходима консультация доктора. Гимнастика предполагает особенный подход. Весь процесс должен быть легким и приносить удовольствие, а не причинять боль. При появлении малейших болевых ощущений необходимо сразу же прекратить занятие.
Комплекс упражнений назначается индивидуально. Это зависит от состояния пациента и его физической подготовки.
Почему комплексное лечение в «Ист Клиник» — выгоднее и эффективнее?
Чтобы гонартроз быстрее остался у вас в прошлом, мы предлагаем комплекс лечебных процедур. Это экономит ваше время, средства и ускоряет выздоровление. Лечение гонартроза действует быстрее при сочетании массажа, остеопатии, мягкой мануальной терапии, иглоукалывания с лазером, моксотерапией, гомеосиниатрией. Эти процедуры входят в курс лечебных сеансов, комбинацию их подбирает врач.
За одно посещение клиники вы можете пройти две и более процедуры, а при единовременной оплате курса лечения получить приятный бонус — 10% скидку. Стоимость одного лечебного сеанса зависит от набора процедур.
Скорость излечения не лекарственными методами зависит от жизненного потенциала человека, однако в большинстве случаев при 2-й стадии достаточно одного комплексного курса лечения.
Гонартроз коленного сустава: причины и механизмы. Почему именно вы?
Причин масса. Это и лишний вес, и проблемы с эндокринной системой, и травмы, и предшествующие воспаления сустава — артриты. Чтобы понять, почему появляется гонартроз, давайте посмотрим, как работает сустав в норме и при болезни.
Основная нагрузка в суставе во время движения приходится на суставной хрящ. Он как губка, пропитанная суставной жидкостью: сжимается во время нагрузки — жидкость выдавливается, расправляется во время отдыха — жидкость всасывается обратно. Сосудов в хряще нет, все питание идет за счет жидкости внутри сустава. Если нагрузка больше, чем возможность к восстановлению, а питания недостаточно, хрящ страдает. На нем появляются микроскопические трещинки, он становится более хрупким и тонким. Это начало пути к гонартрозу.
Медикаментозное лечение остеоартроза
О
стеоартроз (ОА) – это гетерогенное заболевание, с наибольшей частотой встречающееся у людей старше 60 лет и характеризующееся выраженным болевым синдромом и нередко наличием воспалительных признаков, приводящими больного к врачу.
Боль представляет собой самый частый симптом при ОА
, поэтому лечение заболевания направлено, в первую очередь, на уменьшение болевого синдрома и, как результат этого, улучшение функции сустава. У 10–30% больных ОА развивается различной степени нетрудоспособность, поэтому возможность воздействовать на естественное течение заболевания имело бы большое социальное и экономическое значение.
Традиционное лечение ОА
заключается прежде всего в управлении болевым синдромом, которое начинается с различных
нефармакологических методов
, включающих образование больных, физическую терапию, чрескожную стимуляцию и другие. Однако при недостаточной эффективности нефармакологических методов лечения требуется назначение лекарственной терапии. Действие большинства лекарственных средств направлено, в первую очередь, на лечение симптомов болезни, хотя некоторые из них рассматриваются, как препараты, влияющие на катаболические и анаболические процессы, происходящие при повреждении хряща. Эти лекарства классифицируются, как препараты, модифицирующие симптомы болезни. Выбор препаратов, подбор комбинации различных методов лечения остаются строго индивидуальными (табл. 1). Знание механизмов действия, эффективности, противопоказаний при назначении препаратов, профиля безопасности лекарств чрезвычайно важно.
Несмотря на относительно длительный период применения лекарственных средств, остается большое количество вопросов относительно симптоматического лечения. Иерархически первое место занимают анальгетические препараты
. Впервые использование ацетоминофена при ОА рекомендовали Bradley с соавт. [1], которые показали, что прием 4,0 г ацетаминофена в день был сравним по эффективности с двумя дозами ибупрофена (1200 мг и 2400 мг) у больных с ОА коленных и тазобедренных суставов, а переносимость препарата была лучше. Изучение механизма действия препарата выявило наличие высокой анальгетической, жаропонижающей и небольшой противовоспалительной активности [3,4]. In vitro высокие дозы ацетоминофена ингибировали синтез простагландинов [5]. Ацетоминофен, по видимому, влияет на центральную нервную систему через ингибицию синтеза простагландина Е2 и не оказывает действия на синтез простагландинов в периферических тканях [б].
Дальнейшее изучение ацетоминофена с точки зрения его эффективности, риска развития побочных реакций, а также стоимости лечения, показало преимущество его применения у больных ОА с легким и умеренным болевым синдромом, но было отмечено, что клиническая эффективность выше у нестероидных противовоспалительных препаратов
(НПВП) [2]. Кроме того, появились данные о гепатотоксичности и потенциальном повреждающем действии ацетоминофена на почки [7], в связи с чем обращается внимание на то, что при приеме около 60 г алкоголя в день доза ацетоминофена не должна превышать 2,0 г в сутки. Преимущество препарата перед другими анальгетическими средствами заключается в его низкой токсичности для желудочно–кишечного тракта (ЖКТ), однако у больных с выраженным болевым синдромом, с наличием воспаления анальгетики оказываются недостаточно эффективными и требуется назначение НПВП.
НПВП, обладая противовоспалительными, анальгетическими и жаропонижающими свойствами, широко используются для уменьшения боли, синдрома «геля», улучшения функции суставов у больных ОА. Выбор НПВП обычно основывается на мнении врача. В терапевтических дозах клиническая эффективность НПВП примерно одинаковая, однако индивидуальный ответ на препараты широко варьирует [8]. На различия в клинической эффективности также оказывают влияние фармакокинетические, фармакодинамические и метаболические свойства препаратов. И хотя вариабельность ответа можно объяснить (частично) адсорбцией, распределением и метаболизмом препарата, наиболее важная причина разной эффективности лежит, по–видимому, в потенциальных различиях механизма действия лекарств [9].
Большинство НПВП представляют собой слабые органические кислоты и полностью адсорбируются при пероральном приеме, около 95% принятого препарата связывается с сывороточным альбумином, поэтому гипоальбуминемия, особенно у пожилых людей с хроническими соматическими заболеваниями, может приводить к повышению концентрации НПВП в сыворотке и, как следствие этого, к увеличению токсичности. Прием НПВП вместе с пищей может уменьшить его адсорбцию, как например, это показано для напроксена, адсорбция которого в этих условиях снижается на 16%. НПВП метаболизируются в основном в печени и экскретируются с мочой, что необходимо учитывать при назначении этих препаратов больным с нарушениями функции печени или почек. Концентрация препаратов в плазме широко варьирует и зависит от клиренса в почках и скорости метаболизма.
Определенное значение для объяснения различных клинических эффектов имеет время нахождения препаратов в плазме, согласно которому НПВП подразделяются на «коротко– и длительноживущие».
Противоспалительная и анальгетическая активность НПВП связана с уменьшением продукции простагландинов Е. Показано также, что НПВП ингибируют образование простациклина и тромбоксана, оказывая комплексное действие на сосудистую проницаемость и агрегацию тромбоцитов. Противовоспалительное действие НПВП обусловлено, по–видимому, подавлением активности циклооксигеназы
(ЦОГ) – основного фермента метаболизма арахидоновой кислоты на пути превращения ее в простагландины. Существуют, по крайней мере, две изоформы ЦОГ. И хотя аминокислотная последовательность их на 60% идентична, они представляют собой продукт двух разных генов.
ЦОГ–1
регулирует нормальные клеточные процессы и стимулируется гормонами или факторами роста. ЦОГ–1 экспрессируется на большинстве тканей организма и в различной степени ингибируется всеми НПВП, поэтому многие побочные реакции со стороны желудочно–кишечного тракта объясняются именно этой ингибицией [13].
Другая изоформа, ЦОГ–2
, которая обычно не определяется в тканях, экспрессируется при воспалении и также ингибируется всеми существующими НПВП в большей или меньшей степени, а также глюкокортикостероидами [34], что отличает ее от ЦОГ–1.
На основании этих данных была создана новая группа препаратов – специфических ингибиторов ЦОГ–2, к которым относятся целекоксиб и рофекоксиб, примерно в 300 раз более эффективно подавляющие ЦОГ–2 по сравнению с ЦОГ–1 [15]. Клинические исследования при ОА показали, что оба препарата оказывали влияние на боль, сравнимое с действием напроксена, ибупрофена и диклофенака, и почти не оказывали повреждающего действия на слизистую желудочно–кишечного тракта и агрегацию тромбоцитов [16,17,18].
Вместе с тем, накапливаются данные о том, что противовоспалительное и анальгетическое действие НПВП не объясняется только ингибицией ЦОГ. Предполагают, что НПВП ингибируют активацию и хемотаксис нейтрофилов и уменьшают продукцию токсических кислородных радикалов в стимулированных нейтрофилах [5], тормозят активность фактора транскрипции NF–kB, таким образом ингибируя стимуляцию синтетазы оксида азота [20].
Кроме того, НПВП, являясь ингибиторами простагландинов, которые, как предполагают, ингибируют апоптоз (программированная гибель клеток), могут способствовать нормализации жизненного цикла клеток в очаге воспаления [14].
Арахидоновая кислота подвергается действию не только ЦОГ, но и 5– и 12–липооксигеназ. К настоящему времени накапливаются данные о том, что механизм развития НПВП–индуцированных гастропатий может включать альтернативные процессы превращения арахидоновой кислоты в лейкотриены под воздействием 5–липооксигеназы (5–ЛОГ). Это послужило поводом для создания новой группы препаратов, способных ингибировать ЦОГ–1 и ЦОГ–2. Первое исследование такого препарата – ликофелона
(200 мг х 2 раза в день) проведено у 148 больных ОА в сравнительном испытании с напроксеном (500 мг х 2 раза в день) и плацебо [19]. Ликофелон оказался равным по эффективности НПВП, исключительно хорошо переносился и не вызывал поражения желудочно–кишечного тракта,
Таким образом, изучение механизмов действия НПВП привело к созданию новой классификации препаратов (табл. 2), основанной на селективности действия в отношении ЦОГ, позволяющей врачу индивидуально подобрать наиболее эффективный и безопасный препарат.
Многочисленные контролируемые исследования свидетельствуют о достоверно более высокой эффективности НПВП по сравнению с плацебо, поэтому при выборе препарата необходимо учитывать его безопасность, влияние на хрящ, а учитывая возраст больных ОА, и наличие большого числа сопутствующей патологии, сочетаемость с другими средствами.
Общие принципы применения НПВП при ОА заключаются в использовании минимальной эффективной дозы, приеме одновременно не более одного НПВП, отмене препарата при отсутствии боли и оценке эффективности лечения через 2–4 недели от начала приема.
При ОА наиболее оптимальными считаются «короткоживущие» препараты: ибупрофен, диклофенак, кетопрофен. Применяемые при ОА дозы препаратов обычно ниже, чем при воспалительных заболеваниях суставов (табл. 3). Для быстрого купирования болевого синдрома назначаются препараты с высокой анальгетической активностью: калиевая соль диклофенака (Раптен рапид)
. Препарат оказывает стойкий анальгетический эффект значительно быстрее и продолжительнее, чем натриевая форма диклофенака и другие НПВП. Кроме того, препарат обладает минимумом побочных эффектов по сравнению с ибупрофеном и индометацином. Раптен рапид может быть также рекомендован для вводной терапии для купирования боли с последующим переходом на другой анальгетик. Уменьшение болевого синдрома на фоне лечения НПВП отмечается примерно у 60–70% больных ОА. Вместе с тем индивидуальные различия в эффективности НПВП колеблются в широких пределах, поэтому на первое место выходит не только подбор наиболее эффективного препарата (Раптен рапид и др.), но и оценка реальных различий в токсичности препаратов. Побочные реакции, наблюдаемые при лечении НПВП, представлены в таблице 4.
Наиболее клинически значимыми являются побочные реакции со стороны ЖКТ, их возникновение, вероятно, обусловлено местной и системной ингибицией синтеза простагландинов. Спектр поражения ЖКТ довольно широк – от развития эзофагитов до кровотечений и перфораций пептических язв, иногда приводящих к смерти [13]. Приводятся данные о повреждении слизистой тонкой и толстой кишок [23]. Эндоскопические исследования показали, что наиболее часто поражаются препилорический и антральный отделы желудка. Как правило, они протекают бессимптомно, поэтому трудно оценить их истинную распространенность. Факторы риска развития НПВП–гастропатий включают в себя возраст больных старше 60 лет, наличие язвенного анамнеза, прием противоязвенных препаратов по любым причинам, сочетанное использование глюкокортикостероидов, наличие тяжелых сопутствующих заболеваний, например, сердечно–сосудистых [21,22]. На основании многочисленных клинических исследований относительный риск для язвы желудка составляет 4,0–5,0; для язвы 12–перстной кишки – 1,1–1,6 и от 4,5 до 5,0 – для язв желудка с кровотечением, перфорацией или смертельным исходом. «Длительноживущие» НПВП, как например, пироксикам, обладают большей ЖКТ–токсичностью,
Значительно лучшие результаты получены при использовании преимущественно селективных ингибиторов ЦОГ–2: мелоксикама и нимесулида. Отдельные клинические исследования свидетельствуют о сходной со стандартными НПВП эффективности, но более высокой безопасности в отношении поражения ЖКТ.
Применение специфических ингибиторов ЦОГ–2 ассоциируется с достоверным снижением частоты развития язвенного поражения ЖКТ по сравнению с диклофенаком и ибупрофеном. Кроме того, тяжелые гастроэнтерологическне побочные реакции (кровотечения, перфорации) встречаются в 2–3 раза реже при приеме рофекоксиба и целекоксиба. В последние годы постоянно дискутируются вопросы о риске/пользе НПВП при ОА, затратах при гастроэнтерологических побочных реакциях. По–видимому, селективные ингибиторы ЦОГ–2 могут существенно повысить безопасность лечения, особенно у пожилых больных с высокими факторами риска.
При недостаточной эффективности и плохой переносимости НПВП назначаются другие анальгетические препараты. Трамадол
– синтетический анальгетик центрального действия, не вызывающий физической и психической зависимости, эффективен при боли различного происхождения. Schnitzer с соавт. [24] показали, что препарат эффективен в отношении болевого синдрома, кроме того, сочетанное применение трамадола с напроксеном позволило снизить дозу последнего. Трамадол применяется при ОА в дозах от 50 до 200 мг в сутки. Сравнительно частые побочные реакции при применении препарата (тошнота, головокружения, запоры и сонливость) можно существенно уменьшить при титровании дозы (в течение 3–х дней, увеличивая дозу по 25 мг).
При изолированном суставном поражении для лечения ОА используются местные средства в виде мазей, кремов на основе НПВП, что позволяет избежать системных побочных реакций, особенно у пожилых, и хондроитин сульфата в сочетании с диметилсульфоксидом (Хондроксид
). Создана форма НПВП в виде пластыря, содержащая диклофенак, оказавшаяся эффективнее плацебо в 2–х недельном исследовании у 155 больных с гонартрозом [25], что, возможно, позволит уменьшить потребность в системных препаратах.
Moore с соавт. проанализировали 86 исследований для оценки эффективности и токсичности местных средств для лечения острой и хронической боли, в том числе и при ОА. Авторы заключили, что эти препараты достаточно эффективны и безопасны [26].
У больных гонартрозом при наличии суставного выпота используются внутрисуставные введения кортикостероидов
. К сожалению, отдельные аспекты этой терапии остаются противоречивыми (ее относительная эффективность, потенциально повреждающее действие и потенциально структурно–модифицирующее действие), поэтому место длительного применения внутрисуставной кортикостероидной терапии для лечения ОА остается пока не ясным – необходимы длительные двойные слепые исследования. В настоящее время считается, что число внутрисуставных введений в один сустав не должно превышать 3–4–х на протяжении одного года.
Несмотря на то, что НПВП уменьшают боль и воспаление, до сих пор не показано, замедляют ли они прогрессирование ОА и защищают ли хрящ от механического или воспалительного повреждения.
Попытки воздействия на болезнь начинались с изучения факторов риска, таких как ожирение, избыточная нагрузка суставов, и ограничивались рекомендациями по снижению веса и применению различных физических упражнений. В настоящее время ведутся разработки средств, способных замедлить прогрессирование ОА. Спектр изучаемых препаратов довольно широк: от антибиотиков с антиколлагенолитической активностью, гиалуроната и полисахаридов до более сложных препаратов, включающих факторы роста и цитокины. Эти препараты называются структурно–модифицирующими, их роль заключается в способности предотвратить, замедлить, стабилизировать или подвергнуть обратному развитию остеоартритический процесс не только в хряще, но и во всем суставе, рассматриваемом в целом, как орган. В настоящее время нет четких доказательств структурно–модифицирующих свойств для человека ни для одного препарата, но определенные данные получены для некоторых из них.
Хондроитин сульфат
(ХС) и
глюкозамин сульфат
(ГС) – сульфатированные гликозаминогликаны, которые находятся в экстрацеллюлярном матриксе суставного хряща. При пероральном приеме они хорошо адсорбируются и обнаруживаются в высоких концентрациях в полости сустава. Механизм их действия до конца не выяснен. Получены доказательства, что ХС и ГС стимулируют синтез гиалуроновой кислоты и протеогликанов и ингибируют действие протеолитических ферментов, тем самым усиливая анаболические процессы в хряще и подавляя катаболические, что может лежать в основе их структурно–модифицирующего действия. Имеются данные об их способности подавлять образование супероксидных радикалов и синтез оксида азота, что обусловливает, по–видимому, их анальгетический эффект. В процессе экспериментальных исследований in vivo было установлено, что введение ХС перорально или внутримышечно кроликам (с дегенерацией хряща, вызванной химопапаином), значительно повышало содержание протеогликанов хряща по сравнению с контрольными животными, что свидетельствует о том, что ХС защищает хрящ при повреждении и обладает способностью поддерживать ресинтез протеогликанов матрикса [27].
Лечение ХС приводит к значительному уменьшению болевого синдрома, улучшению функциональной способности суставов и позволяет снизить дозу принимаемых НПВП. Препарат обладает прекрасной переносимостью, практически не вызывая побочных эффектов [28,29,30]. Мета–анализ двойных слепых плацебо–контролируемых исследований ХС у 372 и 404 больных гон– и коксартрозом подтвердил эффективность препарата по сравнению с плацебо и НПВП [31,32]. Исследование, проведенное в Швейцарии [33] в течение года, затронуло вопрос о наличии у ХС структурно–модифицирующих свойств, поскольку препарат оказывал стабилизирующее влияние на ширину суставной щели и метаболические процессы в субхондральной кости и хряще, а тем самым, по–видимому, и на течение заболевания. На ежегодном Европейском конгрессе ревматологов, проходившем в Стокгольме (2002 г.), были доложены результаты длительного, в течение 2–х лет, применения ХС (800 мг/сутки) у 300 больных с гонартрозом, которые показали способность препарата замедлять прогрессирование ОА [34].
Более ранние краткосрочные исследования выявили эффективность ГС по сравнению с плацебо и НПВП [35,36]. Недавно длительное (в течение 3–х лет) применение ГС (1500 мг/сутки) у 212 больных с гонартрозом подтвердило не только симптоматическое действие препарата (снижение функционального индекса WOMAC), но и его способность замедлять рентгенологическое прогрессирование, которое оценивалось по изменению ширины суставной щели [37].
Относительно недавно стали появляться работы по сочетанному применению
этих препаратов. Так, двойное слепое плацебо–контролируемое изучение в течение 16 недель комбинации
глюкозамин гидрохлорида
(1500 мг/сутки) и
ХС
(1200 мг/сутки) у 34 мужчин с гонартрозом и болями в нижнем отделе спины показало значительное уменьшение болей в суставах, но не в спине [38]. В другом исследовании сообщалось о сочетанной терапии при ОА височно–челюстных суставов [39]. Вместе с тем многообещающие данные по структурно–модифицирующему действию ХС и ГС требуют дальнейшего подтверждения в длительных контролируемых исследованиях.
Гиалуронат
(ГЛ) представляет собой полисахарид, состоящий из длинной цепи дисахаридов, продуцируется в суставах хондроцитами и синовиальными клетками. В настоящее время используются 2 препарата ГЛ, вводимые внутрисуставно: низкомолекулярный (м.в. 500000–730000 дальтон) и высокомолекулярный (м.в. 6000000 дальтон). Клиническое применение ГЛ было обусловлено исследованиями синовиальной жидкости при ОА, показавшими значительное изменение ее реологических свойств по сравнению с синовиальной жидкостью здорового сустава. Поэтому предполагали, что введение ГЛ восстановит защитные и так называемые удар–адсорбирующие свойства синовиальной жидкости [40]. Однако длительный клинический эффект нельзя было объяснить только этими причинами, поскольку период полувыведения препарата составлял 2–8 дней. На основании дальнейших исследований было высказано предположение, что механизм действия препарата связан с ингибицией воспалительных медиаторов (цитокинов и простагландинов), стимуляцией анаболических и замедлении катаболических процессов в матриксе хряща [41,42].
Высокомолекулярный ГЛ [43] при сравнении 3 еженедельных инъекций с НПВП или с комбинацией НПВП и ГЛ оказался эффективнее НПВП, и, вероятно, может использоваться вместо или вместе с НПВП. При ретроспективном изучении 336 больных с гонартрозом хороший ответ наблюдался у 76% [44] при сохранении эффекта терапии в среднем до 8 месяцев. Местные побочные реакции наблюдались у 8% больных, от незначительных до развития острого синовита с выпотом, требовавшего внутрисуставного введения кортикостероидов или короткого курса НПВП.
Сравнительное исследование высоко– и низкомолекулярного ГЛ у 70 больных ОА коленных суставов (по 3 еженедельных инъекции) выявило более высокую эффективность первого препарата, при равном небольшом числе побочных местных реакций [45]. Вместе с тем, применение высоко– и низкомолекулярного ГЛ требует дальнейшего исследования для лучшего определения места этой терапии и особенно – оценки влияния длительного применения на замедление или обратное развитие деградации хряща. В настоящее время ГЛ определяется как средство, модифицирующее симптомы болезни, и рекомендуется для больных, которые не отвечают на другие виды терапии или не переносят НПВП.
Подтвердить структурно–модифицирующие свойства препаратов у человека чрезвычайно трудно, поскольку ОА – обычно очень медленно прогрессирующее заболевание. Необходимо принимать во внимание, что, возможно, любое эффективное в отношении симптомов болезни, средство может потенциально иметь структурно–модифицирующие свойства. Аналогичным образом, известно, что любой препарат со структурно–модифицирующими свойствами обладает небольшим и, как правило, отсроченным по времени действием на симптомы болезни. Кроме того, методы исследования прогрессирования заболевания ограничены, поэтому клиническое испытание структурно–модифицирующих препаратов представляет собой сложную задачу. Для демонстрации структурно–модифицирующих свойств в клинических испытаниях часто используют оценку исходов ОА по рентгенограммам коленных суставов; развиваются методы, способные оценить поверхность и объем хряща.
Некоторое преимущество в оценке эффективности лечения ОА имеют препараты, модифицирующие симптомы заболевания
. Тем не менее лечение больных ОА представляет собой сложную задачу. Во–первых, при гетерогенном заболевании с непредсказуемым течением, таком как ОА, важно помнить, что лечение не должно приносить вред больному. Во–вторых, трудно создать единый алгоритм лечения, так как индивидуальные различия течения болезни также велики. Поэтому лечение больных ОА следует рассматривать с учетом оценки пользы/риска от проводимой терапии.
Важным моментом в начале лечения является характеристика болевого синдрома в плане наличия или отсутствия воспалительных изменений. Допущение о том, что значительная часть больных имели только болевой синдром без признаков воспаления, легло в основу создания алгоритма лечения больных ОА коленных и тазобедренных суставов, предложенного Американской коллегией ревматологов в 1995 году [10,11]. При недостаточной эффективности нефармакологических методов лечения в качестве препаратов «первой линии» рекомендовались анальгетики (ацетоминофен 4,0 в сутки), далее – местная терапия (кроме ОА тазобедренных суставов), низкие дозы НПВП или другие анальгетики, такие как трамадол, а затем терапевтические дозы НПВП, внутрисуставные введения глюкокортикостероидов, гиалуроновая кислота, сульфатированные гликозаминогликаны. Для больных с высоким риском развития желудочно–кишечных осложнений назначалось профилактическое лечение
мизопростолом, ингибиторами протонного насоса, высокими дозами антагонистов Н2–гистаминовых рецепторов.
И хотя эти рекомендации не потеряли своей актуальности, накапливаются данные о необходимости более раннего назначения противовоспалительной терапии [12]. Кроме того, ацетоминофен оказался не совсем безопасным средством, как сообщалось в ранних работах, a Pincus с соавт. [2] отметили большую эффективность НПВП по сравнению с простыми анальгетиками.
Значительно более высоким отношением польза/риск по сравнению с традиционными НПВП обладают специфические ингибиторы ЦОГ–2. Эти препараты, по–видимому, могут рассматриваться в качестве препаратов «первой линии», в частности, у больных с умеренным и тяжелым болевым синдромом, с и без признаков воспаления, при наличии припухлости сустава и суставного выпота. Больным с недостаточной эффективностью и плохой переносимостью этих препаратов проводить лечение нужно традиционными НПВП с обязательным сочетанием с профилактической терапией, особенно у тех больных, кто имеет факторы риска развития нежелательных явлений. Необходимо учитывать, что большинство больных старше 60 лет имеют, по крайней мере, один фактор риска развития осложнений.
При наличии большого выпота в суставе состояние значительно облегчается внутрисуставным введением стероидов (введение в тазобедренный сустав нежелательно), но не чаще 1–2 раз в год.
Введение гиалуроновой кислоты особенно показано, когда неэффективно лечение анальгетиками и НПВП, также есть противопоказания для их приема.
Весьма перспективными могут оказаться сульфатированные глюкозаминогликаны не только из–за их эффективности и, возможно, структурно–модифицирующего действия, но и за счет их хорошей переносимости, что не требует врачебного мониторинга в отличие от приема НПВП.
Вероятно, время лечения ОА монотерапией уходит в прошлое, а расширение и углубление знаний о патогенезе заболевания, механизмах действия препаратов на разные патогенетические звенья болезни позволяет надеяться, что скоро будут разработаны схемы лечения, новые препараты, которые будут способны изменить естественное течение ОА.
Литература:
1. Bradley ID, Brandt KD, Katz BP et al. Comparison of an antiinflammatory dose of ibuprofen. an analgesic dose of ibuprofen, and acetaminophen in the treatment of patients with osteoarthritis of the knee. N Engi J Med. 1991. 325:87–91.
2. Pincus Т, Callahan LF, Wolfe F et al. Arthrotec compared to acetominophen (ACTA): clinical trial in patients with osteoarthritis (OA) of the hip or knee. Arthritis Rheum 1999. 42–.S404.
3. Towheed ТЕ, Hochberg MC. A systematic review of randomized controlled trials of pharmacological therapy in osteoarthritis of the knee. Semin Arthritis Rheum 1997, 27:755–70.
4. Towheed ТЕ, Hochberg MC. A systematic review of randomized controlled trials of pharmacological therapy in osteoarthritis of the hip. J Rheumatol 1997, 24:349–57.
5. Cryer В. Feldman M. Cyclooxygenase–1 and cyclooxygenase–2 selectivity of widely used nonsteroidal anti–inflammatory drugs. Am J Med 1998, 104:413–21.
6. Simon LS. Mffls JA. Drug therapy: nonsteroidal antiinflammatory drugs. N Engi J Med. 1980, 302:1179–85,1237–43.
7. Schiodt FV, Rjehling FA, Casey DL, Lee WM. Acetominophen toxicity m an urban country hospital. N Engi J Med. 1997, 337:1112–17.
8. Phiffips AC, Simon LS. NSATDs and the elderiy: toxicity and the economic implications. Drugs Aging 1997, 10:119–30.
9. Simon LS, Stand V. Clinical response to nonsteroidal antiinflammatory drugs. Arthritis Rheum 1997, 40:1940–43.
10. Hochberg MC, Altaian RD, Brandt KD et al. Guidelines for medical management of osteoarthritis. L Osteoarthritis of the hip. Arthritis Rheum 1995, 38:1535–40.
11. Hochberg MC, Altman RD, Brandt KD et al. Guidelines for medical management of osteoarthritis. П. Osteoarthritis of the knee. Arthritis Rheum 1995, 38:1541–46.
12. Altman RD, Hochberg MC, Moskowitz RW, Schnitzer TJ. Recommendations for the medical management of osteoarthritis of me Ыр and knee. Arthritis Rheum 2000, 43:1905–15.
13. Wolfe MM, Lichtenstein DR, Singh G. Gasrtointestinal toxicity of me nonsteroidal antiinflammatory drugs. N Engi J Med. 1999, 340:1888–99.
14. Crofford LJ, Lipsky PE, Brooks P et al. Basic biology and clinical application of cyclooxygenase–2. Arthritis Rheum 2000, 43:4–13.
15. Lipsky PE. Abramson SB, Croiford LJ et al. The classification of cyclooxygenase inhibitors. J Rheumatol 1998, 25:2298–2303.
16. Laine L, Haper S, Simon Т et al. A randomized trial comparing the effect ofrofecoxib, a cyclooxygenase–2 specific inhibitor, with that of ibuprofen on gastroduodenal mucosa of patients with osteoarthritis. Gastroenterology 1999, 117:776–83.
17. Hawkey CJ. COX–2 inhibitors. Lancet 1999, 353:307–14.
18. Bensen WG. Flechthner JJ, McMillen Л et al. Treatment of osteoarthritis with celecoxib, a cyclooxygenase–2 specific inhibitor: a randomized controlled trial. Mayo Clin Proc 1999, 74:1095–1105.
19. Reginster J, Bias P, Buchner A. First clinical results oflicofelone (ML3000), an inhibitor of COX–1, COX–2 and %–LOX, for the treatment of osteoarthritis. Ann Rheum Dis 2002. 61 (Suppl):THU0189,pll6.
20. Pelletier IP. The influence of tissue cross–talking on OA progression: role of nonsteroidal antiinflammatoly drugs. Osteoarthritis Cartilage 1999, 7:374–6.
21. Garcia Rodriguerz LA. Nonsteroidal antimflammatory drugs, ulcers and risk: a collaborative meta–analysis. Semin Arthritis Rheum 1997, 26 (suppl):16–20.
22. Simon LS, Hatoum HT, Bittman RM et al. Risk factors for serious nonsteroidal–mduced gastrointestinal complications: regression analysis of the MUCOSA trial. Fam Med 1996. 28:202–208.
23. Wilcox CM, Alexander LN, Cotsonis GA, Clark WS. Nonsteroidal antiinflammatory drugs are associated with both upper and lower gastrointestmal bleeding. Dig Dis Sci 1997, 42:990–97.
24. Schnitzer TJ, Kaniin N, Olson WH. Tramadol allows reduction of naproxen dose among patients with naproxen–responsive osteoarthritis pain: a randomized, double blind, placebo controlled trial. Arthritis Rheum 1999, 42:1370–77.
25. Gallacchi G, Marcolongo R. Pharmacokmetics of diclofenac hydroxyethylpyrrolidine plasters in patients with monolateral knee joint effusion. Drugs Exp Clin Res 1993: 19:95–7.
26. Moore RA, Tramer MR, Carroll D et al. Quantitative systematic review of topically applied non–steroidal anti–inflammatory drugs. BMJ, 1998, 316:333–38.
27. Uebelhart D, Thonar E, Zhang J, Williams J. Protective effect of exogenous 4.6–sulfate in the acute degradation of articular cartilage in the rabbits/ Osteoarthritis Cartilage 1998, 6 (supplement A):6–13.
28. Morreale P, Manopulo R, Galati M et al. Comparison of the anti–inflammatory efficacy of chondroitin–sulfate and diclofenac sodium in patients with knee osteoarthritis. J Rheumatol, 1996.23:1385–91.
29. Uebelhart D, Knussel 0, Theiler R. Efficacy and tolerability of oral chondroitin–sulfate in painful knee osteoarthritis: a double–blind, placebo–controfled, multicentre 6–month trial. Osteoarthritis Cartilage, 1999,7, Suppi A, abstr 144.
30. Алексеева Л.И., Беневоленская Л.И., Насонов Е.Л., Чичасова Н.В., Карякин А.Н.. Структум (хондроитин сульфат) – новое средство для лечения остеозртроза (О А) // Тер. Архив 1999, №5, с. 51–53.
31. Leeb BF, Schweitzer H, Montag K, Smolen JS. A meta–analysis of chondroitmsulfate m the treatment of osteoarthritis. Osteoarthritis Cartilage, 1999, 7, Suppi A. abstr 130.
32. Eugenio–Sarmiento RM, Manapat BHD, Salido EO, The efficacy of chondroitin–sulfate in the treatment of knee osteoarthritis: a meta–analysis. Osteoarthritis Cartilage, 1999, 7, Suppi A, abstr 139.
33. Uebelhart, Thonar E, Delmas P et al. Effects of oral chondroitin sulfate on the progression of knee osteoarthritis: a pilot study. Osteoarthritis Cartilage 1998; 6 (suppl A): 39–46.
34. Michel BA, Bruhlmann P, Stuck! G, Uebelhart D. Chondroprotection through Chondrosutf: the Zurich study. Ann Rheum Dis 2002, 61 (Supp I): 116.
35. Muller–Fasbender H, Bach G, Haase W et al. Glucosamine sulfate compared to ibuprofen m osteoarthritis of the knee. Osteoarthritis Cartilage, 1994,2:61–69.
36. Noack W, Fisher M, Forster KK et al. Glucosamine sulfate in osteoarthritis of the knee. Osteoarthritis Cartilage, 1994,2:51–59.
37. Register J–Y, Deroisy R, Paul I et al. Glucosamine sulfate significantly reduced progression of knee osteoarthritis over 3 years: a large, randomized, placebo–controlled, double–blind, prospective trial. Arthritis Rheum 1999, 42 (suppl):S402.
38. Leffler CN, Phiffipi AF, Lefner SG et al. Glucosamine, chondroitin and magnaese ascorbate for degenerative joint disease of the knee or low back pain: a randomized, double–blind, placebo–controlled pilot study. Mil.Med 1999, 164:85–91.
39. Shanklad WE, The effects of glucosamine and chondroitin sulfate on osteoarthritis of the TMJ: a preliminary report of 50 patients. Cranio 1998, 16:230–235.
40. Balazs EA, Denlinger JL. Viscosupplementation: a new cocept in the treatment of OA. J Rheumatol 1993, Suppl39:3–9.
41. Yasui T, Akatsuka M, Tobetto К et al. The effect ofhyaluronan on interleukin–2 induced prostaglandin–E2 production in human osteoarthritis svnovial cells. Agents Action 1992, 37:155–6.
42. Ghosh P. The role of hyaluronic acid (hyaluronan) m health and disease: interactions with cells, cartilage and components of the synovial fluid. Clin Exp Rheumatol 1994, 12:75–82.
43. Adams ME, Atkinson MH, et al. The role of Viscosupplementation with hylan G–F 20 (Synvisc) in the treatment of osteoarthritis of the knee: a Canadian multicentre trial comparing hylan G–F 20 alone, hylan G–F 20 with non–steroidal anti–inflammatory drugs (NSAIDs) and NSATOs alone. Osteoarthritis Cartilage, 1995, 3:213^225.
44. Lussier AJ, Cividino AA, McFariane CA et al. Viscosupplementanon with hylan for the treatment ofosteoarthritis: findings from clinical practice in Canada. J Rheumatol, 1996, 23:1579–1585.
45. Wobig M, Bach G, Beks P, et al. The role of elastoviscosity in the efficacy of viscosupplementation for osteoarthritis of the knee: a comparison of hylan G–F 20 and a lower– molecular–weight hyaluronan. Clin Ther, 1999 Sep; 21(9): 1549–1562.
Гонартроз коленного сустава: симптомы и стадии. Что с вами происходит?
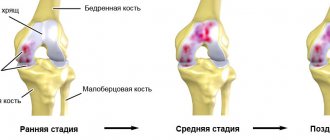
1 стадия гонартроза.
Процесс при артрозе идет незаметно, а дает знать о себе, когда от хряща мало что осталось. Сначала болит несильно и нечасто, особенно если встать утром или долго сидеть, а потом встать и пойти. Это «стартовые боли» — типичный признак 1 стадии гонартроза.
2 стадия гонартроза.
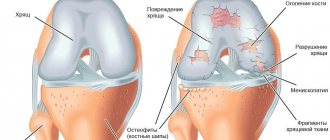
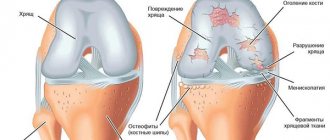
Здесь болит чаще и сильнее. Стоит побыть долго на ногах, или поднять что-то тяжелое – и пара-тройка неприятных часов обеспечены. А еще — утренняя скованность, хруст, боли при спуске по лестнице, и, конечно же, суставы болят «на погоду». Хрящ в суставе разрушается дальше, страдают уже сами кости, их суставные поверхности сплющиваются и выпячиваются, появляются «шипы» — остеофиты. Они травмируют оболочку сустава и вызывают боли.
3 стадия гонартроза.
Суставы деформируются и опухают, а ноги искривляются, принимая О- или Х-образную форму. Сустав часто «заклинивает» — в определенном положении ни согнуть и разогнуть его не получается. Это происходит, когда кусочки хряща отламываются и попадают между костями. Боли становятся сильными, постоянными и нарушают общее самочувствие. Ходить трудно и больно, даже с тростью. Усиливается воспаление — жидкости становится больше, движения ограничены вплоть до контрактуры и полного прекращения движений в суставе, повышается температура и СОЭ.
Почему улучшение с первого курса лечения у нас получают большинство пациентов?
Следим за квалификацией специалистов.
Наши врачи обладают глубокими знаниями в диагностике, неврологии, терапии. Так удается подобрать нужное сочетание процедур, снять лекарственную нагрузку на организм, воздействовать и на симптомы, и на причину заболевания. Средний стаж работы наших врачей — более 20 лет.
Учитываем ваше состояние.
Перед тем как назначить лечение, вас тщательно обследуют. Мы рассматриваем организм как единое целое, и ищем первопричину заболевания. Если вы уже обследовались в других клиниках, захватите результаты с собой. Врач составит персональную схему лечения и реабилитации, чтобы гонартроз больше вас не беспокоил.
Даем правдивую информацию доступным для вас языком.
Врач не старается напугать. Его задача – выяснить, что не так, и подобрать максимально эффективное лечение. Поэтому на консультации он подробно расспрашивает вас о симптомах, лечении и его результате, сопутствующих болезнях, образе жизни и пищевых привычках. Врач понятно объясняет, что будет делать и зачем. А если возникают вопросы, вы всегда можете с ним связаться и задать их.
Возможно, вы все еще сомневаетесь. У вас есть выбор — дождаться, когда нужна операция, терпеть боли и ограничения. Или провести лечение гонартроза безопасными и проверенными методами сейчас. Позвоните 8 (495) 153-52-14 и запишитесь на прием.
Диагностика гонартроза 2 степени
Современная медицина предлагает довольно много методов лечения гонартроза коленного сустава 2 степени и его точной диагностики. Мы знаем, насколько важно поставить верный диагноз. Поэтому для большей эффективности предлагаем действовать комплексно.
Если же диагностирован двухсторонний гонартроз коленного сустава 2 степени, то врач сам определяет, будет лечение проводится параллельно либо поочередно, с перерывом в несколько недель.
Сегодня диагностика гонартроза 2 степени включает в себя несколько этапов.
Осмотр больного у ортопеда
Это основное и очень важное условие. Хороший специалист проведет пальпацию суставов пациента, сделает линейные измерения его костей, а также определит степень подвижности больного сустава под разными углами.
При подозрении на гонартроз врач назначит следующие инструментальные методы диагностики.
Клинические исследования
Это анализы, которые состоят из:
- — анализа на СОЭ;
- — уровеня фибриногена, а также других биохимических данных анализов.
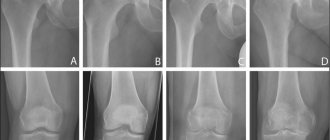
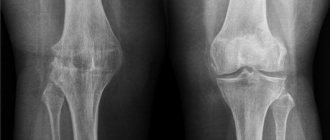
Рентген
Несомненным лидером диагностики в лечении гонартроза коленного сустава 2 степени является рентген. Если сначала этот метод не слишком информативен, то на более позднем этапе — окажется очень эффективным.
В это время на рентгенограмме отображается сужение суставных щелей, разрежение костной ткани, заметное затвердение ткани под хрящом, заметные повреждения костей, окостенение хрящевой ткани, отложение солей.
При этом очень возможно образование остеофитов. Это так называемые костные разрастания, образованные вокруг хряща.
Ультразвук
Ультразвуковое исследование гонартроза 2 степени покажет наиболее точные результаты, но оно точно не сможет заменить рентген.
Поэтому так важно, чтобы у всех больных гонартрозом был на руках рентген-снимок.
МРТ
Магнитно-резонансная томография сегодня является очень передовым методом диагностики. Этот метод позволяет совершенно точно, подробно изучить, оценить степень поражения всех частей сустава, определить изменения, возникшие в хрящевой ткани.
Очевидный плюс МРТ заключается в очень высокой точности метода. Потому что очень часто у пациента гонартроз идет в связке с другими заболеваниями опорно-двигательного аппарата.
Однако и у этого метода есть свой минус — он достаточно дорог.
Анализы на коронавирус
- Тест на коронавирус
- Тест на коронавирус для организаций
- Обследования на коронавирус на дому
- Тестирование на коронавирус на дому за 12 часов!
- Тестирование на коронавирус в Люберцах за 12 часов!
- Тестирование на коронавирус в Некрасовке за 12 часов!
- Тестирование на коронавирус в Королеве за 12 часов!
- Тест на коронавирус на метро Сокол
- Тест на коронавирус на метро Коломенская
- Тест на коронавирус на метро Войковская
- Тест на коронавирус в Некрасовке
- Тест на коронавирус в г. Королев
- Тест на коронавирус в г. Люберцы
- Тест на коронавирус в г. Мытищи
- Тест на коронавирус на дому Мытищи
- Тест на коронавирус на дому Королев
- Тест на коронавирус на дому Люберцы
- Тест на коронавирус на дому Некрасовка
Любые анализы можно сдать в клиниках сети Ист Клиник.