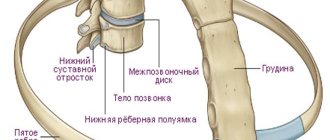
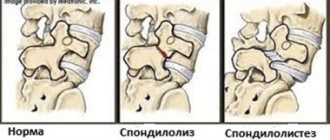
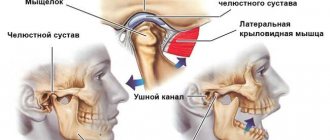
Механизм поражения суставов
Причинами поражения суставов при диабете называют нарушение иннервации и аномально ускоренный кровоток в костной ткани, приводящий к остеопении локального масштаба. Также провоцирующую роль играют рецидивирующие травмы: даже самые незначительные способны запустить процесс остеолиза, разрушающий сустав. Протеингликановый состав костной, а также хрящевой ткани изменяется при дефиците инсулина. Основным механизмом, формирующим патологические нарушения в костях и сосудах, является гликирование белков.
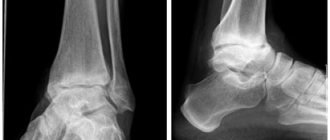
На первой стадии наблюдается отек, умеренная гиперемия. Боль и лихорадка отсутствуют. Рентгенологическое исследование не выявляет деструктивных изменений. Наблюдается остеопороз.
На второй стадии рентген выявляет нарушения в виде:
- умеренного остеопороза эпифизов;
- субхондрального склероза, сопровождающегося появлением краевых остеофитов;
- остеолиза и секвестрации;
- разрастаний соединительной ткани;
- асептических некрозов;
- патологической перестройки тканей кости, ее фрагментации.
Нарушение чувствительности провоцирует растяжение связочного аппарата, от чего сустав расшатывается. На третьей стадии начинается выраженная деформация, вывихи, возможны спонтанные переломы костей. Сустав буквально распадается на части, остается только заменить его на искусственный. Другими способами подвижность не восстановить.
Боль в костях
12978 09 Июня
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Боль в костях: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Боль в костях, или оссалгия, как правило, является симптомом основного заболевания, если не связана с травмой — ушибом или переломом.
Разновидности боли в костях
Боль в костях может возникать остро, в течение короткого промежутка времени, или нарастать постепенно и носить хронический характер.
Субъективно боль в костях подразделяют на ноющую, дергающую, пульсирующую, режущую, тупую.
Боль может носить локальный характер или иррадиировать (отдавать) в другие части тела.
Возможные причины боли в костях
Самая очевидная причина оссалгии — травмы. Как правило, такая боль носит острый характер и усиливается при движении. Ее продолжительность зависит от объема травмы и течения процесса восстановления.
Другая причина – воспалительное поражение кости, которое может быть следствием или травмы, или распространения инфекционного агента с током крови из других очагов в организме. Одним из самых тяжелых заболеваний является остеомиелит, для которого характерно гнойное повреждение костной ткани.
Риск развития болевого синдрома присутствует при недостатке в организме кальция и фосфора. Такое состояние может развиться как и из-за недостаточного поступления этих микроэлементов с пищей, так и в результате патологий паращитовидной и щитовидной желез, поскольку именно они отвечают за регуляцию фосфорно-кальциевого обмена, а также из-за дефицита витамина D.
Отдельного внимания заслуживают наследственные и опухолевые заболевания, поражающие красный костный мозг, который располагается в губчатом веществе костей и костномозговых полостях и содержит стволовые кроветворные клетки.
При нарушении деления стволовых клеток возможно увеличение объема костного мозга, образование специфических продуктов обмена, перестройка структуры кости с развитием болевого синдрома.
Помимо опухолей, развивающихся из кроветворных клеток, существуют новообразования, происходящие из клеток костной ткани (саркомы), а также метастазы злокачественных опухолей других локализаций.
Костная ткань часто становится объектом развития метастатических очагов, поскольку имеет богатое кровоснабжение.
Существует еще одна причина боли в костях – «ростовой скачок» ребенка (так называемая ночная боль роста). Она связана с резким увеличением длины костных структур, когда мышечная ткань не успевает за костной, и проявляется, как правило, в ночное время.
При каких заболеваниях возникает боль в костях
Среди травматических поражений, приводящих к боли в кости, наиболее частыми являются переломы, трещины, ушибы.
Стоит сказать, что боль при вывихах суставов и артритах (воспалении суставов) может иррадиировать и имитировать поражение кости.
Из заболеваний кроветворных органов, а именно костного мозга, упомянем лейкозы (злокачественные опухоли, развивающиеся из предшественников клеток крови), талассемии (наследственное заболевание, характеризующееся нарушением образования гемоглобина – белка, содержащегося в эритроцитах). Несколько особняком стоит опухоль из плазмоцитов (клеток, синтезирующих антитела) — миеломная болезнь, для которой также характерно поражение костей с выраженным болевым синдромом.
Остеомиелиты (воспаление костной ткани) различаются по локализации, возбудителю, бывают острые и хронические. Поздняя диагностика остеомиелита связана с тем, что воспаление развивается и распространяется внутри кости, а не на поверхности. Острые остеомиелиты характеризуются возникновением боли еще тогда, когда внешних признаков воспаления нет.
К злокачественным новообразованиям, происходящим из костной ткани, относится остеосаркома. А к доброкачественным – остеохондрома, остеобластома, остеоид-остеома.
В кости часто метастазирует рак легких, щитовидной железы, молочной железы.
Гиперпаратиреоз, заболевания почек, приводящие к хронической болезни почек, заболевания желудочно-кишечного тракта, нарушающие всасывание кальция, витамина D, приводят к усиленному вымыванию кальция из костей и к развитию остеопороза, характеризующегося развитием болевого синдрома при повышенной нагрузке.
К каким врачам обращаться при возникновении боли в костях
При возникновении болей, особенно острых, необходимо обратиться к травматологу или хирургу. После проведения тщательного всестороннего клинического обследования и дополнительных лабораторно-инструментальных исследований хирург может направить пациента на консультацию к гематологу, , фтизиатру, .
Диагностика и обследования при боли в костях
Как правило, диагностика заболеваний, протекающих с костным болевым синдромом, требует визуализации патологического очага. Для этого проводят рентгенографию костей соответствующей области и прилежащих суставов.
Лечение
Основой терапии при сахарном диабете является постоянный контроль над уровнем сахара. Для этого существуют специальные приборы, позволяющие быстро определить его уровень. Только при условии нормализации сахара можно рассчитывать на результат при лечении суставов, если степень их разрушения еще позволяет проводить консервативную терапию.
Больному необходимо регулярно заниматься гимнастикой, проводить сеансы массажа и самомассажа, а также использовать аппаратную физиотерапию для восстановления чувствительности.
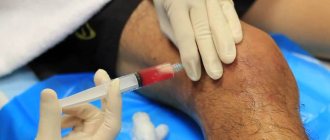
Хондропротекторы при выраженных дегенеративных процессах в суставе не помогут, поэтому их использование в большинстве случаев бессмысленно. Для снятия боли назначаются противовоспалительные и обезболивающие средства, с их помощью спадает отечность и немного улучшается подвижность. Применяются кортикостероидные препараты путем инъекционного введения непосредственно в сустав.
Поражения нижних конечностей у больных сахарным диабетом
О статье
31589
0
Регулярные выпуски «РМЖ» №13 от 15.06.2006 стр. 972
Рубрика: Общие статьи
Авторы: Волковой А.К. , Комелягина Е.Ю. , Анциферов М.Б.
Для цитирования:
Волковой А.К., Комелягина Е.Ю., Анциферов М.Б. Поражения нижних конечностей у больных сахарным диабетом. РМЖ. 2006;13:972.
Сахарный диабет (СД) является одним из наиболее распространенных хронических заболеваний и носит характер неинфекционной эпидемии. В настоящее время около 200 млн. человек в мире страдают СД, при этом количество больных ежегодно увеличивается на 5–7% и каждые 15 лет удваивается. По прогнозам экспертов ВОЗ, их число к 2025 году достигнет 325 млн. человек, а у 410 млн. человек будет определяться нарушенная толерантность к глюкозе (НТГ). СД характеризуется ранней инвалидизацией и высокой смертностью больных вследствие развития поздних сосудистых осложнений. Это обстоятельство ставит СД в ряд социально значимых заболеваний.
Поражения нижних конечностей у больных сахарным диабетом являются одной из основных причин инвалидизации, так как риск выполнения нетравматических ампутаций нижних конечностей у больного СД в 22 раза выше по сравнению с аналогичной вероятностью при отсутствии диабета [1]. Вышеуказанный факт явился одной из основных причин, по которой в Сент–Винсентской декларации (1989 г.) провозглашено снижение в мире к 2000 году на 50% количества высоких ампутаций среди больных сахарным диабетом [2]. К поражениям нижних конечностей у больных сахарным диабетом относятся: диабетическая нейропатия (ДН), поражения магистрального кровотока нижних конечностей (макроангиопатия), синдром диабетической стопы (СДС). Диабетическая нейропатия Диабетическая нейропатия – наличие симптомов и/или объективных признаков нейрональной дисфункции у больного сахарным диабетом, при условии исключения других причин [3]. Распространенность осложнения достаточно высока, в зависимости от различных методов обследования варьирует в пределах 30–50% [4]. А если к числу пациентов, имеющих явные клинические признаки диабетической нейропатии, прибавить пациентов с субклиническими формами, то частота нейропатии может достичь 90% [5]. Существуют различные классификации диабетической полинейропатии, одна из которых приводится ниже. Классификация диабетической полинейропатии [6]: • Гипергликемическая нейропатия • Генерализованные нейропатии: – сенсо–моторная – острая болевая – автономная – острая моторная • Фокальные и мультифокальные нейропатии • Гипогликемичекая нейропатия. В аспекте поражения нижних конечностей в клинической практике чаще всего встречается сенсо–моторная нейропатия, о которой и пойдет речь далее. Ключевая роль в патогенезе диабетической нейропатии принадлежит хронической гипергликемии [7]. Длительно существующий повышенный уровень сахара в крови приводит к активации полиолового пути обмена глюкозы, вызывает оксидативный стресс, снижает образование оксида азота, уменьшает кровоток в нервном волокне, нарушает образование факторов роста. Все вышеуказанные механизмы являются причиной гибели нервной клетки и приводят к замедлению проведения импульса по нервному волокну. Клинические проявления ДН значительно снижают качество жизни больных и являются важнейшим патогенетическим и прогностически значимым фактором риска развития ряда осложнений сахарного диабета, в частности, синдрома диабетической стопы. Клиническая симптоматика ДН может быть положительной (продуктивной), когда пациент предъявляет определенные жалобы, и отрицательной, когда активные жалобы отсутствуют, но уже имеются нарушения чувствительности. В основном выделяют болевые и безболевые варианты поражений [8]. При отсутствии активных жалоб больного диагноз нейропатии можно поставить только на основании результатов осмотра и диагностического исследования. Среди болевых форм нейропатий выделяют острую и хроническую [9]. Продолжительность острой болевой формы составляет 6 месяцев. Появляются колющие, стреляющие, ноющие боли в стопах и голенях; чувство жжения, онемения, стягивания стоп. Интенсивность болевого синдрома может усиливаться в вечернее и ночное время. Для хронической нейропатии характерно наличие болевой симптоматики более полугода. Клиническая картина болевого синдрома разнообразна по интенсивности и частоте. Компенсация СД может приводить к регрессу субъективных симптомов, в то время как ненадлежащий контроль уровня глюкозы в крови, напротив, ухудшает чувствительность и усиливает чувство онемения, жжение, покалывание, парестезии. В таблице 1 приведены основные клинические проявления нейропатии в зависимости от стадии развития патологического процесса [10]. Диагноз ДН устанавливается на основании характерных жалоб, анамнеза (давность симптоматики, наличие сопутствующей патологии), данных объективного осмотра. В клинической практике при помощи специальных инструментов определяются нарушения различных видов чувствительности. Для оценки наличия изменений тактильной чувствительности применяется монофиламент весом 10 г (5,07 Semmens–Weinstein), болевой – укол тыльной поверхности большого пальца специальной иглой с притупленным концом, температурной – при помощи определения разницы в ощущениях тепла и холода инструментом «tip therm», вибрационной – с использованием камертона либо биотезиометра. Ахилловы и коленные рефлексы применяются для оценки нарушений моторной функции. С целью раннего выявления и углубленного исследования ДН выполняется электромиография с определением скорости проведения импульса по нервному волокну. К наиболее точным методам диагностики можно отнести биопсию нерва с последующим морфологическим исследованием. Для дифференциального диагноза с нарушением магистрального кровотока нижних конечностей проводится ультразвуковая допплерография (УЗДГ) артерий голеней и стоп. Лечение диабетической полинейропатии Лечение ДН отличает комплексный подход и во многом зависит от стадии развития патологического процесса. В таблице 2 приведены принципы ведения больных сахарным диабетом с наличием диабетической полинейропатии. Как видно, на начальной стадии лечения обязательным условием является достижение компенсации углеводного обмена. Кроме того, нормализация гликемии часто приводит к устранению нейропатических болей, в то время как лекарственная терапия на фоне декомпенсации углеводного обмена может быть малоэффективной. Назначение средств симптоматической терапии направлено прежде всего на устранение симптомов периферической нейропатии (боли, судороги, жжение, парестезии). Могут назначаться: • трициклические антидепрессанты (имипрамин, амитриптиллин) • противосудорожные препараты (габапентин, карбамазепин) • анальгетики • местно раздражающие средства К препаратам патогенетической направленности относятся: • ингибиторы альдозоредуктазы • g–линоленовая кислота • ингибиторы конечных продуктов гликирования структурных белков • препараты a–липоевой кислоты • факторы роста нерва • миоинозитол В настоящее время из всех вышеуказанных методов патогенетического воздействия, на основании ряда международных плацебо–контролируемых исследований, свою эффективность доказали препараты a–липоевой кислоты. Необходимо отметить, что одной из основных задач ведения больных с диабетической периферической полинейропатией является предупреждение развития язвенных дефектов стоп. В данном аспекте основная роль принадлежит обучению больных правилам ухода за ногами, подбору ортопедической обуви. Диабетическая ангиопатия нижних конечностей Под диабетической ангиопатией нижних конечностей понимают «наличие таких клинических признаков, как отсутствие пульса на артериях стоп, перемежающаяся хромота в анамнезе, наличие болей покоя и/или изменений, выявляемых при неинвазивном сосудистом обследовании, указывающих на нарушение кровообращения» [3]. Снижение кровотока является ведущим фактором, нарушающим процессы репарации тканей и в сочетании с инфекцией – основным фактором ампутаций нижних конечностей [11]. Развитию диабетической макроангиопатии способствуют: курение, артериальная гипертензия, хроническая гипергликемия, гиперлипидемия, возраст, генетическая предрасположенность, длительность СД [12]. К проявлениям макроангиопатии при сахарном диабете относятся: медиакальциноз (склероз Менкеберга) и атеросклероз. Склероз Менкеберга – кальцификация средней оболочки артериальной стенки. Как правило, медиакальциноз в изолированном виде не является причиной ишемии конечности, так как не сопровождается уменьшением просвета сосуда. Есть мнение, что склероз Менкеберга ассоциируется с автономной полинейропатией [13]. Течение атеросклероза при сахарном диабете имеет некоторые отличия по сравнению с атеросклерозом при его отсутствии [14]. Морфологически атеросклеротическое поражение сосудов характеризуется циркулярным расположением бляшек, системностью, склонностью к осложненным поражениям с казеозным распадом, образованием аневризм, а клинически – поражением больных более молодого возраста, одинаковой частотой встречаемости у мужчин и женщин, более быстрым прогрессированием, частым поражением подколенных и берцовых артерий. Клинически ангиопатия нижних конечностей проявляется болями в области голеней при ходьбе – «синдромом перемежающейся хромоты», зябкостью стоп. При осмотре – ослабление или отсутствие пульсации магистральных сосудов нижних конечностей; мраморная окраска кожи, алопеция в области голеней, гипотермия стоп. В запущенных случаях развивается критическая ишемия конечности. Она характеризуется наличием ишемической боли в покое более чем в течение 2–х недель, и/или наличием язв или гангрены в области стопы или пальцев при систолическом давлении в области тибиальных артерий Для выявления снижения магистрального кровотока в артериях нижних конечностей в качестве скрининга проводится пальпаторное определение пульсации на артериях стоп. Ослабление или отсутствие пульсации хотя бы на одной из них является показанием к направлению больного на консультацию к ангиохирургу. Наиболее распространенным неинвазивным методом исследования магистрального русла нижних конечностей является ультразвуковая допплерография (УЗДГ) с вычислением лодыжечно–плечевого индекса (ЛПИ). ЛПИ – отношение систолического артериального давления на тибиальных артериях на уровне средней трети голени к систолическому артериальному давлению на плечевой артерии. В норме ЛПИ больше 0,9, но меньше 1,15. Степень нарушения кровоснабжения нижних конечностей определяется по классификации хронической артериальной недостаточности Покровского – Фонтейна, основанной на клинических проявлениях патологии: I – функциональная: клинических проявлений нет, перемежающаяся хромота возникает при длительной (более 1 км) или быстрой ходьбе. Снижение ЛПИ выявляется при проведении УЗДГ нижних конечностей. IIА – перемежающаяся хромота при ходьбе на 500–200 м. IIБ – перемежающаяся хромота при ходьбе менее чем на 200 м. III – появляется боль в покое. IV – наличие язвенно–некротических поражений нижних конечностей. Однако следует помнить, что у больных с выраженной полинейропатией, сопровождающейся снижением чувствительности, данная классификация не всегда объективно отражает выраженность ишемии. Больной может не ощущать болевого синдрома, что приводит к недооценке тяжести состояния. Также необходимо знать, что определение ЛПИ при наличии медиакальциноза сопровождается ложновысокими показателями ЛПИ (>1,15). К углубленным методам диагностики поражений магистрального кровотока нижних конечностей относится дуплексное сканирование артерий. «Золотым стандартом» исследования сосудистого русла считается ангиография. Показанием к выполнению ангиографии или аорто–артериографии является выявление стеноза или окклюзии по УЗДГ для определения возможности выполнения реконструктивной операции. Для оценки степени выраженности ишемии тканей все более широкое распространение приобретает метод определения транскутанного напряжения кислорода на нижних конечностях. Посредством чрескожного газоанализа удается измерить локальную оксигенацию (ТсрО2) кожи и, таким образом, оценить прогноз заживления раневого дефекта. Критическим показателем считается уровень ТсрО2 Комплексное ведение больных сахарным диабетом с нарушением магистрального кровотока предусматривает решение следующих вопросов [16]: 1) улучшение магистрального кровотока; 2) нормализация углеводного обмена (HbA1c 3) коррекция артериального давления (целевыми параметрами следует считать артериальное давление 4) назначение препаратов, снижающих повышенный тромбогенный потенциал крови (прием ацетилсалициловой кислоты в дозировке 50–325 мг является обязательным); 5) коррекция липидного спектра крови (общий холестерин 1,2 ммоль/л, триглицериды 6) соблюдение режима дозированной ходьбы; 7) отказ от курения. Для решения вопросов по улучшению магистрального кровотока больных сахарным диабетом необходимо вести совместно с ангиохирургом. Наиболее эффективным способом являются реконструктивные хирургические вмешательства на сосудах: шунтирующие операции (аорто–бедренное, бедренно–подколенное, бедренно–тибиальное), чрескожная транслюминальная баллонная ангиопластика (самостоятельная или в сочетании с установкой эндоваскулярного стента). Для улучшения реологических свойств крови назначаются вазоактивные лекарственные препараты. Помимо тромбоцитарных дезагрегантов (ацетилсалициловая кислота), прием которых в настоящее время у данной категории больных считается обязательным, назначаются препараты комплексного воздействия (пентоксифиллин 1200 мг в сутки). В последнее время довольно часто публикуются сообщения о благоприятном эффекте Танакана (EGb 761) по 120 мг/сут. не менее 3 месяцев. Эффективность и безопасность Танакана при облитерирующем атеросклерозе нижних конечностей была доказана в ряде международных двойных слепых плацебо–контролируемых исследований, где зафиксировано достоверное увеличение дистанции ходьбы до появления боли [17–19]. Благоприятный вазоактивный эффект Танакана был объективизирован с помощью ультразвуковой допплерографии нижних конечностей [20]. Нельзя забывать, что бесконтрольное применение вазоактивных препаратов может привести к прогрессированию ретинопатии (кровоизлиянию в стекловидное тело и сетчатку). Поэтому на всем протяжении назначения вазоактивных препаратов необходимо динамическое наблюдение окулиста. При этом следует отметить, что благодаря наличию в механизме действия Танакана гемореологического, метаболического, нейропротективного и антиоксидантного эффектов препарат оказывает защитное действие на сетчатку глаза. Безопасность и эффективность Танакана при лечении больных с диабетической ретинопатией была также подтверждена как иностранными, так и российскими специалистами в ходе экспериментальных и клинических исследований [21]. Отсутствие противопоказаний, межлекарственного взаимодействия и выявленный в данных исследованиях благоприятный профиль побочных эффектов Танакана позволяет рекомендовать его более широкое назначение у пожилых пациентов с сахарным диабетом при сочетании у них полинейропатии, ангиопатии и ретинопатии. Диабетическая стопа Диабетическая стопа (синдром диабетической стопы – СДС) – инфекция, язва и/или деструкция глубоких тканей, связанная с неврологическими нарушениями и/или снижением магистрального кровотока в артериях нижних конечностей различной степени тяжести [11]. К проявлениям СДС относится «безболевая прогрессирующая деструкция одного или нескольких суставов стопы на фоне нейропатии – диабетическая остеоартропатия (стопа Шарко) [22]». СДС – одно из ведущих инвалидизирующих хронических осложнений сахарного диабета. От 40 до 60% (в ряде регионов до 90%) всех нетравматических ампутаций проводится у больных сахарным диабетом. В 85% случаев всем ампутациям, связанным с сахарным диабетом, предшествуют инфицированные язвенные дефекты стоп, распространенность которых составляет 4–10% среди больных сахарным диабетом старше 50 лет. В большинстве случаев ампутации производятся из–за сочетания инфекции глубоких тканей и ишемии: в 50–70% случаев причиной ампутаций является гангрена, в 20–50% – инфекция. Необходимо различать факторы риска развития синдрома диабетической стопы и факторы риска ампутации. Как правило, язвенный дефект возникает в результате сочетанного взаимодействия нескольких факторов риска. Факторы риска развития синдрома диабетической стопы, по мнению ведущих специалистов, можно представить следующим образом: периферическая нейропатия; патология периферических сосудов; предшествующие язвы и/или ампутации; деформации стоп; плохо подобранная обувь; травма; социально–экономические факторы; расовая принадлежность [23,24]. К факторам риска ампутации относятся: инфицированные язвенные дефекты стоп; инфицированные язвенные дефекты стоп в сочетании с ишемией. В настоящее время нет единой классификации, учитывающей все особенности этиопатогенеза синдрома диабетической стопы. Предложены следующие классификации, учитывающие различные факторы в формировании данного осложнения, такие как: 1) форма поражения. В зависимости от преобладания периферической нейропатии либо макроангиопатии различают: – нейропатическую, – ишемическую (в изолированном виде встречается крайне редко), – нейро–ишемическую формы синдрома диабетической стопы [11]. 2) глубина распространения язвенного дефекта (классификация Wagner) [25]. В зависимости от глубины поражения язвенному дефекту присваивается степень от 0 до V: ст. 0 – интактная неповрежденная кожа ст. I – поверхностная язва (процесс захватывает эпидермис, дерму) ст. II – процесс захватывает кожу, подкожную клетчатку, мягкие ткани ст. III – глубокая язва, абсцесс, остеомиелит, септический артрит ст. IV – сухая/влажная гангрена: некроз всех слоев кожи отдельных участков стопы ст. V – сухая/влажная гангрена части стопы/всей стопы 3) тяжесть инфекционного процесса: • Не угрожающая конечности инфекция, характеризующаяся наличием признаков воспаления. Отек мягких тканей, гиперемия и гипертермия распространяются менее чем на 2 см. Как правило, это поверхностно расположенные язвенные дефекты, не требующие госпитализации. • Угрожающая конечности инфекция. Отек мягких тканей, гиперемия, гипертермия распространяются более чем на 2 см, захватывая глубоко лежащие структуры (подкожно жировую клетчатку, фасции, суставы, кости) с наличием некротического и гнойного отделяемого (плантарный абсцесс, септический артрит, флегмона стопы, остеомиелит). В данном случае для проведения соответствующих лечебных мероприятий требуется госпитализация. Основное проявление СДС – это трофические язвы или другие гнойно–деструктивные поражения стопы. Следует отметить, что язвенные дефекты голени, развивающиеся на фоне хронической венозной недостаточности, не относятся к определению СДС. В таблице 3 приведена дифференциальная диагностика нейропатических и нейроишемических язв при СДС. Основные принципы лечения язвенных дефектов при СДС у больных СД Стратегия комплексного лечения нейропатической инфицированной язвы состоит из следующих основных положений: 1) хирургическая обработка гнойного очага (объем вмешательства определяется степенью тяжести имеющегося инфекционного процесса); 2) назначение системной рациональной антибактериальной терапии; 3) местное лечение раны с использованием многокомпонентных мазей на гиперосмолярной основе, антисептиков и перевязочных средств, способствующих очищению раны; 4) выполнение режима разгрузки (разгрузочный каблук, использование при ходьбе костылей/ кресла– коляски и т.д.); 5) пластические и реконструктивные органосохраняющие операции. При нейроишемическом варианте поражения принципы лечебных мероприятий следующие: 1) коррекция артериального кровотока в нижних конечностях (хирургическая и консервативная); 2) хирургическая обработка гнойно–некротического очага (объем вмешательства определяется степенью тяжести имеющегося инфекционного процесса и компенсации артериального кровотока); 3) назначение системной рациональной антибактериальной терапии; 4) местное лечение раны с использованием растворов иодофоров, антисептиков и перевязочных средств, способствующих очищению раны; 5) при необходимости выполнение режима разгрузки (разгрузочный каблук, использование при ходьбе костылей/кресла–коляски и т.д.); 6) пластические и реконструктивные органосохраняющие операции. В связи с тем, что при сахарном диабете столь высок риск развития гангрены стопы и, как следствие, ампутации конечности, каждый пациент должен быть знаком с комплексом профилактических мероприятий, позволяющих в достаточной степени снизить этот риск. Больным нельзя: подстригать ногти на ногах ножницами или пользоваться кусачками; пользоваться мозольными пластырями; ходить босиком; носить туфли на высоком каблуке и с узким носом; носить «шлепки»; обогревать ноги рядом с источником тепла (рядом с камином или на батарее). В то же время больным необходимо: регулярно подпиливать ногти пилочкой; каждый день мыть ноги в теплой воде, тщательно вытирая после мытья межпальцевые промежутки; покупать новую обувь во второй половине дня, когда ноги уже чуть отекли; носить только хлопковые носки (согревать ноги в носках из шерсти); носить только удобную обувь на низком каблуке; с любой ранкой на ногах тут же обращаться в кабинет диабетической стопы. Соблюдение этих несложных правил позволит значительно снизить вероятность ампутации конечности. Литература 1. Trautner C., Haastert B., et al. Amputations and diabetes: a case–control study // Diabet Med. – 2002. – Vol. 19. – P. 35–40. 2. Diabetes care and research in Europe: the St.Vinsent Declaration. Geneva: World Health Organization. ICP/CLR 034// – 1989. 3. Международное Соглашение по Диабетической стопе, 2000. 4. Kempler P. Neuropathies–Springer–Budapest–2002; Dyck P.J., Litchy W.J. The Rochester Diabetic Neuropathy Study of Health Subjects. // Neurology, 1995, 45: 1115–1121. 5. Vinik A.I., Liuzze F.I., ets. Diabetes neuropathy. Diabetes Care, 1992, 15: 1926–1975. 6. Thomas P.K. “Nextbook of Diabetic Neuropathy”, 2002. 7. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of Diabetes on the development and progression of long–term complication in insulin–dependent diabetes mellitus N.Engl. J.Med. 1993;70: 1009–1018. 8. International Guidelines on the Out–patient Management of Diabetic Peripheral neuropathy. Abingdon: The Medicine Group (Education) Ltd., 1998. 9. Kempler P. Neuropathies. Springer. Budapest. 2002. 10. Boulton A.J.M. “Nextbook of Diabetic Neuropathy”, 2002. 11. Международное соглашение по диабетичекой стопе.– М., 1999. 12. Дедов И.И., Анциферов М.Б. и соавторы. Синдром диабетической стопы. – М., 1998. 13. Young M. et al., Medial arterial calcification in the feet of diabetic patients and matched non–diabetic control subjects // Diabetologia. – 1993. –Vol.36. – P. 615–621. 14. Jude E., et al., Peripheral arterial disease in diabetic and nondiabetic patients// Diabetes Care. – 2001. – Vol. 24. – P. 1433–1437. 15. Luther M. Critical limb ischemia in diabetes // VASA. – 2001. – Suppl. 58. – P. 21–27. 16. ADA: Clinical Practice Recommendations 2004 // Diabetes Care 2004; 27: S19–S75. 17. Bauer U. Etude clinicue d I/ EGb 761 dans 1’artertedes members inferieurs. Essai a duble insu face au placebosur 6 mois. //Arzneim Forsh Drug Res. –1984. –V.34. –N.6. –P.716–720. 18. Кошкин В.М. Консервативная терапия хронических облитерирующих заболеваний артерий конечностей.// Русский медцинский журнал. –1997. –Т.6. – № 13. –С.820. 19. Покровский А.В., Чупин А.В., Грязнов О.Г. Клиническое испытание препарата Танакан у пацентов с атеросклеротическим поражением артерий нижних конечностей. // Международный симпозиум “Консевативная терапия в ангилогии. Опыт применения препаратов Танакан и Гингко форт”. – М. –1997. – Тезисы докладов. – С.37. 20. Алиев М.А., Джакупов В.А., Секербаев О.А. Консервативное лечение диабетических ангиопатий. // В сб.: Хирургическое лечение диабетических ангиопатий. – Алматы. –1998. –С.29–32. 21. Мошетова Л.К., Аржиматова Г.Ш., Строков И.А., Яровая Г.А. «Современная антиоксидантная терапия диабетической ретинопатии». Русский медицинский журнал, 2006, т. 7, № 1, 26–38. 22. Frykberg R.G. “Charcot Foot: an Update on Pathogenesis and Management” in the Foot in Diabetes, 2000, p.236. 23. Peter – Riesch B et al.: Pivotal events: a neglected field of factors leading to major diabetic foot complications. // Diabetologia. 1996; 39, Suppl. 1, A.265. 24. Veves A., et all: Comparison of risk factors for foot problems in diabetic pations attending teaching hospital outpatient clinics in four different European states. // Diabetic Medicine. 1994; 11:709–711. 25. Wagner F. M. A classification and treatment program for diabetic, neuropatic and dysvascular foot problems. In the American Acaemy of Ortopaedic Surgeons instructional course lectures. – St. Louis: Mosby, 1979. – P. 143–165.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Хирургическое лечение
Хирургическое вмешательство при сахарном диабете возможно только при нормализации уровня сахара. Если диабет скомпенсирован и противопоказаний со стороны сердечно-сосудистой системы и внутренних органов не выявлено, то можно проводить замену сустава. Заключение дает эндокринолог по результатам обследования. При нормализации уровня сахара все процессы заживления у больных диабетом происходят также, как и у здоровых людей, но контроль очень важен не только перед операцией, но и сразу же после нее.
Есть риск отторжения, если у пациента преклонный возраст, заболевание продолжается более 10 лет. Однако современные технологии позволяют свести его к минимуму. Эндопротезирование производится при помощи фиксации на цемент, в котором содержится антибиотик (например, цифуроксим). Частота осложнений при введении данного метода существенно сократилась.
Существенно осложняет процедуру эндопротезирования лишний вес, который часто превышает все нормы при сахарном диабете. Это может стать противопоказанием к операции, поскольку не только затрудняется доступ к суставу, УЗИ-навигация и последующее закрытие тканей, но и ухудшается приживаемость из-за высокой нагрузки. Часты случаи развития ранних инфекций и смещения эндопротеза, велика вероятность, что произойдет перипротезный перелом, повредятся связки сустава, может развиться тромбоз конечности, тромбоэмболия, асептическая нестабильность, вывих головки имплантата.
Успех операции по замене сустава тучному человеку с диагнозом «сахарный диабет» во многом зависит от опыта врача, наличия необходимого оборудования для точной установки эндопротеза, правильного подбора имплантата. Важно проведение грамотной предоперационной профилактики тромбообразования и инфицирования.
В России есть клиники, в которых возможно обеспечить все необходимые условия для максимально успешного эндопротезирования таких больных, но попасть туда зачастую сложно. Единственной возможностью заменить сустав с минимальным риском осложнений является поездка в Германию или Израиль. Но многих останавливает высокая стоимость. предлагает организовать лечение опорно-двигательного аппарата для пациентов из РФ в специализированных клиниках Чехии, где цены существенно ниже, а качество на высоком европейском уровне.
Остеоартроз (ОА) и сахарный диабет 2-го типа (СД2) являются одними из наиболее часто встречаемых заболеваний среди лиц пожилого и старческого возрастов, поэтому и сочетание этих болезней широко распространено среди лиц данной категории [1, 5]. СД вносит в клиническую картину ОА бо`льшую выраженность дегенерации хрящевой ткани, отчетливый периартикулярный воспалительный процесс и снижение работоспособности мышц бедра, что связано, в основном, с развитием поздних диабетических осложнений (макро- и микроангиопатия, сенсомоторная нейропатия) [1, 3, 4, 6, 8—10, 12]. Однако в ряде работ выявлено, что хроническая гипергликемия препятствует развитию вторичных воспалительных реакций в полости сустава, что может проявляться менее выраженным болевым синдромом и ограничением амплитуды движения в коленном суставе у пациентов с СД2 в сравнении с лицами, страдающими гонартрозом без нарушений углеводного обмена [2—4]. Противоречивы данные литературы о частоте и выраженности суставного синдрома в зависимости от длительности и степени компенсации СД2. Ряд авторов отмечают наличие более глубоких костно-суставных нарушений у пациентов с длительным, плохо контролируемым СД. В то же время другие исследователи считают, что выраженный суставной синдром нередко встречается среди лиц с легким течением СД2 [3, 13]. Целью настоящей работы явилось изучение клинико-метаболических аспектов влияния СД2 на течение гонартроза.
Материал и методы
Проведено комплексное обследование 90 человек в возрасте от 40 до 70 лет. В 1-ю (основную) группу включили 45 пациентов с гонартрозом в сочетании с СД2. Во 2-ю (контрольную) группу вошли 45 больных гонартрозом без сопутствующего СД2. В обеих группах среди больных преобладали женщины (90%). Критериями включения пациентов в группы было наличие гонартроза (по критериям R. Altman [7]) и интенсивность боли при ходьбе не менее 40 мм по визуальной аналоговой шкале (ВАШ). Из исследования исключали пациентов с СД 1-го типа и другими специфическими типами диабета, онкологическими заболеваниями, лиц с наличием ОА IV рентгенологической стадии.
Исследование суставов включало осмотр, пальпацию, измерение окружности коленных суставов, объективную оценку боли в покое и при ходьбе по ВАШ, проведение гониометрии коленных суставов. Симптомы гонартроза оценивали также по выраженности болевого и функционального показателя Лекена в соответствии со специализированным вопросником [11]. Проводили рентгенографию коленных суставов, стадии гонартроза устанавливали в соответствии с классификацией I. Kellgren и J. Lawrens (1957 г.). Диагноз СД2 устанавливали в соответствии с диагностическими критериями, предложенными Комитетом экспертов ВОЗ (1999 г.). Степень компенсации СД оценивали по уровню гликированного гемоглобина (HbA1c).
Статистическая обработка выполнена с помощью пакетов программ Statistica 6.0 («StatSoft Inc.», USA). Абсолютные величины представлены в виде медианы и квартилей. При проведении множественных сравнений для оценки значимости различий средних величин использовали ранговый анализ вариаций Краскела—Уоллиса; парные сравнения проводили с помощью непараметрического теста Манна—Уитни. Для оценки значимости различия долей применяли критерий хи-квадрат Пирсона. Различия считали достоверными при уровне значимости р<0,05.
Результаты и обсуждение
Клиническая характеристика сравниваемых групп представлена в табл. 1.
Следует подчеркнуть, что основная и контрольная группы были сравнимы по возрасту, половому составу, длительности и стадии гонартроза, основным морфометрическим показателям, в том числе по индексу массы тела (ИМТ).
К особенностям суставного синдрома при сочетанной патологии можно отнести бо`льшую выраженность боли при движении (табл. 2).
Функциональный тест Лекена подтвердил бо`льшую тяжесть гонартроза по сумме баллов в 1-й группе пациентов. Окружность коленных суставов отчетливо превалировала в группе пациентов с сочетанной патологией. При проведении гониометрии выявлено уменьшение угла сгибания и угла разгибания максимально пораженного сустава в 1-й группе больных, что также указывало на нарушение функции сустава.
Тест Лекена был проанализирован по частоте встречаемости каждого признака в группах больных. Согласно этому тесту 27% больных 1-й группы и 9% больных 2-й группы испытывали ночную боль в покое (p=0,01). Для больных 1-й группы характерным явилось усиление боли в коленных суставах после стояния на протяжении 30 мин; 65% пациентов 1-й группы указывали на этот признак по сравнению с 31% больных 2-й группы (p=0,001). Анализ расстояния, максимально преодолеваемого без боли, показал, что только 11% больных группы сочетанной патологии могут проходить без боли дистанцию 1 км и более. В контрольной группе данный показатель составил 51% (р=0,02). Появление болевого синдрома при ходьбе на расстояние менее 300 м достоверно чаще зарегистрировано среди пациентов 1-й группы — 28%, против 11% больных контрольной группы (р=0,01). Данные свидетельствуют об утяжелении суставного синдрома на фоне СД2 (усиление болей и более выраженное ограничение функции сустава).
Для оценки влияния длительности СД2 на течение гонартроза пациентов с сочетанной патологией разделили на 3 подгруппы и сравнили все характеристики гонартроза (табл. 3).
Нарушение функции суставов, оцениваемое по индексу Лекена и уменьшению угла сгибания коленных суставов, гонартроз преимущественно III рентгенологической стадии статистически значимо чаще определялись у больных с длительностью СД2 более 10 лет. Вторичный синовит чаще встречался у больных ОА в сочетании с СД2 продолжительностью менее 5 лет. Пациенты данной подгруппы достоверно чаще предъявляли жалобы на ночные и стартовые боли. Это свидетельствует о преобладании воспалительного компонента в данной группе пациентов.
Кроме длительности СД2 значительное влияние на течение суставного синдрома оказывала степень компенсации СД2 (табл. 4).
Нарастание интенсивности боли по ВАШ, нарушения функции сустава по индексу Лекена, III рентгенологическая стадия гонартроза, наличие утренней скованности и вторичного синовита, жалобы на ночные и стартовые боли чаще определялись при выраженной декомпенсации СД2, характеризующейся уровнем HbA1c>10%.
Выводы
1. СД2 отягощает течение ОА у больных с сочетанной патологией. Наличие СД2 у больного гонартрозом приводит к усилению болевого синдрома, ухудшению функции суставов, большей частоте вторичного синовита.
2. Выраженная декомпенсация углеводного обмена (HbA1c>10%) ассоциирована с усилением болевого синдрома (более 80 мм по ВАШ), более выраженными функциональными нарушениями и воспалительными изменениями суставов у больных гонартрозом в сочетании с СД2.