- Частота возникновения саркомы Юинга
- Факторы риска развития саркомы Юинга
- Диагностика саркомы Юинга
- Определение стадии (распространенности) саркомы Юинга
- Лечение саркомы Юинга
- После окончания лечения
Саркома Юинга занимает второе место по частоте среди злокачественных опухолей костей у детей (после остеогенной саркомы) была впервые описана Д. Юингом в 1921 году и получила название по имени автора.
Эта опухоль редко встречается у детей младше 5 лет и у взрослых старше 30 лет. Наиболее часто эта опухоль возникает у подростков в возрасте от10 до 15 лет. Встречаются случаи внекостной саркомы Юинга с поражением мягких тканей.
Другая опухоль детского возраста — примитивная нейроэктодермальная опухоль (ПНЕТ) имеет много общих черт с костной и внекостной саркомой Юинга, которая может первично поражать как кости, так и мягкие ткани. Все эти опухоли развиваются из одного и того же типа клеток.
Костная саркома Юинга составляет 87%, внекостная саркома Юинга — 8% и ПНЕТ -5%.
Обычно такие опухоли развиваются в центральной части длинных трубчатых костей верхних и нижних конечностей, однако могут выявляться также в тазовых костях и в костях и мягких тканях, образующих грудную клетку.
Частота возникновения саркомы Юинга
Среди злокачественных опухолей у детей саркома Юинга составляет 1,8% и является второй по частоте среди злокачественных опухолей костей у детей (10-15%).
Ежегодно в США эта опухоль выявляется у 150 детей и подростков. Чаще заболеванию подвержены лица мужского пола.
Существует некоторая связь между возникновением саркомы Юинга и наличием аномалий костей скелета и мочеполовой системы.
В 30% случаев в момент диагностики уже имеется метастатическое поражение легких и костей.
Описание паллиативной «химии»
Фундаментальным принципом данной терапии является не полное устранение патологии, а лишь уменьшение опухолевых габаритов. Таким образом, удается понизить выраженность осложнений и продлить жизнь онкобольного. Паллиативные химиотерапевтические процедуры прописывают людям, которые страдают от неизлечимых разновидностей сарком. Лечебный процесс затормаживает прогрессирование онкопатологии и способствует увеличению длительности жизни. Срок увеличения может быть разным: от 3-4 месяцев до нескольких лет. Многое зависит от применяемой терапии, которая может быть и экспериментальной (см. соответствующий раздел).
Факторы риска развития саркомы юинга
В настоящее время известно несколько факторов риска, связанных с возникновением саркомы Юинга.
Пол. Саркома Юинга несколько чаще встречается среди мальчиков по сравнению с девочками.
Возраст. В 64% случаев саркома Юинга встречается в возрасте от 10 до 20 лет.
Раса. Наиболее часто саркома Юинга наблюдается у белого населения.
Профилактика саркомы Юинга, как и большинства других опухолей детского возраста, в настоящее время невозможна, так как образ жизни детей и их родителей не влияет на частоту возникновения данной опухоли.
Профилактика рака костей
Каких-либо методов специфической профилактики неоплазмы кости не существует. В качестве общих мер можно рекомендовать:
- Отказаться от табакокурения и злоупотребления алкоголесодержащими напитками.
- Вести физически активный образ жизни.
- Поддерживать иммунитет: прием растительных препаратов, стимулирующих иммунитет, закаливающие водные процедуры, регулярный прием таблеток витаминно-минерального комплекса.
- Придерживаться рационального питания.
- Регулярно проходить профилактические медосмотры.
Однако, следует учитывать, что здоровый образ жизни не является гарантией снижения риска развития каких-либо видов злокачественных заболеваний. Поэтому, если возникло подозрение на рак костей, симптомы даже незначительного характера вас должны насторожить. Обращение за специализированной профессиональной медицинской помощью позволяет рано начать терапию и повысить эффективность лечебных мероприятий.
Диагностика саркомы юинга
Признаки и симптомы саркомы юинга
Наиболее частым симптомом саркомы Юинга является боль, которая встречается у 85% детей с поражением кости. Боль может быть вызвана как распространением процесса на надкостницу, так и переломом пораженной кости.
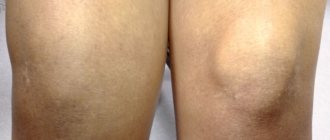
У 60% больных с костной саркомой Юинга и почти у всех пациентов с внекостной опухолью появляется припухлость или уплотнение. В 30% случаев опухоль бывает мягкой и теплой на ощупь. У больных имеется повышенная температура тела.
Данные признаки и симптомы могут наблюдаться также при ушибах и воспалении костной ткани, однако они проходят после лечения антибиотиками.
При распространенной (метастатической) саркоме Юинга больные могут жаловаться на повышенную утомляемость и похудание. В редких случаях, например, при поражении позвоночника возможна резкая слабость в нижних конечностях и даже паралич.
Анализ периферической крови. Выявление опухолевых клеток в крови больного указывает на поражение костного мозга при саркоме Юинга.
Биохимический анализ крови. Повышение уровня ЛДГ (лактатдегидрогеназы) дает право заподозрить метастатический процесс у больного саркомой Юинга.
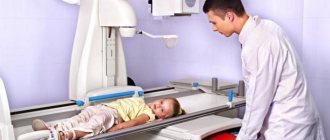
Рентгенологическое исследование костей позволяет с определенной уверенностью диагностировать саркому Юинга.
Рентгенологическое исследование грудной клетки дает возможность обнаружить метастазы саркомы Юинга в легких.
Компьютерная томография (КТ) (иногда с дополнительным контрастированием) костей грудной и брюшной полости позволяет уточнить локализацию и размер опухоли, выявить наличие метастазов в легких, лимфатических узлах и печени.
Магнитно-резонансная томография (МРТ) дает дополнительную информацию относительно состояния костного мозга, мышц и соединительной ткани вокруг пораженных костей и помогает определить степень распространения опухоли.
Радионуклидное сканирование (сцинтиграфия) с помощью технеция-99 выявляет поражение других костей и мягких тканей.
Пункция и биопсия костного мозга необходимы для выявления его поражения при саркоме Юинга.
Биопсия опухоли (взятие кусочка опухоли для исследования) является окончательным и обязательным методом для уточнения диагноза саркомы Юинга
Устранение патологии и возможные прогнозы
Стопроцентное избавление от данного заболевания возможно лишь при условии извлечения онкоочага. Такое возможно при маленьких габаритах опухоли и при отсутствии повреждений жизненно важных органов. Кроме того, полностью излечиться можно и при единичных метастазах внутри легочных, костных и печеночных тканей. По сути, наиболее положительный исход возможен только на ранних этапах онкопроцесса.
При запущенности рака, даже после принятия терапевтических мер, показатели выживаемости составляют лишь 20% (причем это максимум). Вероятны частые рецидивирующие проявления.
Определение стадии (распространенности) саркомы юинга
Уточнение стадии саркомы Юинга важно как для определения прогноза (исхода) заболевания, так и для планирования лечения. При саркоме Юинга выделяют две стадии заболевания — локализованную и метастатическую.
При локализованной стадии опухоль ограничена тканью, из которой она возникла, но может также распространяться на окружающие мышцы и сухожилия.
Отсутствие видимых метастазов не исключает наличие мелких очагов (микрометастазов) опухоли, которые можно обнаружить только при микроскопическом исследовании.
Метастатическая стадия означает распространение опухоли в легкие, кости, костный мозг, лимфатические узлы, печень.
Симптоматика
Прежде всего, больного мучают ноющие, нарастающие боли. Удерживание конечности в одном положении не спасает от болевого дискомфорта. Имеет место припухлость пострадавшей области. Данная припухлость стремительно покрывает всю пострадавшую конечность; в патологический процесс могут вовлекаться суставы. Частенько пораженная область имеет более высокие температурные показатели.
Может присутствовать нарушение двигательной функциональности руки или ноги (это зависит от местонахождения). Также, имеют место общие признаки: слабость, снижение массы. Иногда больной страдает от неконтролируемого мочеиспускания. Возможен паралич рук и ног (если раковый очаг находится на позвоночнике).
Помимо этого, могут увеличиваться габариты лимфатических узлов. Нервные волокна могут утрачивать изначальную чувствительность. Также, может иметь место кровохарканье, трудности при дыхании, атипичная походка.
Лечение саркомы юинга
ОПЕРАЦИЯ
Выбор типа операции зависит от локализации опухоли и влияния операции на функцию пораженной части тела.
Во многих случаях пораженная кость или мягкие ткани могут быть полностью удалены хирургическим путем без нарушения функции органа. В других случаях сохранение функции органа после полного удаления опухолевой ткани невозможно.
Если много лет тому назад саркому Юинга верхних и нижних конечностей лечили с помощью ампутации, то в настоящее время чаще всего выполняются сохранные операции. При этом удаленные кости и суставы замещаются трансплантатами или протезами. Сохранные операции проводятся даже больным с поражением тазовых костей.
У больных саркомой Юинга с поражением жизненно важных нервов и сосудов вместо операции может быть применена лучевая терапия.
В случае локализации саркомы Юинга на грудной клетке выполняется удаление опухоли вместе с несколькими ребрами, которые замещаются синтетическим материалом.
Метастатические узлы в легких удаляются во время операции торакотомии. После операции таким больным проводится лучевая терапия на легочную ткань.
Из непосредственных и отдаленных последствий оперативного лечения саркомы Юинга следует отметить плохое заживление ран и инфекционные осложнения. Это объясняется ранее примененной химиотерапией и облучением. После операции многие больные саркомой Юинга нуждаются в восстановительном лечении.
Химиотерапия больным саркомой Юинга проводится с помощью противоопухолевых препаратов, вводимых, как правило, внутривенно и редко внутрь. Этот метод лечения применяется всем больным, независимо от стадии болезни.
Это объясняется тем, что даже у больных с локализованным процессом могут быть микрометастазы, выявляемые только с помощью микроскопического исследования. Поэтому отказ от химиотерапии у больных с локализованной стадией в конце концов приведет к росту этих микрометастазов.
Для химиотерапии саркомы Юинга применяются различные комбинации (сочетания) противоопухолевых препаратов, которые назначаются каждые 3-4 недели.
Сначала применяется комбинация таких препаратов, как винкристин, адриамицин (доксорубицин) и циклофосфан. После того, как проходят побочные эффекты химиотерапии, назначают вторую комбинацию, включающую ифосфамид и этопозид. Такие циклы химиотерапии повторяют 4-5 раз.
Химиотерапия может сопровождаться различными побочными эффектами в виде тошноты, рвоты, потери аппетита, облысения, поражения слизистой оболочки полости рта и мочевого пузыря, повышения восприимчивости к инфекции, нарушения менструального цикла, бесплодия, повреждения сердечной мышцы.
Самым серьезным, хотя и редким, осложнением химиотерапии может быть возникновение второй злокачественной опухоли, в частности, острого миелоидного лейкоза.
ЛУЧЕВАЯ ТЕРАПИЯ
У больных саркомой Юинга применяется наружное облучение источниками высоких энергий. Эта опухоль является высоко чувствительной к облучению, и большинство больных можно излечить комбинацией химиотерапии и облучения.
Суммарная доза лучевой терапии на очаг обычно составляет 45-55 грей. По показаниям проводится облучение легких, однако дозы лучевой терапии при этом снижаются.
К серьезному осложнению лучевой терапии относится нарушение роста костей. При этом, чем моложе ребенок, тем более выражены побочные эффекты и осложнения. Лучевая терапия может вызвать укорочение конечности, деформацию лица и пр.
При облучении области таза возможно поражение мочевого пузыря и толстой кишки. Лучевая терапия на область сустава может вызвать ограничение его функции за счет образования рубцов.
Побочные явления и осложнения лучевой терапии при воздействии на спинной и головной мозг проявляются через 1-2 года и заключаются в головной боли и ухудшении умственной деятельности.
Высокие дозы лучевой терапии (свыше 60 грей) в 20% случаев приводят к развитию второй злокачественной опухоли.
Трансплантация костного мозга и периферических стволовых клеток
В последнее время больным с плохим прогнозом, в частности с метастазами в кости и костный мозг, имеющим выживаемость менее 10%, применяется более интенсивное лечение — химиотерапия высокими дозами препаратов с облучением тела и трансплантацией костного мозга или периферических стволовых клеток. Такой подход позволяет излечить более 30% больных с метастатическим процессом.
Методы паллиативной хирургии
Сотрудники отделения интервенционной онкологии осуществляют паллиативные хирургические вмешательства.
1. Имплантируют венозные и артериальные порт-системы, которые призваны вводить химиосредства. Данные системы рекомендованы онкобольным, которым придется очень долго получать химиотерапевтические медикаменты. Главными превосходствами такого подхода считаются: наличие быстрого и беспроблемного доступа к венам (это особенно важно при получении кровяной массы или вводе лекарств), понижение вероятности формирования флебитов, обеспечение многократного внедрения химиолекарств, обеспечение психологического комфорта для людей, которые панически боятся иголок, возможность продолжительного применения системы, полное отсутствие какого-либо дискомфорта.
2. Осуществляют накладывание нефростом, благодаря которым моча отводится из почек. Частенько мероприятие делается путем открытого оперирования. Однако самой популярной по сей день считается чрескожная пункционная нефростомия, при которой используется рентгеновский или же ультразвуковой контроль.
3. Делают процедуры, касающиеся дренирования либо же стентирования протоков желчи.
4. Монтируют кава-фильтры, дабы предотвратить тромбоэмболию артерии легкого.
Список литературы:
- Juergens C, Weston C, Lewis I, Whelan J, Paulussen M, Oberlin O, Michon J, Zoubek A, Jürgens H, Craft A: Safety assessment of intensive induction with vincristine, ifosfamide, doxorubicin, and etoposide (VIDE) in the treatment of Ewing tumors in the EURO-E. W.I. N.G. 99 clinical trial. Pediatric blood & cancer 2006, 47: 22 [PMID: 16572419] JüR2006
- Kaatsch P, Spix C: German Childhood Cancer Registry — Jahresbericht / Annual Report 2015 (1980-2014). Institut für Medizinische Biometrie, Epidemiologie und Informatik (IMBEI), Universitätsmedizin der Johannes Gutenberg-Universität Mainz 2015 [URI: www.kinderkrebsregister.de] KAA2015a
- Dirksen U, Jürgens H: Ewing-Sarkome des Kindes- und Jugendalters. S1-Leitlinie der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) AWMF online 2014 [URI: www.awmf.org] DIR2014
- Haeusler J, Ranft A, Boelling T, Gosheger G, Braun-Munzinger G, Vieth V, Burdach S, van den Berg H, Jürgens H, Dirksen U: The value of local treatment in patients with primary, disseminated, multifocal Ewing sarcoma (PDMES). Cancer 2010, 116: 443 [PMID: 19924786] HAE2010
- Burkhardt B, Reiter A, Landmann E, Lang P, Lassay L, Dickerhoff R, Lakomek M, Henze G, von Stackelberg A: Poor outcome for children and adolescents with progressive disease or relapse of lymphoblastic lymphoma: a report from the berlin-frankfurt-muenster group. Journal of clinical oncology 2009, 27: 3363 [PMID: 19433688] BUR2009
- Wagner LM, McAllister N, Goldsby RE, Rausen AR, McNall-Knapp RY, McCarville MB, Albritton K: Temozolomide and intravenous irinotecan for treatment of advanced Ewing sarcoma. Pediatric blood & cancer 2007, 48: 132 [PMID: 16317751] WAG2007
- Gerth HU, Juergens KU, Dirksen U, Gerss J, Schober O, Franzius C: Significant benefit of multimodal imaging: PET/CT compared with PET alone in staging and follow-up of patients with Ewing tumors. Journal of nuclear medicine : official publication, Society of Nuclear Medicine 2007, 48: 1932 [PMID: 18006618] GER2007
- Germeshausen M, Skokowa J, Ballmaier M, Zeidler C, Welte K: G-CSF receptor mutations in patients with congenital neutropenia. Current opinion in hematology 2008, 15: 332 [PMID: 18536571] GER2007
- Bernstein M, Kovar H, Paulussen M, Randall RL, Schuck A, Teot LA, Jürgens H: Ewing’s sarcoma family of tumors: current management. The oncologist 2006, 11: 503 [PMID: 16720851] BER2006
- Hunold A, Weddeling N, Paulussen M, Ranft A, Liebscher C, Jürgens H: Topotecan and cyclophosphamide in patients with refractory or relapsed Ewing tumors. Pediatric blood & cancer 2006, 47: 795 [PMID: 16411206] HUN2006
- Hawkins DS, Schuetze SM, Butrynski JE, Rajendran JG, Vernon CB, Conrad EU 3rd, Eary JF: [18F]Fluorodeoxyglucose positron emission tomography predicts outcome for Ewing sarcoma family of tumors. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2005, 23: 8828 [PMID: 16314643] HAW2005
- Dirksen U, Poremba C, Schuck A: Knochentumoren des Kindes-und Jugendalters. Der Onkologe 2005, 10: 1034 DIR2005
- Niemeyer C, Kontny U: Tumoren der Ewing-Sarkom-Familie, in: Gutjahr P (Hrsg.): Krebs bei Kindern und Jugendlichen. Deutscher Ärzte-Verlag Köln 5. Aufl. 2004, 491 [ISBN: 3769104285] NIE2004
- Schuck A, Ahrens S, Paulussen M, Kuhlen M, Konemann S, Rube C, Winkelmann W, Kotz R, Dunst J, Willich N, Jürgens H: Local therapy in localized Ewing tumors: results of 1058 patients treated in the CESS 81, CESS 86, and EICESS 92 trials. Int J Radiat Oncol Biol Phys 2003, 55: 168 [PMID: 12504050] SCH2003g
- Paulussen M, Frohlich B, Jürgens H: Ewing tumour: Incidence, prognosis and treatment options. Paediatr Drugs 2001, 3: 899 [PMID: 11772151] PAU2001c
Саркома Юинга: краткая информация (336KB) автор: Dipl.-Biol. Maria Yiallouros, PD Dr. med. Gesche Tallen Stand: 14.07.2016