Что такое ревматоидный артрит и каковы причины?
Ревматоидный артрит (РА) является хроническим воспалительным заболеванием, поражающим суставы и различные органы. Наиболее характерным симптомом является боль, скованность или отек суставов кистей и стоп, но воспаление также может поражать другие суставы. Без лечения болезнь чаще всего приводит к разрушению суставов и тяжелой инвалидности, а также к повреждению многих органов и ранней смерти. Раннее начало эффективного лечения подавляет развитие болезни, предупреждает осложнения болезни и дает возможность нормального функционирования.
Какие факторы могут повлиять на прогноз?
В то время как прогноз для людей с РА трудно предсказать, несколько факторов могут иметь влияние. Это:
- наличие осложнений и системных симптомов;
- возраст человека;
- прогрессирование состояния при диагностике;
- избыточный вес или ожирение;
- генетический фактор;
- факторы образа жизни, такие как курение и пассивный образ жизни.
Исследование у людей с генетической предрасположенностью к РА показало, что курение является существенным фактором риска развития этого заболевания. Курение вызывает дальнейшее воспаление, которое может ухудшить состояние и увеличить риск осложнений, таких как респираторные заболевания и болезни сердца.
Как и при многих других заболеваниях, ранняя диагностика РА может привести к значительному улучшению. Ранние стадии заболевания, как правило, связаны с меньшим воспалением, которое легче контролировать с помощью противовоспалительных препаратов. Лечение на данном этапе позволяет предотвратить необратимое повреждение суставов и минимизировать влияние РА на качество жизни.
Более поздний диагноз приводит к хроническому течению заболевания, которое трудно лечить. Существует также повышенный риск постоянного повреждения суставов.
Причины ревматоидного артрита
Суть заболевания заключается в воспалительном процессе, который начинается внутри сустава. Неизвестный фактор стимулирует синовиальную оболочку, выстилающую сустав, к воспалительному ответу. Происходит ее разрастание и разрушение соседних структур (хряща, костей, связок, сухожилий). Симптомами этого изначально являются боль и отек, а затем необратимое разрушение и потеря подвижности сустава.
Рисунок -1. Локализация изменений суставов при ревматоидном артрите
Причины РА не до конца изучены. Скорее всего, для развития болезни необходимо сосуществование множества факторов. Наиболее важными из них являются:
- наследственная предрасположенность — существует предрасположенность к возникновению РА у близких родственников, но сам генетический фактор не вызывает заболевания — поэтому наличие РА у родителя не означает, что заболевание разовьется у детей, однако риск развития у них в 2–5 раз выше
- дефект иммунной системы — приводит к ошибочному распознаванию собственных тканей, как «врага», и выработке аутоантител для их уничтожения; было идентифицировано несколько генов, ответственных за этот процесс (в т.ч. гены тканевой совместимости HLA DRB1).
- пол — женщины болеют примерно в 3 раза чаще, чем мужчины
- инфекция — подозревается роль некоторых бактерий и вирусов в инициировании воспалительной реакции
- курение — увеличивает риск заболевания и вызывает ее более тяжелое течение
- стресс — у некоторых пациентов заболевание начинается после сильного стресса
Как протекает заболевание
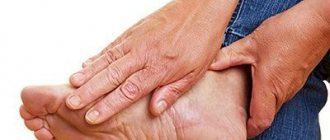
Болевой синдром обычно протекает с развитием опухоли вокруг болезненного сустава
В первое время воспалительный процесс охватывает только один сустав. Ткани вокруг него начинают отекать, краснеют, и только спустя неопределенный срок больной начинает чувствовать скованность и боль. Болезнь может быстро распространиться на второй, третий и т.д. суставы – буквально за несколько часов. Но начало воспалительного процесса практически всегда незаметно для человека.
Заболевание может затронуть два-три сустава или же распространиться на руки, ноги, позвоночник и нижнюю челюсть. Наибольше подвержены именно те сочленения, которые активно нагружаются человеком или испытывают неблагоприятные воздействия (ушиб, сдавливание, переохлаждение).
При артрите воспаление затрагивает синовиальную оболочку сустава. Именно с белками данных тканей начинает бороться иммунитет, ошибочно принимая их за чужеродных агентов. Это и влияет на то, сколько живут с ревматоидным артритом. Проявляются также сопутствующие симптомы:
- вялость, постоянная утомляемость;
- появление подкожных узлов (характерно больше для локтевых суставов);
- повышение температуры тела;
- слезоточивость и покраснение глаз;
- чувство онемения в конечностях;
- снижение веса;
- увеличение лимфоузлов.
Среди первых проявлений – утренняя скованность: человеку сложно согнуть/разогнуть руку или ногу, пошевелить пальцами. Причиной этому выступает скопление воспалительного экссудата за время неподвижного состояния человека.
Как проявляется ревматоидный артрит?
У большинства пациентов РА развивается незаметно. Может пройти несколько недель или даже месяцев, прежде чем симптомы станут настолько раздражающими, чтобы обратиться за медицинской помощью. Реже мы имеем дело с внезапным развитием болезни в течение нескольких дней. Часто вначале появляются «общие» симптомы, похожие на грипп, такие как слабость, субфибрильная температура, боль в мышцах, отсутствие аппетита, а также снижение массы тела. Они могут опережать или сопровождать «суставные» симптомы. Во время болезни также могут появиться симптомы поражения других органов.
Характерные симптомы ревматоидного артрита
Суставы
Болезнь типично поражает одни и те же места с обеих сторон тела. Первоначально это мелкие суставы кистей и стоп, и, по мере прогрессирования заболевания, многие другие суставы. Нетипичным (но возможным) началом заболевания является воспаление одного крупного сустава (напр., коленного или плечевого) или перемещение болезни по многим суставам.
Рисунок -2. Ранние изменения при ревматоидном артрите
Симптомы артрита это:
• боль и скованность — наиболее неприятны после пробуждения или после периода неподвижности в суставе, когда происходит накопление воспалительной жидкости и отек тканей; характерна утренняя скованность, которая при РА обычно длится более часа
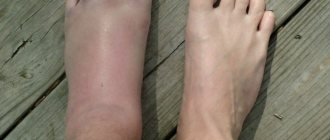
• отек — это результат разрастания синовиальной оболочки, образующей т.н. паннус, может сопровождаться экссудатом, вызванным повышенным образованием суставной жидкости воспалительного характера,
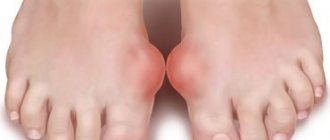
Рисунок -3. Прогрессирующие изменения при РА (многочисленные ревматоидные узелки, видимые над суставами)
• чувствительность сустава к сдавлению – характерным является, например, болезненное рукопожатие при протягивании руки пациенту с РА
• ограничение подвижности — пораженный сустав теряет способность выполнять весь спектр движений; и если происходит повреждение суставных структур в результате воспаления и вторичных дегенеративных изменений, нарушение суставной функции становится необратимым
• деформация суставов — это следствие длительной болезни; (рис. типичные суставные деформации при РА).
Внесуставные поражения
Ревматоидный артрит — это системное заболевание, поражающее не только суставы, но и многие органы (особенно РА с тяжелым и длительным течением). Кроме относительно частых доброкачественных поражений, таких как ревматоидные узелки или синдром сухости, очень редко могут возникать тяжелые осложнения, приводящие к преждевременной смерти (напр., инсульт или инфаркт миокарда).
- Ревматоидные узелки — безболезненные, подкожные узелки, чаще всего расположенные в области локтей, суставов кистей и других местах, подверженных сдавлению; также могут возникать во внутренних органах.
- Атеросклероз — его ускоренное развитие является результатом активации воспалительных процессов; осложнения атеросклероза являются основной причиной преждевременной смерти у людей с РА; у этих пациентов риск развития инфаркта миокарда и сердечной недостаточности, внезапной сердечной смерти или инсульта в 2–3 раза выше, чем у здоровых людей (смотрите также: Что такое атеросклероз, Ишемическая болезнь сердца, Инфаркт миокарда).
- Сердце — кроме ишемической болезни сердца и инфаркта миокарда в результате развития атеросклероза, может развиться: перикардит, кардиомиопатия, повреждение сердечных клапанов — симптомами этих заболеваний являются: боль в грудной клетке, одышка и снижение толерантности к физической нагрузке.
- Сосуды — васкулит — редкое, но серьезное осложнение РА, приводящее к ишемии различных внутренних органов; также могут появиться изъязвления подушечек пальцев и кожи.
- Легкие — РА способствует, среди прочего, плевриту и интерстициальной пневмонии; эти заболевания вызывают сухой кашель, одышку и боль в грудной клетке.
- Остеопороз — как РА, так и кортикостероиды, используемые при его лечении, значительно ускоряют развитие остеопороза; важным является соответственно раннее начало лечения, снижающего риск переломов костей.
- Глаза — частым симптомом является синдром сухости, вызванный конъюнктивитом, для которого характерно ощущение песка или инородного тела под веками; реже происходит вовлечение других структур глаза и проблемы со зрением.
- Нервы — часто встречается т.н. синдром запястного канала; редким, но серьезным осложнением является сдавление спинного мозга, вызванное подвывихом позвонков в шейном отделе позвоночника — его симптомами являются головная боль, расстройства чувствительности (онемение, покалывание, снижение болевой чувствительности) и слабость или парез конечностей. Это состояние, требующее срочного контакта с врачом.
- Почки — как сама болезнь, так и используемые препараты могут повредить почки; важны регулярные контрольные исследования функции почек.
- Гематологические нарушения — в течение длительной болезни встречается умеренная анемия, а также аномальное количество лейкоцитов. Для обострений заболевания характерно увеличение количества тромбоцитов. Чаще встречается увеличение лимфатических узлов и селезенки. РА увеличивает восприимчивость к инфекциям и риск развития лимфом.
Осложнения
Помимо серьезной деформации суставов, артрит может давать осложнения на другие органы и системы
Значительную опасность представляют именно осложнения артрита, поскольку затрагивают жизненно важные органы и системы. Классифицируют следующие опасности неконтролируемого развития болезни:
- Поражение кожных покровов. Наиболее распространены ревматоидные узелки, которые могут проявляться постепенно или внезапно. Также может наблюдаться утолщение и гипотрофия кожи, микроинфаркты в области ногтевого ложа. Нельзя дать однозначного ответа на вопрос “сколько живут с псориатическим артритом”, все зависит от стадии заболевания.
- Поражение глаз. Здесь, чаще всего, проявляется конъюнктивит. В более запущенных случаях склерит, который может привести к стойкой потере зрения. Наиболее страшным последствием является синдром Шегрена – аутоиммунное поражение слезных желез.
- Заболевания сердечно-сосудистой системы. Характеризуются различными воспалительными процессами в сердце: перикардит (воспаление наружной оболочки сердца); мокардит (воспаление средней сердечной оболочки); гранулематозное воспаление клапанов.
- Поражение нервной системы. Проявляется следующими болезнями: шейный миелит (воспаление шейного отдела спинного мозга); компрессионная нейропатия (сдавливание нервных стволов); множественный васкулит; сенсорно-моторная нейропатия (снижение чувствительности пораженных нервов). Продолжительность жизни при ревматоидном артрите с такими осложнениями невысокая.
- Заболевания крови. Среди распространенных тромбоцитоз, анемия и нейтропения (снижение количества нейтрофильных лейкоцитов).
- Поражение дыхательной системы. Проявляется интерстициальным заболеванием легких, плевритом (воспаление серозной оболочки), облитерирующим бронхиотолитом. Опасным является возникновение ревматоидных узелков в легочной ткани – они могут становиться причиной небольшого разрыва в легких и характеризуются кашлем с кровью.
- Заболевания опорно-двигательного аппарата. Среди них: генерализованная амиотрофия (нарушения питательных процессов мышечной ткани); бурситы, тендиниты, синовиты; поражение перстневидно-черпаловидных суставов гортани.
Что делать в случае появления симптомов РА?
Если появятся боль и отек суставов, следует немедленно обратиться к врачу. Люди с подозрением на РА должны находиться под наблюдением ревматолога. Быстрая диагностика определяет эффективность лечения, и, если его начать соответственно рано, существует даже вероятность постоянной ремиссии заболевания.
В течение РА могут возникнуть осложнения, требующие срочного медицинского вмешательства. Чаще всего их можно предотвратить и эффективно пролечить. Ознакомьтесь с симптомами, которые указывают на возникновение осложнений РА (смотрите: выше).
Важно
Срочно сконтактируйтесь со своим врачом, если у Вас появится:
- обострение заболевания (усиление боли, скованности и припухлости суставов, субфибрильные состояния, слабость, потеря массы тела) — требует более интенсивного лечения, чтобы, как можно скорее подавить активность заболевания
- любые признаки инфекции, напр., лихорадка, кашель, боль в горле, чувство жжения при мочеиспускании, слабость, чувство разбитости — пациенты с РА имеют сниженную способность борьбы с инфекциями (требуется быстрое и эффективное лечение)
- если у Вас недавно была выполнена пункция сустава, после которой увеличилась интенсивность боли, отек и повысилась температура в области сустава или лихорадка — это могут быть симптомы инфицирования сустава, требующие быстрого лечения; не стоит беспокоиться о боли сустава, которая проходит в течение суток после пункции( в это время следует ограничивать нагрузку на сустав)
- кашель, одышка, боль в грудной клетке, снижение толерантности к физической нагрузке — требуют неотложной диагностики в направлении болезней легких и сердца, сопутствующих РА
- любые неврологические симптомы (напр., нарушения чувствительности, слабость или парез конечностей, сильная головная боль, нарушения зрения) — могут быть симптомом инсульта или сдавления нервных структур
- боль в животе, темно окрашенный стул (или с примесью крови) —это могут быть симптомы язвенной болезни и кровотечения из желудочно-кишечного тракта, которые являются осложнением лечения нестероидными противовоспалительными препаратами.
Чрезвычайно важным также является информирование врача о планируемой беременности (это касается, как женщин, так и мужчин). Ревматоидный артрит не является противопоказанием к зачатию (а у большинства женщин во время беременности наступает временная ремиссия заболевания), однако ее следует запланировать, чтобы своевременно скорректировать лечение, поскольку большинство препаратов может навредить плоду.
Каким образом врач ставит диагноз ревматоидный артрит?
Врач ставит диагноз ревматоидный артрит на основании сопоставления характерных симптомов с результатами лабораторных и визуализирующих исследований. Используемые до сих пор критерии РА датировались 1987 г. и были применимы только к далеко зашедшей болезни (это означает, что точный диагноз можно было поставить только после длительного наблюдения). В 2010 г. были разработаны новые критерии (ACR/EULAR), благодаря которым можно диагностировать РА уже на начальной стадии болезни и начать лечение прежде, чем разовьется необратимая деструкция сустава.
Лабораторные исследования
Лабораторные исследования помогают в диагностике РА, прогнозировании тяжести заболевания и контроле ее течения.
- РФ (ревматоидный фактор) определяется у 70–80 % больных (т. н. серопозитивная форма РА); однако РФ также определяется у здоровых людей и при других ревматологических заболеваниях.
- АЦЦП (антитела к циклическому цитруллинированному пептиду) — их преимуществом является то, что они встречаются почти исключительно при РА; могут появиться раньше, чем симптомы заболевания, а также у людей с серонегативной формой РА. Высокий титр РФ и АЦЦП указывает на тяжелую форму заболевания, с быстрым разрушением суставов и появлением внесуставных изменений.
- Повышенные показатели воспаления, напр., СОЭ, СРБ и изменения в общем анализе крови — служат в т. ч. для оценки активности заболевания.
Врач может также выполнить другие исследования крови, мочи или суставной жидкости, чтобы исключить другие заболевания суставов и оценить работу различных внутренних органов (напр., почек, печени).
Визуализирующие исследования
В случае подозрения РА выполняется рентгенография (РГ) кистей и стоп, и, возможно, других пораженных суставов. Типичные рентгенологические изменения при РА это: отек мягких тканей и снижение плотности кости в области сустава, наличие костных дефектов, сужение суставных щелей, а при более поздних стадиях —деформация суставов.
В начале заболевания полезны: магнитно-резонансная томография и ультразвуковое исследование, которые могут выявить воспалительные изменения раньше, чем РГ. В некоторых случаях (напр., при оценке шейного отдела позвоночника) информативна компьютерная томография.
Современное ведение больных с ранним ревматоидным артритом
Фармакотерапия РА существенно продвинулась за последние 10–15 лет. Ранняя и более агрессивная стратегия лечения с использованием традиционных синтетических базисных противовоспалительных препаратов (с–БПВП) и генно-инженерных биологических препаратов (ГИБП) позволяет изменить клиническое течение РА и замедлить или остановить рентгенографическое прогрессирование. В настоящее время целью лечения РА является ремиссия [2] или (если это не представляется возможным, например, при поздней стадии болезни) минимальная активность заболевания, что позволяет, контролируя симптомы, остановить деструкцию, предотвратить инвалидность и улучшить качество жизни. При этом надо помнить, что хотя воспаление потенциально обратимо, повреждение суставов (сужение суставной щели вследствие деградации хряща, костные эрозии) является практически необратимым, поэтому существует потребность в агрессивном лечении с самого начала болезни, для чего диагноз должен быть установлен максимально рано.
Ранняя диагностика
Поскольку при РА, как и при многих других иммуновоспалительных заболеваниях, не существует по-настоящему патогномоничных симптомов, включая результаты лабораторной и инструментальной диагностики, с 1956 г. применяются критериальные методы диагностики [4]. Последний вариант классификационных критериев РА – совместная разработка Американской коллегии ревматологов (ACR) и Европейской лиги против ревматизма (EULAR) – был опубликован в 2010 г. [5]. Эти критерии ориентированы в первую очередь на раннюю диагностику РА. Приоритетной задачей для авторов являлось выявление больных, нуждающихся в назначении БПВП.
По критериям ACR/EULAR 2010 диагностика проводится в 3 этапа:
1. Должно быть установлено наличие у больного хотя бы одного припухшего сустава по данным клинического осмотра.
2. Следует исключить другие заболевания, которые могут сопровождаться воспалительными изменениями суставов и и для которых более свойственны, чем для РА, такие изменения. Требуется дифференциальная диагностика с различными заболеваниями, такими как системная красная волчанка, псориатический артрит, подагра. В случае неясностей рекомендуется консультация ревматолога-эксперта.
3. Нужно набрать как минимум 6 баллов из 10 возможных по 4 позициям, описывающим особенности картины болезни у данного пациента (табл. 1).
Подробное описание практического применения критериев ACR/EULAR 2010 дано в нашей публикации [4]. Тестирование классификационных критериев ACR/EULAR для РА было проведено на нескольких когортах пациентов с ранним артритом. В целом новые критерии продемонстрировали высокую чувствительность, но обсуждается возможность гипердиагностики. В нашей группе больных с впервые возникшим артритом (n=413) были продемонстрированы высокая чувствительность и удовлетворительная специфичность этих критериев (89 и 63% соответственно). Показано, что наиболее хорошо критерии РА 2010 позволяют оценить состояние больных на очень ранней стадии болезни (до 3 мес.), серонегативных по ревматоидному фактору (РФ), а также с недифференцированным артритом [6, 7].
Оценка прогноза
После верификации диагноза РА необходимо выявить наличие факторов неблагоприятного прогноза, которые определяют в значительной степени агрессивность терапии. Наличие следующих факторов неблагоприятного прогноза следует оценивать при первичном обследовании и учитывать при принятии решения относительно лечения: наличие и титр РФ, наличие и уровень антител к циклическому цитруллинированному пептиду (АЦЦП) и/или других антител к цитруллинированным пептидам (АЦП), функциональные нарушения, большое количество припухших и болезненных суставов, ранние рентгенологические эрозии в кистях и стопах, а также эрозии суставных поверхностей, выраженный отек костного мозга по данным магнитно-резонансной томографии (МРТ) кистей, эрозии и выраженный энергетический допплеровский сигнал по данным УЗИ кистей, признаки внесуставных поражений, высокая скорость оседания эритроцитов (СОЭ) и повышенный уровень С-реактивного белка (СРБ). Все эти признаки ассоциированы с более агрессивным течением болезни и быстрым прогрессированием суставной деструкции [8–14]. Оценка факторов неблагоприятного прогноза является одним из компонентов клинических рекомендаций по лечению РА EULAR [15].
Принципы ведения больных и мониторинг
Основные принципы ведения пациентов с РА в развернутом виде, основные современные правила были представлены в 2010 г. в международной программе «Treat to target» (T2T) – «Лечение до достижения цели» [16]. Общие принципы Т2Т сформулированы следующим образом:
А. Лечение РА следует проводить на основании совместного решения пациента и врача-ревматолога.
B. Основная цель лечения больного РА – обеспечить максимально продолжительное сохранение высокого качества жизни, связанного с состоянием здоровья, путем контроля над симптоматикой, предотвращения структурного поражения суставов, нормализации функции и социальных возможностей пациента.
C. Подавление воспаления – важнейший способ достижения этой цели.
D. Лечение до достижения цели с помощью оценки активности заболевания и соответствующего подбора терапии способствует оптимизации исхода РА.
На основании общих принципов международным комитетом разработаны 10 рекомендаций Т2Т по лечению РА до достижения цели, основанных на научных доказательствах и мнении экспертов:
1. Первичная цель лечения РА – достижение состояния клинической ремиссии.
2. Клиническая ремиссия определяется как отсутствие признаков значимой воспалительной активности.
3. Хотя основной целью остается достижение ремиссии, на основании имеющихся научных данных допустимо считать приемлемой альтернативной целью лечения достижение низкой активности заболевания, особенно при стабильном состоянии и длительно протекающем заболевании.
4. До тех пор, пока не будет достигнута цель лечения, пересмотр лекарственной терапии необходимо осуществлять не реже 1 раза в 3 мес.
5. Необходимо регулярно оценивать и документировать данные об активности заболевания: у пациентов с умеренной/высокой степенью активности – ежемесячно, у пациентов со стойкой низкой активностью или в состоянии ремиссии – реже (1 раз в 3–6 мес.).
6. В каждодневной клинической практике для принятия решений о лечении необходимо использовать валидированные комплексные показатели активности заболевания, включающие оценку состояния суставов.
7. Помимо использования комплексных показателей активности заболевания при принятии клинических решений необходимо учитывать структурные изменения и нарушения функции.
8. Желаемая цель лечения должна поддерживаться в течение всего периода заболевания.
9. На выбор (комплексного) показателя активности заболевания и целевых параметров могут повлиять сопутствующие заболевания, индивидуальные особенности пациента и риски, связанные с приемом лекарственных препаратов.
10. Пациент должен быть в достаточной степени информирован о цели лечения и запланированной стратегии для достижения этой цели под наблюдением ревматолога.
Таким образом, в соответствии с рекомендациями Т2Т, принимая больного с РА, врач должен:
- оценить тяжесть состояния больного и прогноз (активность, функция, деструкция, иммунологические показатели). Этому способствует правильная формулировка диагноза согласно отечественной клинической классификации РА 2007 г. [17, 18], которая позволяет в компактной форме достаточно подробно описать картину болезни у конкретного пациента и хорошо обосновать терапевтический подход (табл. 2);
- исходя из этого определить цели лечения;
- разъяснить пациенту принципы лечения и возможности разных медикаментозных средств, обсудить плюсы и минусы разных схем терапии, объяснить ключевые моменты: больные РА нуждаются в активном лечении, при этом необходимо избежать «перелечивания» так же, как и «недолечивания»;
- лечение РА – не одноразовое мероприятие, а процесс, в течение которого схемы терапии меняются;
- резистентностью к БПВП в полных дозах;
В дальнейшем врач должен контролировать активность заболевания каждые 1–3 мес. до достижения низкой активности болезни или (предпочтительнее) ремиссии. Основным методом контроля в настоящее время является использование индекса активности DAS28 [18] (табл. 2). Все большее распространение получают упрощенные индексы – SDAI и CDAI [19], которые более четко определяют состояние клинической ремиссии [20]. Кроме того, для контроля прогрессирования суставной деструкции рекомендуется рентгенография кистей и стоп каждые 12 мес. (промежутки могут быть больше у длительно болеющих пациентов с 3–4 рентгенологической стадией). Для верификации структурных нарушений в суставах и их динамики в последнее время используют УЗИ и МРТ суставов, хотя практическое значение этих методов пока неокончательно определено.
Медикаментозная терапия РА
В настоящее время используются следующие группы медикаментозных препаратов для лечения РА:
1. Нестероидные противовоспалительные препараты (НПВП).
2. Глюкокортикоиды (ГК).
3. Синтетические БПВП.
4. ГИБП.
Согласно недавно опубликованному проекту группы специалистов EULAR [21], в связи с появлением новых классов противоревматических средств предложено внутри группы с-БПВП выделять «обычные» с-БПВП (метотрексат (МТ), лефлуномид (ЛЕФ) и др.) и таргетные с–БПВП, которые пока представлены единственным зарегистрированным препаратом (тофацитиниб (ТОФА)). Внутри группы ГИБП предложено выделить оригинальные ГИБП и биоаналоги ГИБП («биосимиляры»).
НПВП
НПВП – первая группа препаратов, которые назначаются при артрите, поскольку позволяют контролировать суставную боль. НПВП ингибируют фермент циклооксигеназу (ЦОГ), который катализирует выработку простагландинов, вызывающих воспалительные реакции (отек, боль, расширение сосудов и др.). ЦОГ существует в нескольких изоформах, из которых ЦОГ-1 отвечает за некоторые защитные реакции, в первую очередь со стороны ЖКТ, а ЦОГ-2 активируется при воспалении. НПВП условно делятся на неселективные, которые ингибируют ЦОГ-1 и ЦОГ-2 (диклофенак, ацеклофенак, индометацин и др.), а также селективные, ингибирующие преимущественно ЦОГ-2, поэтому они имеют лучший профиль безопасности (целекоксиб, эторикоксиб). При выборе НПВП необходимо учитывать факторы риска развития НПВП-ассоциированной гастропатии: высокие дозы НПВП, пожилой возраст, инфекция Helicobacter pylori, «язвенный анамнез» и кровотечения из ЖКТ в анамнезе, применение низких доз ацетилсалициловой кислоты (АСК), антикоагулянтов. С другой стороны, класс-специфическим является возможное негативное действие НПВП на сердечно-сосудистую систему, поэтому необходимо также учитывать факторы риска этого типа осложнений: наличие сердечной недостаточности, артериальной гипертензии [22]. Врач должен оценить выраженность риска и сочетание различных факторов риска у конкретного пациента [23]. Использование ингибиторов протонной помпы с НПВП может усилить защиту верхних отделов ЖКТ. При риске кардиоваскулярных осложнений возможно сочетание с низкими дозами АСК и другими антиагрегантами или антикоагулянтами, но соотношение между вредом и пользой должно оцениваться индивидуально. Мониторинг АД может иметь значение при подборе схемы терапии НПВП.
ГК
ГК могут быть назначены как часть начальной стратегии лечения пациентов с РА для контроля над активностью болезни. Основные методики применения ГК при РА – внутрь низкие дозы (преднизолона 5–10 мг/сут или метилпреднизолона 4–8 мг/сут) и внутрисуставное введение пролонгированных препаратов (бетаметазон, метилпреднизолон и триамцинолон). Более высокие дозы ГК внутрь или пульс-терапия ГК применяются весьма редко – при тяжелых системных проявлениях болезни. Имеются данные, доказывающие, что сочетание низкой дозы ГК внутрь с БПВП повышает клиническую эффективность лечения и способствует торможению суставной деструкции [24]. В связи с достаточно высокой вероятностью осложнений терапии (инфекции, остеопороз, задержка жидкости, снижение толерантности к глюкозе и др.) рекомендуются применение минимально возможных дозировок ГК, сокращение продолжительности их приема до момента развития эффекта от БПВП (так называемая «бридж-терапия»), тщательный контроль над состоянием пациента, профилактическое назначение антиостеопоретических препаратов.
Синтетические БПВП
Применение с-БПВП до сих пор является основой и обязательным компонентом лечения РА. Традиционные БПВП имеют различную химическую структуру и механизмы действия. Они условно могут быть подразделены на препараты с преимущественно (применяемые для лечения РА) иммуномодулирующим действием – МТ, ЛЕФ, сульфасалазин (ССЗ), гидроксихлорохин (ГХ), циклоспорин А, азатиоприн и преимущественно цитотоксические препараты (циклофосфамид, хлорамбуцил и др.), которые либо практически вышли из употребления, либо назначаются очень редко в особых случаях (тяжелый ревматоидный васкулит, синдром Шегрена и др.). Ранее широко известные препараты золота и пеницилламин сейчас практически не применяются из-за неблагоприятного профиля безопасности.
МТ является предпочтительным по сравнению с другими с-БПВП по соотношению эффективности и безопасности и должен быть первым препаратом, который используется у пациентов с РА при отсутствии противопоказаний. Ни один другой с-БПВП или ингибитор фактора некроза опухоли-α (ФНО-α) в монотерапии не превосходит МТ по клинической эффективности. Для всех ГИБП показано, что их комбинация с МТ превосходит по эффективности монотерапию [25]. МТ также является обязательным компонентом [24, 26] рекомендованных комбинаций с-БПВП (МТ + ССЗ, МТ + ГХ, МТ + ССЗ + ГХ, МТ + циклоспорин А). Прием MT следует начинать перорально или парентерально (дозы могут варьироваться, обычно рекомендуется начальная доза 10–15 мг/нед.) и титровать до максимальной дозы 25–30 мг/нед. Оптимальный график эскалации дозы зависит от клинической картины и переносимости МТ у конкретного пациента. Профиль безопасности МТ в низких дозах, используемых для лечения РА при еженедельном назначении, изучается уже более 25 лет с очень незначительным количеством клинически значимых побочных эффектов [27]. У пациентов с неадекватным ответом или непереносимостью МТ per os должно обсуждаться парентеральное назначение препарата. В этом случае наилучшие результаты могут быть получены при использовании формы МТ для подкожного введения [28], которая обеспечивает наилучший фармакокинетический профиль.
ГИБП
К настоящему времени 8 ГИБП были одобрены для лечения РА в Российской Федерации. Они относятся к разным классам в зависимости от механизма действия, химической структуры и содержания инородного (мышиного) белка (табл. 3). Структурные особенности наиболее важны для группы ингибиторов ФНО-α, среди которых чаще всего наблюдается феномен иммуногенности (выработки антител к препарату), приводящий к потере эффекта. Иммуногенность наиболее выражена у ингибиторов ФНО-α, относящихся к моноклональным антителам (МАТ) и содержащих мышиный белок.
Терапия ингибиторами ФНО-α рекомендуется для лечения пациентов с неадекватным ответом на традиционные БПВП. Неадекватный ответ определяется как сохранение умеренной или высокой активности заболевания, несмотря на использование МТ и/или других с-БПВП в монотерапии или комбинированной терапии в течение 3–6 мес. при условии применения в рекомендованных дозах. Показано, что в качестве препаратов 1-го ряда биологической терапии можно успешно применять и ГИБП с иными механизмами действия [15].
Переход на ГИБП после неуспеха лечения МТ был поставлен под сомнение в нескольких недавних исследованиях с использованием «тройной терапии» с-БПВП (МТ + ССЗ + ГХ). O’Dell et al. в исследовании TEAR [29] показали, что у больных, недостаточно ответивших на лечение МТ, «тройная терапия» не уступала по клиническому ответу комбинации МТ и этанерцепта. Те же авторы в исследовании RACAT [30] продемонстрировали возможность успешного перехода не только с «тройной терапии» на комбинацию МТ + ингибитор ФНО-α, но и наоборот, причем результаты были вполне сопоставимы.
Таргетные БПВП
К этой новой группе лекарственных средств для лечения иммуновоспалительных заболеваний (называемой еще «малые молекулы») относится пока единственный зарегистрированный в России (а также в США, Японии, Швейцарии и ряде других стран) препарат тофацитиниб (ТОФА). Он представляет собой низкомолекулярный ингибитор внутриклеточного фермента Янус-киназы, который входит во внутриклеточную сигнальную систему Jak-STAT, состоящую из Jak-киназ и сигнального белка-трансдуктора и активатора транскрипции STAT (Janus Kinases – Signal Transducer and Activator of Transcription). Биологическая роль этой системы состоит во внутриклеточной передаче сигнала от медиаторов иммунной системы (например, цитокинов). В связи с этим ряд фармакодинамических эффектов ТОФА объясняется блокадой биологического действия интерлейкина-6 (ИЛ-6), и терапевтические характеристики препарата в определенной степени пересекаются с характеристиками тоцилизумаба [31]. Исследования ТОФА в 3-й фазе клинических испытаний при РА были проведены на большом клиническом материале в рамках 6-ти контролируемых исследований серии ORAL, изучавших основные клинические ситуации, в которых может потребоваться применение нового противовоспалительного/иммуномодулирующего препарата. Суммарно в этих исследованиях приняли участие 4267 пациентов. Все исследования ТОФА достигли своих первичных конечных точек, продемонстрировали хороший клинический эффект препарата в сочетании с удовлетворительной безопасностью [32]. Препарат перспективен, особенно учитывая возможность приема внутрь. В то же время имеется настороженность в отношении некоторых аспектов его безопасности, а опыт практического применения этого нового препарата недостаточен, чтобы делать конкретные выводы о его реальном месте в современной терапии РА.
Клинические рекомендации EULAR по лечению РА
В современных условиях, когда имеется значительное количество терапевтических возможностей для лечения РА, особое значение приобретают клинические рекомендации. Наиболее авторитетными являются рекомендации EULAR, которые носят международный характер и отличаются высокой научной обоснованностью. Последний вариант этих рекомендаций по медикаментозному лечению РА был принят в 2013 г. [15] и сразу стал активно обсуждаться в нашей стране [25, 33]. Краткое содержание рекомендаций EULAR 2013 представлено в таблице 4.
Рекомендации начинаются с основных принципов, постулирующих, что:
A. Терапия больных РА должна быть направлена на наилучшие результаты лечения как совместное решение пациента и ревматолога.
B. Ревматологи являются специалистами, которые должны первично вести больных РА.
C. Лечение РА предполагает высокие индивидуальные, социальные и медицинские расходы, которые должны учитываться лечащим ревматологом при ведении больного.
Эти принципы, несомненно, носят очень общий характер, но необходимо отметить высокую значимость работы специалиста-ревматолога и его контактов с пациентом.
Конкретные рекомендации подчеркивают важность МТ как «якорного» препарата при лечении РА в качестве монотерапии и компонента комбинированных схем лечения. Следует обратить внимание на то, что терапия ГИБП рассматривается только в комбинации с МТ. Монотерапия ГИБП не обсуждается, поскольку хорошо доказано, что лечение ГИБП в подавляющем большинстве случаев оправданно именно в рамках комбинации с с-БПВП. С другой стороны, новая версия рекомендаций «демократичнее» подходит к выбору первого ГИБП, допуская помимо ингибиторов ФНО-α применение также препаратов с иными механизмами действия. В целом новые рекомендации EULAR (2013 г.) являются важным вкладом в научную ревматологию и в практическое здравоохранение. Их внедрение, несомненно, будет способствовать повышению качества оказания медицинской помощи больным РА. Кроме того, эти рекомендации могут стать хорошей базой для разработки новой редакции российских национальных рекомендаций по ведению больных РА.
Литература
- Балабанова Р.М., Эрдес Ш.Ф. Ревматические заболевания у взрослого населения в федеральных округах России // Научно-практическая ревматология. 2014. № 52. С. 5–7.
- Галушко Е.А., Эрдес Ш.Ф., Базоркина Д.И. и соавт. Распространенность ревматоидного артрита в России (по данным эпидемиологического исследования) // Терапевтический архив. 2010. № 5. С. 9–14.
- Smolen J.S., Aletaha D., Machold K.P. Therapeutic strategies in early rheumatoid arthritis // Best Pract Res Clin Rheumatol. 2005. Vol. 19. Р. 163–77.
- Каратеев Д.Е., Олюнин Ю.А., Лучихина Е.Л. Новые классификационные критерии ревматоидного артрита ACR/EULAR 2010 – шаг вперед к ранней диагностике // Научно-практическая ревматология. 2011. № 49. С. 10–15.
- Aletaha D., Neogi T., Silman A.J. et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative // Ann Rheum Dis. 2010. Vol. 69. Р. 1580–1588.
- Luchikhina E., Karateev D., Novikov A. et al. Performance and predictive value of ACR/EULAR2010 rheumatoid arthritis classification criteria in different groups of patients with early arthritis // Ann Rheum Dis. 2011. Vol. 70. Suppl. 3. Р. 285 (THU0324).
- Каратеев Д.Е., Лучихина Е.Л. Ранний ревматоидный артрит / В кн.: Генно-инженерные биологические препараты в лечении ревматоидного артрита / под ред. Е.Л. Насонова. М.: ИМА-Пресс, 2013. С. 65–77. 8. Landewé R. Predictive markers in rapidly progressing rheumatoid arthritis // J Rheumatol Suppl. 2007. Vol. 80. Р. 8–15.
- Emery P., McInnes I.B., van Vollenhoven R., Kraan M.C. Clinical identification and treatment of a rapidly progressing disease state in patients with rheumatoid arthritis // Rheumatology (Oxford). 2008. Vol. 47. Р. 392–398.
- Brown A.K., Conaghan P.G., Karim Z. et al. An explanation for the apparent dissociation between clinical remission and continued structural deterioration in rheumatoid arthritis // Arthritis Rheum. 2008. Vol. 58. Р. 2958–2967.
- Vastesaeger N., Xu S., Aletaha D., St Clair E., Smolen J. A pilot risk model for the prediction of rapid radiographic progression in rheumatoid arthritis // Rheumatology. 2009. Vol. 48. Р. 1114–1121.
- Демидова Н.В. Взаимосвязь иммуногенетических и иммунологических маркеров и их влияние на активность заболевания и рентгенологическое прогрессирование у больных ранним ревматоидным артритом // Научно-практическая ревматология. 2009. № 3. С. 12–17.
- Nam J., Villeneuve E., Emery P. The role of biomarkers in the management of patients with rheumatoid arthritis // Curr Rheumatol Rep. 2009. Vol. 11. Р. 371–377.
- Каратеев Д.Е. Современный взгляд на проблему быстропрогрессирующего ревматоидного артрита // Современная ревматология. 2010. № 2. С. 37–42.
- Smolen J.S., Landewé R., Breedveld F.C. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update // Ann Rheum Dis. 2014 Mar. Vol. 73 (3). Р. 492–509. doi: 10.1136/annrheumdis-2013-204573.
- Smolen J., Aletaha D., Bijlsma J. et al. Treating rheumatoid arthritis to target: recommendations of an international task force // Ann Rheum Dis. 2010. Vol. 69. Р. 631–637.
- Каратеев Д.Е., Олюнин Ю.А. О классификации ревматоидного артрита // Научно-практическая ревматология. 2008. № 1. С. 5–17.
- Насонов Е.Л., Каратеев Д.Е., Балабанова Р.М. Ревматоидный артрит / В кН.: Ревматология. Национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. М.: ГЭОТАР-Медиа, 2008. С. 290–331.
- Aletaha D., Smolen J. The Simplified Disease Activity Index (SDAI) and the Clinical Disease Activity Index (CDAI): a review of their usefulness and validity in rheumatoid arthritis // Clin Exp Rheumatol. 2005. Vol. 23 (5. Suppl 39). Р. 100–108.
- Felson D., Smolen J., Wells G. et al. American College of Rheumatology/European League Against Rheumatism provisional definition of remission in rheumatoid arthritis in clinical trials // Arthr Rheum. 2011. Vol. 63. Р. 573–586.
- Smolen J.S., van der Heijde D., Machold K.P., Aletaha D., Landewé R. Proposal for a new nomenclature of disease-modifying antirheumatic drugs // Ann Rheum Dis. 2014. Vol. 73 (1). Р. 3–5. doi: 10.1136/annrheumdis-2013-204317.
- Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. М.: ИМА‐пресс, 2009. 167 с.
- Каратеев А.Е. Применение НПВП: схематический подход // Русский медицинский журнал. 2011. № 25. С. 1558–1559.
- Gaujoux-Viala C., Nam J., Ramiro S. et al. Efficacy of conventional synthetic disease-modifying antirheumatic drugs, glucocorticoids and tofacitinib: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis // Ann Rheum Dis. 2014 Mar. Vol. 73 (3). Р. 510–515. doi: 10.1136/annrheumdis-2013-204588.
- Насонов Е.Л., Каратеев Д.Е., Чичасова Н.В. Новые рекомендации по лечению ревматоидного артрита (EULAR 2013): место метотрексата // Научно-практическая ревматология. 2014. № 52. С. 8–26.
- Kumar P., Banik S. Pharmacotherapy Options in Rheumatoid Arthritis // Clin Med Insights Arthritis Musculoskelet Disord. 2013. Vol. 6. Р. 35–43.
- Kaltsonoudis E., Papagoras C., Drosos A. Current and future role of methotrexate in the therapeutic armamentarium for rheumatoid arthritis // Int J Clin Rheumatol. 2012. Vol. 7. Р. 179–189.
- Braun J. Methotrexate: Optimizing the Efficacy in Rheumatoid Arthritis // Ther Adv Musculoskelet Dis. 2011. Vol. 3 (3). Р. 151–158. doi: 10.1177/1759720X11408635.
- O’Dell J.R., Curtis J.R., Mikuls T.R. et al. Validation of the methotrexate-first strategy in patients with early, poor-prognosis rheumatoid arthritis: results from a two-year randomized, double-blind trial // Arthritis Rheum. 2013. Vol. 65. Р. 1985–1694. doi: 10.1002/art.38012.
- O’Dell J.R., Mikuls T.R., Taylor T.H. et al. Therapies for active rheumatoid arthritis after methotrexate failure // N Engl J Med. 2013. Vol. 369. Р. 307–318.
- Каратеев Д.Е. Новое направление в патогенетической терапии ревматоидного артрита: первый ингибитор Янус-киназ тофацитиниб // Современная ревматология. 2014. № 1. С. 39–45.
- Feist E., Burmester G. Small molecules targeting JAKs—a new approach in the treatment of rheumatoid arthritis // Rheumatology. 2013. Vol. 52. Р. 1352–1357.
- Насонов Е.Л., Каратеев Д.Е., Чичасова Н.В. Рекомендации EULAR по лечению ревматоидного артрита – 2013: общая характеристика и дискуссионные проблемы // Научно-практическая ревматология. 2013. № 51. С. 609–623.
Какие существуют методы лечения ревматоидного артрита?
Методы лечения РА за последние годы значительно изменились в связи с появлением новых эффективных лекарственных средств. В настоящее время основной упор делается на применении как можно раньше болезнь-модифицирующего антиревматического препарата (БМАРП). Все чаще это позволяет достичь ремиссии (то есть состояния, при котором отсутствуют симптомы заболевания и признаки его активности в лабораторных и визуализирующих исследованиях) или его низкой активности. К сожалению, начало РА часто незаметно, и нередко проходит несколько месяцев прежде, чем начнется соответствующее лечение — поэтому не откладывайте посещение врача, если у Вас появились симптомы артрита!
Эффективное лечение РА означает исчезновение симптомов болезни, хорошее качество жизни и сохранение физической формы. Помимо основного фармакологического лечения этого заболевания, важным является раннее начало реабилитации, а в некоторых случаях — хирургическое лечение. О том, какие конкретно лекарства использовать, решает ревматолог, принимая во внимание степень тяжести заболевания, его активность (чаще всего с использованием индекса DAS-28), прогностические показатели и противопоказания к применению определенных лекарств (напр., заболевания печени, почек, туберкулез). Важным является разработка вместе с врачом эффективного плана действий — это включает регулярные визиты и проведение лабораторных исследований, оценивающих эффективность и возможные побочные эффекты используемых препаратов.
Фармакологическое лечение ревматоидного артрита
Болезнь-модифицирующие антиревматические препараты (БМАРП) играют основную роль в лечении РА, потому что не только облегчают симптомы, но, прежде всего, тормозят разрушение суставов, позволяя сохранить физическую полноценность и нормальное функционирование в повседневной жизни. Они должны назначаться незамедлительно, сразу после постановки диагноза, чтобы предотвратить появление необратимых изменений в суставах. Эти препараты, однако, не обеспечивают полного выздоровления — после прекращения их приема заболевание обычно рецидивирует. Различают БМАРП «небиологические (синтетические)» и «биологические».
К небиологическим БМАРП относятся:
- метотрексат
- лефлуномид
- сульфасалазин
- соли золота
- хлорохин
Первоначальный эффект действия этих препаратов появляется через некоторое время, обычно через 1–2 месяца (полный — через 3–6 месяцев). Метотрексат является препаратом первой линии при РА, он очень эффективен и обычно хорошо переносится (многие побочные эффекты имеют временный характер).
В течение последних нескольких лет в лечении РА все чаще используются т.н. биологические препараты, полученные с помощью методов генной инженерии, которые направлены против факторов, вовлеченных в воспалительный процесс. Существует несколько типов биологических препаратов, в зависимости от их целевого места действия (в т. ч. ФНО, ИЛ-1, ИЛ-6, T или B лимфоциты).
При лечении РА чаще всего применяются:
- адалимумаб
- этанерцепт
- инфликсимаб
- цертолизумаб
- голимумаб
- абатацепт
- тоцилизумаб
- ритуксимаб
Эффект действия этих препаратов заметен немного быстрее, обычно в течение 2–6 недель. Их можно использовать отдельно или в сочетании с синтетическими препаратами (чаще всего с метотрексатом). Биологические препараты предназначены для пациентов, у которых не удается добиться соответствующего контроля заболевания, несмотря на применение максимально переносимых доз синтетических препаратов, реже — в качестве начального лечения для людей с высокой активностью заболевания и неблагоприятными прогностическими факторами.
Глюкокортикостероиды быстро купируют симптомы артрита и тормозят процесс разрушения суставов, поэтому их часто используют в начале заболевания (до того, как начнет действовать базисный БМАРП) и при его обострениях. Из-за множества побочных эффектов, необходимо попытаться как можно скорее уменьшить дозу глюкокортикостероида и использовать его кратковременно. Кортикостероиды также можно вводить непосредственно во внутрь пораженного сустава (смотрите: Преднизолон, Метилпреднизолон).
Нестероидные противовоспалительные препараты —купируют симптомы артрита, но не подавляют прогрессирования заболевания, поэтому используются только в качестве вспомогательных средств в борьбе с болью и скованностью в суставах. Оказывают много побочных эффектов, таких как желудочно-кишечное кровотечение, повреждение почек и повышенный риск развития заболеваний сердца. Никогда не принимайте более одного препарата из этой группы и не превышайте рекомендуемых дозировок Смотрите некоторые препараты из этой группы: Диклофенак, Ибупрофен, Кетопрофен, Напроксен, Нимесулид
Обезболивающие препараты, такие как, парацетамол и опиоиды, применяются, если, несмотря на полноценную базисную терапию, сохраняются болевые симптомы.
Нефармакологическое лечение ревматоидного артрита
У всех пациентов, кроме применения лекарственных препаратов очень важным является:
- психологическая поддержка — помните, что болезнь, которая часто связана с болью и инвалидностью, также может вызывать разочарование, чувство зависимости от окружающих, и даже депрессию, поэтому не стесняйтесь искать психологической поддержки у близких и в специализированных центрах; некоторые методы (напр., метод биологической обратной связи (biofeedback) и бихевиоральная терапия) очень эффективны при контроле симптомов заболевания и улучшают самооценку
- отдых — усталость является частым симптомом РА, особенно в его активном периоде; позвольте себе отдохнуть — короткий сон в течение дня поможет Вам восполнить энергию и принести облегчение больным суставам
- упражнения — пациенты с РА часто отказываются от какой-либо физической активности, что приводит к снижению подвижности суставов, контрактурам и мышечной слабости; регулярная физическая активность предотвращает некоторые неблагоприятные изменения в суставах, и даже их устраняет; рекомендуются упражнения, увеличивающие объем движений и укрепляющие мышцы (помогают сохранить подвижность и стабильность суставов), и упражнения, улучшающие общую выносливость (напр., ходьба, плавание, езда на велосипеде); программа упражнений должна быть разработана физиотерапевтом и должна быть адаптирована к каждому пациенту индивидуально, в зависимости от степени тяжести заболевания, состояния данного человека и сопутствующих заболеваний
Важно
От упражнений следует воздержаться при обострении симптомов заболевания; помните, что, чем раньше Вы начнете целенаправленную реабилитацию, тем легче будет предотвратить деформацию и неподвижность суставов.
- физиотерапия — различные методы, такие как криотерапия, ультразвук, массаж и бальнеотерапия, помогают уменьшить боль и воспаление суставов, а также расслабить мышечную систему; их использование требует тщательной оценки состояния здоровья и учета возможных противопоказаний.
- ортопедические приспособления помогает уменьшить нагрузку на больные суставы и справиться с инвалидностью — это трости, костыли, ходунки, инвалидные коляски для облегчения передвижения, стабилизаторы на руки, колени и голеностопные суставы (т. н. ортезы), помогающие поддерживать правильное положение суставов, ортопедические стельки для обуви, улучшающие структуру стопы и разгружающие опорные суставы при ходьбе
- адаптация окружения к инвалидности, напр., специально адаптированные кухонные приспособления, мебель, ручки, помогающие при подъеме, адаптированный автомобиль — помогут выполнять повседневные действия
- соответствующая диета — речь идет о поддержании нормальной массы тела; избегайте, как избыточного веса и ожирения (которые увеличивают нагрузку на суставы и ускоряют развитие атеросклероза), так и недоедания (которое ослабляет организм и приводит к атрофии мышц); также важным является обеспечить кости необходимым количеством кальция и витамина D, так как РА значительно ускоряет развитие остеопороза
- прекращение курения, которое увеличивает риск развития и тяжелого течения заболевания.
Местное лечение ревматоидного артрита
Местное лечение ревматоидного артрита касается непосредственно пораженного сустава.
Выполняется:
- пункция сустава с целью декомрессии его от накопившейся воспалительной жидкости и введения внутрь противовоспалительных препаратов (кортикостероидов)
- процедуры по удалению измененной синовиальной оболочки (т.н. синовэктомии) — существуют разные способы их выполнения: хирургические, химические (с помощью введения вещества, разрушающего синовиальную оболочку) или с использованием радиоизотопа
- разного рода коррекционно-реконструктивные процедуры, главной целью которых является улучшение строения и функционирования деформированных суставов
- эндопротезирование, т. е. замена разрушенного сустава искусственным протезом
- артродез, основанный на полной стабилизации сустава, благодаря чему устраняется боль
- декомпрессия туннельного синдрома запястья, который часто сопровождает РА.
Тяжелый вариант течения ревматоидного артрита
Ревматоидный артрит (РА) считается одним из самых тяжелых хронических заболеваний человека. Заболевание характеризуется выраженным воспалением с пролиферацией синовиальной оболочки суставов, поражением внутренних органов и систем, многолетним персистированием активности воспаления и постепенным разрушением структур суставов и периартикулярных тканей. До последнего времени в течение первых 5 лет болезни более 40% больных РА становились инвалидами [1]. Кроме того, многими авторами сообщается, что РА снижает продолжительность жизни больных в среднем на 10 лет [2, 3].
Течение РА весьма вариабельно. Это связано со многими причинами. Больной может оказаться резистентным к лечению, либо терапия оказывается не переносимой. Задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) также ухудшает прогноз при РА. Кроме того, известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания. Известно, что в крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляются серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитрулинированному пептиду (АЦЦП) [4] (рис. 1).
Морфологическое исследование синовиальной оболочки, полученной у больных в первые месяцы дебюта артрита, показало, что не у всех больных выявляются признаки острого ревматоидного воспаления, у части больных уже в первом биоптате отмечаются отчетливые признаки хронического синовита [5]. Именно у этих больных отмечался далее более торпидный вариант РА с плохим ответом на терапию БПВП. Тяжесть состояния больного РА на каждом этапе зависит от уровня воспалительной активности, что определяет выраженность болей в суставах, скованности, функциональных нарушений. При адекватно проводимой терапии и подавлении активности до развития необратимых анатомических изменений в суставах (деструкция, деформация) функция суставов восстанавливается (
). Тяжелый вариант течения болезни формируется при неадекватно проводимой или не эффективной терапии и определяется степенью стойкой утраты функциональной способности больного не только к профессиональному труду, но и к самообслуживанию. Поэтому как можно более раннее начало противовоспалительной терапии имеет при РА принципиальное значение.
В последнее десятилетие в практику ревматолога внедрены критерии раннего РА [6] для своевременного направления больного к ревматологу и раннего начала терапии. Идеальным должно считаться начало терапии БПВП сразу после появления первых симптомов воспаления в синовиальной оболочке: утренней скованности, боли в суставах и припухлости. На практике больной с дебютом РА проходит подчас длинный путь консультаций, диагностических мероприятий до встречи с ревматологом. Кроме того, начало болезни может быть клинически слабо выражено и симптомы болезни медленно нарастают, что затрудняет установление диагноза РА. По данным зарубежных авторов [7] и по нашим данным [8] при остром дебюте РА отдаленный исход болезни лучше, чем при постепенном начале заболевания. Вероятно, острое начало болезни заставляет пациента быстрее обращаться за врачебной помощью и позволяет врачу быстрее определиться с диагнозом и начать терапию. Наши данные свидетельствуют о лучшем исходе РА, оцененном через 15 лет болезни по степени сохранности функции опорно-двигательного аппарата, выраженности деструкции в суставах, частоте многолетних ремиссий и по выживаемости больных, при назначении БПВП в первые 6 месяцев от дебюта симптомов артрита [9]. Задержка с назначением БПВП приводит к более плохому ответу на эти препараты, что было показано в контролируемых исследованиях [10]. Препаратами первой линии считаются метотрексат и лефлуномид. Оба препарата способны подавлять активность и прогрессирование РА у большинства больных, особенно при назначении их в первые месяцы болезни. Но и начало терапии в очень ранний период болезни (1–2 месяца) не во всех случаях позволяет добиться выраженного эффекта (клинической ремиссии или поддержания субклинической активности РА). Во-первых, больной может не ответить на базисный препарат; во-вторых, у многих больных эффективность БПВП уменьшается через 1–2 года терапии, у части больных происходит последовательная смена базисных препаратов из-за симптомов непереносимости. При неэффективности и/или непереносимости последовательно назначаемых БПВП и формируется тяжелый вариант РА. Наиболее значимыми параметрами для определения тяжести РА являются выраженность деструктивных изменений в суставах и степень стойкой утраты функциональной способности суставов вплоть до утраты больным способности к самообслуживанию.
Большое количество рандомизированных клинических исследований (РКИ) было посвящено выявлению наиболее эффективных терапевтических стратегий в лечении больных РА: сравнивались результаты лечения при последовательной монотерапии БПВП, при их комбинации как в дебюте болезни (стратегия step-down), так и присоединение второго, третьего препаратов при неэффективности первого средства (стратегия step-up).
Оценка в сравнительном аспекте эффективности монотерапии метотрексатом, сульфасалазином, антималярийными препаратами, циклоспорином А, лефлуномидом и их комбинаций [11, 12, 13, 14, 15, 16, 17, 18] не показала однозначного преимущества комбинированной терапии БПВП перед их применением в виде монотерапии. В ряде исследований было показано, что через 6, 12 и 24 месяца клинический эффект был более выражен при использовании комбинации БПВП (либо при step-up, либо при step-down стратегии) [14, 16, 19, 20, 21, 22, 23], по данным других авторов [24, 25] не отмечено достоверных отличий во влиянии на показатели активности монотерапии или комбинации БПВП. При продлении срока исследований (до 5 лет) преимущества во влиянии на активность РА комбинации БПВП перед монотерапией не отмечено [11, 23, 24]. Оценка рентгенологических изменений в суставах через 1–2 года не показала преимуществ комбинированного лечения в исследовании MASCOT [16], а комбинация циклоспорина А и метотрексата в двух исследованиях через 6 [26] и 12 [27] месяцев в большей степени подавляла прогрессирование деструкции, чем монотерапия метотрексатом. В исследовании FIN-RACo изменение счета Ларсена было достоверно меньше при использовании комбинации БПВП через 2 года [14], но через 5 лет достоверных различий между комбинированной терапией и монотерапией уже не отмечалось [15].
Весьма интересны данные, полученные в результате исследования TICORA [12, 28], которое сравнило результаты 18-месячного лечения двух групп больных РА: в 1-й группе лечение проводилось со строгим ежемесячным контролем изменения активности РА по DAS (tight-контроль) и в соответствии с динамикой DAS корригировалась терапия («интенсивная» группа). Во 2-й группе лечение проводилось «рутинным способом» без такого жесткого контроля. К концу исследования ремиссия была достигнута у 65% больных 1-й группы и только у 16% больных 2-й группы. Увеличение числа эрозий было меньше в 1-й группе. Контролируемое лечение («интенсивная» группа) сопровождалась более частой коррекцией терапевтической тактики (использование комбинации БПВП, эскалация их дозы, использование внутрисуставных введений глюкокортикоидов). Авторы при анализе этих результатов пришли к выводу, что контроль за лечением обеспечивает наилучшие результаты вне зависимости от выбора БПВП. Такой же вывод сделан Albers J. M. и соавт. [29] при оценке результатов четырех различных режимов использования БПВП: жесткий контроль за успешностью лечения обеспечивает сходные результаты терапии различными БПВП. При оценке лечения метотрексатом пациентов с ранним РА (длительность болезни < 1 года) в исследовании CAMERA [17, 18] также сделан вывод, что строгий ежемесячный контроль динамики активности болезни (tight-контроль) и своевременная коррекция терапии позволяют добиться достоверно лучшего результата за период 2-летнего наблюдения. Так, в группе интенсивного контроля (n = 76) частота ремиссий составила 50%, а при рутинном способе лечения (n = 55) — 37% (p = 0,03) [18]. Эти данные подтверждают и наше мнение, основанное на результатах более длительного открытого исследования эффективности базисной терапии у 240 больных: улучшение функционального, рентгенологического и жизненного исходов РА зависит не только от сроков начала лечения, но и от степени обеспечения постоянного контроля за ходом лечения [9].
Даже при грамотном подходе к лечению больных РА классическими БПВП (раннее начало терапии и постоянный контроль за степенью подавления активности и прогрессирования болезни) тяжелый вариант болезни все же развивается. По нашим данным и данным литературы у 15–25% больных последовательно назначаемые БПВП не приводят к развитию выраженного эффекта (хороший эффект по критериям EULAR либо более чем 50% улучшение по критериям ACR) либо приводят к развитию побочных реакций и необходимости их отмены. Создание генно-инженерных биологических препаратов (ГИБП) позволило в значительной степени оптимизировать лечение больных РА.
В настоящий момент в Российской Федерации зарегистрированы два блокатора фактора некроза опухоли альфа (ФНО-альфа) — инфликсимаб (Ремикейд) и адалимумаб (Хумира) и препарат ритуксимаб (Мабтера), связывающий CD20 B-клеток. Ингибиторы ФНО-альфа продемонстрировали свои преимущества перед монотерапией метотрексатом как при раннем [30, 31], так и при развернутом РА [32, 33] (
,
). Ремиссия (по критериям EULAR) при раннем РА по данным исследования ASPIRE развивалась у 15% больных, получавших метотрексат, и у 21,2% больных, получавших комбинацию инфликсимаба и метотрексата (p = 0,065), и по данным исследования PREMIER у 21% больных при терапии метотрексатом и у 43% — при комбинации адалимумаба и метотрексата (p < 0,001). Еще большее различие в эффективности классических БПВП и ГИБП заметно при развернутом РА, когда достижение 70% улучшения по критериям ACR либо не отмечается при назначении метотрексата (исследование ATTRACT), либо отмечается у незначительного количества больных (4,8%) (по данным исследования ARMADA). При использовании его в комбинации с инфликсимабом [32] или адалимумабом [33] 70% улучшение было отмечено у соответственно 53% и 67%. Оба ингибитора ФНО-альфа начинают действовать в первые недели от начала лечения, обладают выраженным противовоспалительным эффектом и способны подавлять деструкцию в суставах (
, 6).
Лечение ритуксимабом проводится при неэффективности ингибиторов ФНО-альфа, хотя препарат может использоваться как первый биологический агент. Повторные курсы ритуксимаба не менее эффективны, чем первый. При этом не зарегистрировано нарастания числа инфузионных или других нежелательных реакций.
В соответствии с общеевропейским обновленным консенсусом по биологическим препаратам в лечении ревматических болезней [34] (в скобках представлен уровень доказательности):
- нет доказательств, что какой-либо блокатор ФНО эффективнее других препаратов из этой группы и должен использоваться первым (А, B);
- возможно переключение с одного блокатора ФНО на другой, но двойных слепых исследований не проводилось (В, D);
- может наблюдаться потеря клинического эффекта, при этом недостаточный ответ на один блокатор ФНО не исключает развитие хорошего ответа на другой (В, D);
- при первичной неэффективности одного препарата хороший ответ на другой менее вероятен (B);
- при непереносимости одного из блокаторов ФНО риск непереносимости второго увеличивается (В, D);
- оптимальная схема лечения больных, не отвечающих на блокаторы ФНО, пока не разработана (А);
- блокаторы ФНО замедляют или прекращают рентгенологическое прогрессирование при РА даже у некоторых пациентов, не ответивших на лечение по клиническим параметрам (А).
Учитывая высокую стоимость лечения ГИБП, вопрос отбора больных для биологической терапии представляется важным. Как было показано в исследовании BEST [13], при неэффективности двух последовательно назначенных классических БПВП дальнейшее использование других БПВП не приводит к развитию эффекта. Поэтому во многих странах Европы одним из критериев отбора больных для назначения ГИБП является неэффективность двух БПВП. Однако существуют и другие факторы риска быстрого прогрессирования болезни в ранние сроки, среди них обсуждаются следующие:
- начало РА в молодом возрасте;
- наличие более четырех припухших суставов;
- счет DAS ≥ 4,21;
- наличие эрозий на рентгенограммах или при магнитно-резонансной томографии (МРТ) в первые месяцы болезни;
- повышение С-реактивного белка (СРБ) более 0,6 мг/дл;
- повышение СОЭ более 28 мм/ч.
Было показано, что при применении метотрексата у больных с высоким уровнем и СОЭ и СРБ сохраняется очень высокий риск прогрессирования, при повышении одного из этих двух лабораторных параметров — сохраняется высокий риск прогрессирования, а при снижении СОЭ и СРБ до нормальных цифр все равно сохраняется средний риск прогрессирования. И только присоединение биологического агента способно уменьшить риск прогрессирования до низкого [35]. Однако классические БПВП способны в дебюте РА оказать выраженный эффект и подавить рентгенологическое прогрессирование деструкции у значительного количества пациентов. В нашей практике больным с установленным диагнозом РА сразу назначается метотрексат или лефлуномид, при наличии противопоказаний к ним обсуждается индивидуально выбор базисного средства. Далее пациент наблюдается ежемесячно до развития выраженного эффекта. При использовании метотрексата или лефлуномида эффект начинает появляться через 4–6 недель, если в эти сроки эффект не стал проявляться, то увеличивается доза метотрексата, а вопрос о продолжении лечения лефлуномидом решается индивидуально. В течение первых 3–4 месяцев лечения должно быть установлено, развивается ли эффект, какова его выраженность. Такой контроль за степенью подавления активности приводит к быстрой коррекции терапии, если она требуется. При развитии 50% (и более) улучшения далее в течение первого года терапии оценивается, есть ли подавление прогрессирования эрозивного артрита. Недостаточный противовоспалительный эффект или появление новых эрозий в суставах кистей и стоп, развитие деструкции крупных суставов, сохранение внесуставных проявлений должны приводить к изменению терапии: смена БПВП, комбинация БПВП или их комбинация с ГИБП. Увлечение симптоматической терапией, стремление подавления активности при помощи частых внутрисуставных или внутривенных введений глюкокортикоидов при отсутствии достаточного и стабильного эффекта БПВП не предупреждают развития тяжелого варианта РА. Эти мероприятия могут быть только дополнением к лечению БПВП, но не заменять его.
Таким образом, для предупреждения утраты функции больных РА, т. е. для предупреждения формирования тяжелого варианта болезни, врач должен обеспечить следующее:
- раннее назначение БПВП всем больным РА;
- провести обучение больного с объяснением целей терапии, необходимости длительного (многомесячного и многолетнего) лечения, необходимости проводить мониторинг переносимости препаратов;
- проведение постоянного контроля за степенью подавления активности и прогрессирования болезни с объективной оценкой количественной выраженности суставного синдрома и деструктивных изменений в суставах, за переносимостью терапии;
- при неэффективности двух последовательно назначенных БПВП поставить вопрос о необходимости назначения ГИБП.
Для объективного контроля за активностью РА на каждом этапе лечения врач должен регистрировать число болезненных и число припухших суставов, выраженность боли по оценке больного, общее состояние по оценке больного и врача с использованием визуальной аналоговой шкалы, а также лабораторные параметры (СОЭ и СРБ). Динамика этих показателей будет объективной оценкой успешности (или неуспешности) проводимой терапии и будет способствовать быстрой коррекции лечения.
Литература
- Балабанова Р. М. Руководства по внутренним болезням, 1997, гл.9, стр. 257–294.
- Goodson N., Symmons D. Rheumatoid arthritis in women: still associated with increased mortality. Ann. Rheum. Dis., 2002,61: 955–956.
- Riise T., Jacobsen B. K., Gran J. T. et al. Total mortality is increased in rheumatoid arthritis. A 17-year prospective study // Clin. Rheum., 2002, 20: 123–127.
- Nielen M. M., van Schaadenburg D., Reesnik H. W. et al. Specific autoantibodies precede the symptoms of rheumatoid arthritis: A study of serial measurement in blood donors // Arthr. Rheum., 2004, v. 50: 380–386.
- Шехтер А. Б., Крель А. А., Чичасова Н. В. Клинико-морфологические сопоставления при различных вариантах ревматоидного артрита (по данным пункционных биопсий синовиальной оболочки) // Терапевтический архив, 1985, № 8, 90–100.
- Emery P., Breedveld F., Dougados M. et al. Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of a clinical guide // Ann. Rheum. Dis., 2002, v. 61: 290–297.
- Zatarain E., Strand V. Monitoring disease stativity of rheumatoid arthritis in clinical practice: contributions from clinical trials // Nature Clinical Practice Rheumatology, 2006, v. 2, № 11: 611–618.
- Чичасова Н. В. Лечение различных вариантов течения ревматоидного артрита // Моск. мед. журнал, 1997, № 1, 21–26.
- Kanevskaya M. Z., Chichasova N. V. Treatment of early rheumatoid arthritis: influence on parameters of activity and progression in long-term prospective study // Ann. Rheum. Dis., vol. 672, Suppl. 1, 2003, p. 179 (Annual European Congress of Rheumatology, EULAR 2003, Abstracts, Lisbon, 18–21 June 2003).
- Han C., Smolen J. S., Kavanaugh A. et al. Impact of disease duration and physical function on employment in RA and PsA patients // Arthr. Rheum., 2006, v. 54, Suppl. P. S54.
- Maillefert J. F., Combe B., Goupille P. et al. Long-term structural effects of combination therapy in patients with early rheumatoid arthritis: five-year follow up of a prospective double blind controlled study // Ann. Rheum. Dis., 2003, v. 62: 764–766.
- Grigor C., Capell H., Stirling A. et al. Effect of treatment strategy of tight control of rheumatoid arthritis (the TIСORA study): a single-blind randomised controlled trial // Lancet, 2004, v. 364: 263–269.
- Goecor-Ruiterman Y. P., de Vries-Bouwstra J. K., Allaart C. F. et al. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeST study): a randomised, controlled trial // Arthr. Rheum., 2005, v. 52: 3381–3390.
- Mottonen T., Hannonen P., Leirisalo-Repo M. et al. Comparison of combination therapy with single drug in early rheumatoid arthritis: a randomised trial. FIN-RACo Group // Lancet, 1999, v. 353: 1568–1573.
- Korpela M., Laansonen L., Hannonen P. et al. Retardation of joint damage in patients with early rheumatoid arthritis by initial aggressive treatment with disease-modifying antirheumatic drugs: five-year experience from FIN-RACo study // Arthr. Rheum., 2004, v. 50: 2072–2081.
- Capell H., Madhok R., Porter D. et al. Combination therapy with sulphasalazine and methotrexate is more effective than either drug alone in rheumatoid arthritis (RA) patients with a suboptimal response to sulphasalazine: result from the double-blind placebo controlled MASCOT study // Ann. Rheum. Dis., 2007,v. 66: 235–241.
- Bijlsma J. W., Weinblatt M. E. Optimal use of the methotrexate: the advantages of tight control // Ann. Rheum. Dis., 2007, v. 66: 1409–1410.
- Verstappen S. M. M., Jacobs J. W., van der Veen M. J. et al. Intensive treatment with methotrexate in early rheumatoid arthritis: aiming for remission. Computer Assisted Management in Early Rheumatoid Arthritis (CAMERA, an open-label strategy trial) // Ann. Rheum. Dis., 2007, v. 66: 1443–1449.
- Haagsma C. J., van Riel P. L., de Jong A. J., van de Putte L. B. Combination of sulphasalazine and methotrexate versus methotrexate alone: a randomised open clinical trial in rheumatoid arthrits patients resistant to suylphasalasine therapy // Dr. J. Rheum., 1994,v. 33: 1049–1055.
- Dougados M., Combe B., Cantagrel A. et al. Combination therapy in early rheumatoid arthritis: a randomised, controlled double-blind 52 week clinical trial of sulphasalazine and methotrexate with the single components // Ann. Rheum. Dos., 1999, v. 58: 220–225.
- Stein M. et al. Combination treatment of severe rheumatoid arthritis with cyclosporine and methotrexate for forty-eight weeks. An open-label extension study // Arthr. Rheum., 1997, v. 40: 1843–1851.
- Kremer J. et al. Concomitant leflunomide therapy in patients with active rheumatoid arthritis despite stable doses of methotrexate. A randomised, double-blind, placebo-controlled trial // Ann. Int. Med., 2003, v. 137: 726–733.
- Kremer J. et al. Combination leflunomide and methotrexate therapy for patients with active rheumatoid arthritis failing methotrexate therapy: open label extension of a randomised, double-blind placebo controlled trial // J. Rheum., 2004, v. 31: 1521–1531.
- Haagsma C. J., van Riel P. L., de Jong A. J., van de Putte L. B. Combination of sulphasalazine and methotrexate versus the single components in early rheumatoid arthritis: a randomsed, controlled, double-blind, 52 week clinical trial // Br. J. Rheum., 1997, v. 36: 1082–1088.
- Hider S. L., Silman A. J., Bunn D. et al. Comparing the long term clinical outcome between methotrexate and sulphasalazine prescribed as the first disease modifying antirheumatic drugs in patients with inflammatory polyarthritis //Ann. Rheum. Dis., published online15 March 2006.
- Garards A. et al. Cyclosporine A monotherapy versus cyclosporine A and methotrexate combination therapy in patients with early rheumatoid arthritis: a double blind randomised placebo controlled trial // Ann. Rheum. Dis., 2003, v. 62: 291–296.
- Marchesoni A. et al. Radiographic progression in early rheumatoid arthritis: a 12-month randomised controlled study comparing the combination of cyclosporine A and methotrexate with methotrexate alone // Rheum., 2003, v. 42: 1545–1549.
- Porter D. Targeting persistent disease activity in early RA: a commentary on the TICORA trial // Int. J. Adv. Rheum., 005,v. 3: 2–6.
- Albers J. M., Paimela L., Kurki P. et al. Treatment strategy, disease activity, and outcome in four cohort of patients with early rheumatoid arthritis // Ann. Rheum. Dis., 2001, v. 60, 453–458.
- St. Clair E. W., van der Heijde D. M., Smolen J. S. et al. Combination of infliximab and methotrexate therapy for early rheumatoid arthritis: A randomized, controlled trial // Arthritis Rheum 2004, 50: 3432–3442.
- Breedveld F. C., Weissman M. H., Kavanaugh A. F. et al. The PREMIER study: A multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early aggressive rheumatoid arthritis who had or not had previous methotrexate treatment // Arthritis Rheum, 2006, 54: 26–37.
- Maini R. N., Breedveld F. C., Kalden J. R. et al. Sustaind improvement over two years in physical function, structural damage, and signs and symptoms among patients with rheumatoid arthritis treated with infliximab and methotrexate // Arthr. Rheum., 2004, v. 50: 1051–106.
- Weinblatt M. E., Keystone E. C., Furst D. E. et al. Adalimumab, a fully human anti-tumor necrosis factor a monoclonal antibody for the treatment of rheumatoid arthritis patients taking concomitant methotrexate: the ARMADA trial // Arthr. Rheum., 2003, v. 48: 35–45.
- Furst D. E., Keystone E. C., Kirkham B. et al. Update consensus of biological agents for the treatment of rheumatic diseasis, 2008 // Ann. Rheum. Dis., 2008, v. 67: iii2–iii25.
- Smolen J., Van der Heijde D. M., StClair E. W. et al. Prediction of joint damage in patients with rearly rheumatoid arthritis treated with high-dose methotrexate with or without concomitant infliximab: Results from ASPIRE trial // Arthritis Rheum., 2006;v. 54: 702–710.
- Smolen J. S., Aletaha D. Patients with rheumatoid arthritis in clinical care // Ann. Rheum. Dis., 2004, v. 63: 226–232.
Н. В. Чичасова, доктор медицинских наук, профессор Г. Р. Имаметдинова, кандидат медицинских наук Е. В. Иголкина С. А. Владимиров ММА им. И. М. Сеченова, Москва
Возможно ли полное излечение от ревматоидного артрита?
В настоящее время излечение от РА, т.е. отсутствие болезни без необходимости приема лекарственных средств, встречается очень редко. Обычно после прекращения приема БМАРП заболевание рецидивирует. Доступные методы лечения все чаще позволяют достичь ремиссии заболевания и нормально функционировать. К сожалению, у части пациентов (около 10–20 %), несмотря на лечение, заболевание прогрессирует. Ремиссия часто бывает у женщин во время беременности, однако болезнь обычно обостряется в течение 3 месяцев после родов.
РА по прежнему связан с частым ограничением дееспособности — по оценкам, через 5 лет около половины пациентов теряют работоспособность, а через 10 лет — почти все. Больные живут на несколько лет короче по сравнению с общей популяцией, в основном из-за осложнений атеросклероза. Вероятно, благодаря более раннему выявлению РА и все более эффективному лечению, эти статистики улучшатся в будущем.
Что следует делать после окончания лечения ревматоидного артрита?
РА является хроническим заболеванием, которое требует постоянного ревматологического контроля. В начале заболевания и во время его обострений обязательными являются частые визиты к врачу (в среднем каждые 1–3 месяца), чтобы определить соответствующие дозы лекарств и достичь ремиссии заболевания. Во время стабильного периода посещения могут быть менее частыми (обычно каждые полгода).
Активность и прогрессирование заболевания оценивают на основании степени тяжести клинических симптомов (количество пораженных суставов, оценка тяжести боли, шкалы оценки качества жизни) и результатов лабораторных исследований (СОЭ, CРБ, общий анализ крови) и визуализирующих (РГ кистей и стоп). Важным является диагностирование побочных эффектов лекарств, в том числе оценка функции почек, печени и костного мозга, и периодические осмотры на наличие сопутствующих заболеваний (УЗИ брюшной полости, РГ грудной клетки, маммография, гинекологический контроль). В связи с ускоренным развитием атеросклероза необходима оценка риска сердечно-сосудистых заболеваний и, при необходимости, соответствующие профилактика и лечение.
Следует также помнить о соответственно раннем лечении остеопороза, чтобы снизить риск перелома костей. Кроме посещений ревматолога пациент должен учавствовать в целенаправленных реабилитационных занятиях и выполнять рекомендованные упражнения дома.
Советы ревматолога пациентам с ревматическими заболеваниями
Вспыхнувшая пандемия коронавируса COVID-19 неизбежно спровоцировала беспокойство и ряд вопросов у пациентов с ревматическими заболеваниями. Ревматических болезней более 150. Сегодня руководитель Городского ревматологического центра им. профессора И.Г. Салихова Равия Гаязовна Мухина подготовила рекомендации своим пациентам.
— Кого касаются Ваши рекомендации?
— Наши рекомендации, в первую очередь, предназначены пациентам с воспалительными ревматическими заболеваниями, и меньше всего пациентам с заболеваниями опорно-двигательного аппарата (это заболевания позвоночника, то есть боли в спине не воспалительной природы, остеоартритом, фибромиалгией, остеопорозом, хронической подагрой).
А воспалительные ревматические заболевания, прежде всего это ревматоидный артрит, системные васкулиты, системная красная волчанка, системная склеродермия, болезнь Бехтерева (анкилозирующий спондилит), дерматополимиозит. Конечно же, это не все аутоиммунные воспалительные заболевания.
— Какие противоревматическе препараты должны быть в фокусе внимания как пациентов, так и врачей?
— Именно этих пациентов, принимающих иммуносупрессивные (подавляющие активность иммунной системы) препараты, такие как генно-инженерные биологические препараты (ГИБП), ингибиторы янус-киназ, глюкокортикоиды (стероиды, гормональные, таблетки, внутрисуставные инъекции) и базисные противовоспалительные препараты, например метотрексат (таблетки и подкожные инъекции) , лефлуномид (таблетки), азатиоприн (таблетки), циклофосфамид (таблетки и внутривенные инфузии), сульфасалазин (таблетки) волнуют вопросы относительно коронавирусной инфекции.
Вышеуказанные иммуносупрессивные препараты, назначенные Вам ранее врачом-ревматологом, необходимы для снижения активности (клинической в первую очередь, в виде снижения боли, отеков в суставах, увеличения объёма движений, нормализации температуры тела и лабораторной в виде снижения уровня повышенных СОЭ, СРБ, повышения сниженного гемоглобина и т.д.) и предотвращения обострения Вашего заболевания. А необоснованный перерыв в приёме этих лекарственных препаратов может привести к резкому ухудшению состояния.
— Влияют ли эти препараты на возможную коронавирусную инфекцию?
— Обоснованные рекомендации отсутствуют. Поэтому мы настоятельно советуем не прекращать лечение или не уменьшать дозировки принимаемых препаратов во время пандемии, если только этого не сделает ваш врач-ревматолог или терапевт по какой-либо конкретной причине.
— Кто наблюдает за состоянием пациента во время эпидемии?
— На время эпидемии в условиях самоизоляции выпадает плановый визит к врачу ревматологу. Встреча может быть перенесена на более благоприятное время без риска для пациента. У многих пациентов имеются номера телефонов врачей-ревматологов, которые знают особенности заболеваний, получаемой терапии, поэтому можно пользоваться любыми средствами связи. Исключение составляют врачи-ревматологи, работающие на сегодняшний день непосредственно в развернутых в республике инфекционных госпиталях. Кроме того, все терапевты поликлиники, к которой пациент прикреплен, владеют необходимыми знаниями и опытом ведения тяжелых пациентов, в том числе и ревматологических.
— Может ли воспалительное ревматическое заболевание повысить риск заражения коронавирусом?
— Да, с учетом того, что этот вирус быстро и легко распространяется среди здоровых людей, сам факт наличия воспалительного ревматического заболевания повышает возможность заражения коронавирусом, прежде всего при нарушении условий самоизоляции и требований к лечению.
— Как поступить, если появились признаки простудного заболевания (ОРЗ, ОРВИ)?
— Если у пациента повысилась температура, беспокоит кашель, имеются симптомы простудного заболевания (боль и першение в горле, немотивированная слабость, ознобы), нужно следовать действующим в республике рекомендациям по получению медицинской помощи на период эпидемии, обычно это обращение по телефону в поликлинику по месту прикрепления и вызов врача на дом.
Если у Вас положительный результат тестов на COVID-19, пожалуйста, не теряйтесь, сохраняйте спокойствие, по возможности, обсудите ситуацию с Вашим специалистом-ревматологом.
— Будет ли ухудшение течения ревматического заболевания, если заразиться коронавирусной инфекцией?
— Обострение возможно, как и при любой другой банальной вирусной инфекции, например, ОРВИ.
— Влияет ли наличие сопутствующих заболеваний при воспалительных ревматических заболеваниях на течение коронавирусной инфекции и не опасно ли это?
Нельзя исключить, что при тяжёлом ревматическом заболевании, особенно у пациентов пожилого возраста, или имеющих сопутствующие болезни (сахарный диабет, ожирение, повышение артериального давления, бронхиальную астму или другие заболевания лёгких), курильщики с длительным «стажем», так называемые, злостные курильщики, и также у тех пациентов, которые вынуждены по активности заболевания, по медицинским показаниям принимать одновременно несколько противовоспалительных препаратов и в высоких дозах, риск развития осложнений при коронавирусной инфекции может возрастать. Все ревматологи России и всего мира объединились в период пандемии в вопросах ведения пациентов с воспалительными ревматическими заболеваниями в сложных клинических ситуациях.
— А если у кого –то из членов семьи есть подозрение на коронавирусную инфекцию?
— В таких случаях, временно рекомендуем прекратить приём противоспалительных препаратов, за исключением гидроксихлорохина и глюкокортикоидов, примерно на 2 недели. Когда член Вашей семьи выздоровеет или диагноз не подтвердится, можно возобновить лечение.
— А если я заражусь коронавирусом?
— Наш совет временно прекратить прием любых базисных противовоспалительных препаратов, кроме гидроксихлорохина и глюкокортикоидов примерно на 2 недели. И без крайней необходимости следует временно избегать внутрисуставного введения глюкокортикоидов.
— Нужно ли применять особые меры предосторожности на период пандемии, если уже принимаю длительное время противовоспалительные препараты?
— Да, конечно! Соблюдение простейших мер предосторожности поможет сохранить здоровье Вам, членам вашей семьи и близким!
· Регулярно мойте руки с мылом, делайте это тщательно, не менее 20 секунд. Затем вытрите руки насухо.
· Избегайте прикосновений к лицу.
· Когда кашляете или чихаете, прикрывайтесь локтем или бумажной салфеткой/платком; использованную салфетку следует сразу же выбросить.
· Используйте одноразовые салфетки.
· Носите маску, меняя её каждые 2 часа. Маска не может гарантированно предотвратить распространение вируса, но она поможет вам избежать неосознанных и нежелательных прикосновений к лицу.
· Соблюдайте разумную дистанцию в местах скопления людей, особенно с теми, кто кашляет и чихает, то есть, может быть болен.
· Избегайте рукопожатий и объятий при встрече, придумайте безопасный способ приветствия.
· Старайтесь не использовать (загруженный) городской транспорт и избегать мест с большим скоплением людей.
· Не предпринимайте ненужных поездок в период эпидемии.
Главное требование и убедительная просьба к Вам, уважаемые наши ревматологические пациенты – строго соблюдайте режим самоизоляции! Этим Вы защитите себя и поможете нам, Вашим врачам, медсёстрам, санитаркам!
Всегда и вместе сохраняем оптимизм и только уверенность в выздоровлении!