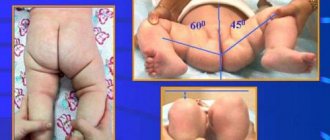
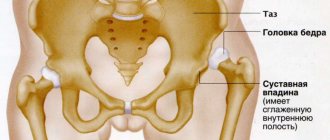
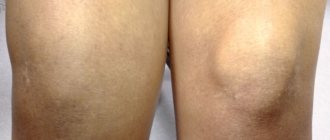
Что такое остеопороз коленного сустава
При остеопорозе коленного сустава симптомы неочевидны на начальных этапах, но своевременное лечение помогает избежать дальнейшего развития патологии. Заболевание проявляется в деформации тканей и суставов. Болезнь может поражать как костную систему в общем, так и отдельные части. Коленные суставы перестают быть эластичными, что приводит к сильным спазмам при ходьбе. Несвоевременное выявление недуга грозит необратимыми последствиями. Деформация костей может сделать человека инвалидом.
Переломы случаются неожиданно, остеопороз подкрадывается незаметно
Поговорив о причинах остеопороза, необходимо разобраться в формах его проявления. Основная ошибка многих врачей кроется в том, что зачастую они принимают за проявления остеопороза симптомы других болезней. В действительности остеопороз проявляется незначительными симптомами с почти полным отсутствием жалоб, очень часто заболевание выявляется только при наличии переломов. Такая особенность болезни дала ученым повод назвать остеопороз «молчаливой эпидемией». Конечно, и при остеопорозе бывают боли в спине, но это ноющие боли «усталости», возникающие только после относительно длительного (больше 30 минут) нахождения в одной статической позе, — стоя или сидя. К другим косвенным признакам болезни относятся старческая сутулость (горб), ночные судороги ног, повышенная утомляемость, пародонтоз, хрупкость ногтей и преждевременное поседение. И хотя наличие этих симптомов не является стопроцентным подтверждением диагноза, оно всё-таки позволяет определить круг исследований, необходимых для его уточнения.
Причины возникновения болезни и факторы риска
Вызвать остеопороз коленного сустава могут различные факторы. Чаще всего появление болезни связано с низким содержанием кальция в организме. Кальций способствует образованию оксиапатов, которые участвуют в формировании костной ткани. При падении уровня кальция возрастает риск развития остеопороза. Нехватка цинка, фосфора, витаминов Д и В приводит к развитию болезни. Причиной нехватки этих элементов может быть нарушение усвояемости организмом. К появлению боли в области колена приводят хронические болезни, злоупотребление алкоголем, лишний вес, а также некоторые медикаменты.
Диагностика
При появлении признаков заболевания нужно обратиться к врачу-терапевту, ревматологу или травматологу.
При осмотре можно выявить укорочение конечности с поврежденным суставом.
Врач проведет осмотр, и назначит комплекс обследований:
- Денситометрия костной ткани для оценки ее плотности. Этот метод позволяет, и оценить эффективность терапии.
- Рентгенография суставов в двух проекциях. При остеопорозе на рентгенограмме присутствуют следующие признаки: повышенная прозрачность костной ткани;
- наличие выростов костной ткани в виде шипов на суставных поверхностях костей;
- переломы костей рядом с суставами.
Также необходимо сдать анализ крови для
- определения уровня кальция в крови;
- определения уровня женских гормонов (эстрогена), гормонов щитовидной железы.
При подозрении на вторичную природу заболевания проводят полное обследование для исключения заболеваний, приводящих к остеопорозу.
Стадии развития остеопороза коленного сустава
Для остеопороза коленного сустава характерны 3 стадии протекания заболевания, в соответствии с которыми специалист подбирает лечение:
- Первая степень заболевания – легкая, протекает бессимптомно. Обнаруживается вместе с другими заболеваниями или в ходе профосмотра.
- Вторая степень – умеренная. На этой стадии симптомы проявляют себя ярче. Происходит разрушение хрящевой ткани. Спазмы беспокоят в вечернее время.
- Третья степень – тяжелая. Пациент с этой формой заболевания фактически инвалид.
Первая степень
Симптоматика болезни на этой стадии, в отличие от остеопороза коленного сустава 2 степени, проявляется неярко. Пациента могут беспокоить:
- ломота в коленном суставе при смене погоды и высоких физических нагрузках, на этом этапе начинается разрушение структуры кости;
- спазмы после длительной ходьбы;
- ограниченность передвижения из-за спазмов;
- сужение суставной щели.
Вторая степень
Вторая стадия болезни протекает с очевидными симптомами, которые в сравнении с остеопорозом 3 степени коленного сустава, позволяют назначить подходящее лечение и предупредить необратимые последствия. На этом этапе человека беспокоят:
- спазмы утром и вечером;
- ограниченность движений в районе колена;
- возникновения хруста в суставе;
- деформация сустава становится видимой;
- синдром «суставной мыши», вызывающий сильные спазмы;
- на рентгене отмечается сильное сужение суставной щели, очевидны костные наросты.
Третья степень
Третья стадия заболевания наиболее опасная и может стать причиной инвалидности. Как лечить остеопороз коленного сустава, специалист определяет после выявления следующих признаков:
- увеличение сустава в размерах;
- постоянные спазмы;
- ограниченность движений;
- изменение формы ног у человека;
- атрофирование мышц возле колена;
- слышимый хруст при движениях;
- рентген показывает истирание хряща, разрушение связок.
Вкладыш тибиальный FREEDOM
Подробнее
Все эндопротезы коленного сустава
Классификация эндопротезов
Материалы для изготовления протеза коленного сустава для замены последнего: керамика, металлические сплавы, полиэтилен. В зависимости от особенностей конструкции эндопротезы делят на модели с подвижной и неподвижной платформой.
У протезов с подвижной платформой имеется вкладыш, способный вращаться в металлической части. Это дает дополнительную амплитуду при движении коленом после операции в медиальном, боковом направлении. В эндопротезах с неподвижной платформой элементы – часть большеберцового элемента и металлический компонент – прочно соединены между собой.
Другая классификация делит протезы коленного сустава на 3 типа.
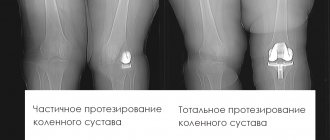
- Односторонний или одномыщелковый эндопротез. Применяется для частичной замены коленного сустава в его верхней части (протезирование участка на одном из мыщелков бедренной кости).
- Тотальный или двухсторонний протез коленного сустава (как правило, металлический). Используется для замены обеих частей соединения (покрываются оба мыщелка бедренной кости). Конструкция такого эндопротеза отличается от одномыщелкового более мощными креплениями в кость и увеличенной шириной.
- Тотальный эндопротез с осевой стабилизацией. Тоже применяется в операциях полной замены коленного сустава, когда его части (верхняя и нижняя) фиксируются длинными штифтами по продольным осям бедренной и большеберцовой костей. Штифты для надежной фиксации вбивают в пространство, заполненное костным мозгом (костномозговую полость).
Еще один признак классификации коленных протезов – способ их фиксации. Здесь 2 варианта: конструкции, устанавливаемые цементным и бесцементным методом. В первом случае при замене коленного сустава его искусственный аналог стабилизируют (закрепляют) медицинским цементом быстрого отверждения. При бесцементном способе фиксация осуществляется по мере врастания в имплантат костной ткани.
Протезы коленного сустава, фиксируемые цементным способом, более надежны и универсальны (используются в операциях по замене любого типа). Эндопротез для бесцементной установки имеет специальную поверхность – пористую, текстурированную (она обеспечивает возможность для кости врасти в имплантат).
Диффузный тип заболевания
Вторая стадия заболевания иначе называется «диффузный остеопороз». Типичным для этого этапа патологии является появление злокачественных опухолей. Кости сильно истончаются, но не всегда подвергаются перелому. Диагностируется у пациентов после 50 лет, однако может коснуться и детей. Причины у болезни разные:
- изменения гормонального фона;
- сбои в работе щитовидной железы;
- несбалансированное питание;
- наследственность.
Выявить диффузный тип болезни, также как и остеопороз 1 степени коленного сустава, можно с помощью рентгена, на котором заметно истончение костей. Своевременная диагностика позволяет предупредить потерю костной массы.
Взаимосвязь остеопороза и остеоартроза
Вопросы, касающиеся взаимосвязи между остеоартрозом (ОА) и остеопорозом (ОП), стали рассматриваться с конца 1960-х гг. Так, хирурги во время операций по поводу перелома шейки бедра у пациентов с ОП отметили, что у них практически отсутствуют признаки коксартроза [1]. Наличие ОА являлось протектором против возникновения переломов в проксимальном отделе бедра и позвоночнике. В клинической практике наличие этих двух заболеваний у одного больного считалось редкостью [2]. Ученые до сих пор не пришли к единому мнению относительно того, идет ли в данном случае речь о двух взаимоисключающих диагнозах или нет. Действительно ли наличие ОА является протективным признаком для развития ОП? Сегодня известно, что ОА и ОП являются очень распространенными заболеваниями опорно-двигательного аппарата у лиц пожилого возраста. Так, на долю ОА приходится более 75% от всех ревматических заболеваний, он наблюдается более чем у 50% лиц от 65 лет и старше, причем более чем у 1/3 из них развивается нарушение различных видов физической активности. Распространенность ОП в России среди пациентов в возрасте от 50 лет и старше составляет 30–33% среди женщин и 22–24% среди мужчин. Оба заболевания встречаются как у женщин, так и у мужчин, однако чаще регистрируются у женщин, особенно после наступления менопаузы. Так, ОА выявляется у каждой десятой женщины в возрасте от 50 лет, а к 75 годам — уже у каждой второй. Одна из трех женщин в климактерическом периоде и более половины лиц в возрасте 75–80 лет страдают ОП. Социальная значимость ОП определяется его последствиями — переломами позвонков и костей периферического скелета. Среди городского населения России у 24% женщин и 13% мужчин в возрасте от 50 лет и старше отмечается по крайней мере один клинически выраженный перелом. Частота остеопоротических переломов значимо повышается с возрастом, а распространенность переломов проксимального отдела бедренной кости растет экспоненциально.
Число ОП и ОА с возрастом увеличивается, поэтому наблюдающийся в последние десятилетия в развитых странах рост продолжительности жизни и, соответственно, увеличение в популяции доли пожилых людей, особенно женщин, ведет к нарастанию частоты этих заболеваний, превращая их в одну из важнейших проблем здравоохранения во всем мире.
Хотя и ОА, и ОП встречаются чаще среди лиц старших возрастных групп, тем не менее пациенты с этими заболеваниями имеют значительные антропометрические отличия (например, ОА обычно встречается у лиц с повышенной массой тела, а ОП, наоборот, у хрупких женщин), свидетельствующие о том, что эти два заболевания обусловлены разными процессами (табл.) [3, 4].
В течение последних 30 лет были опубликованы результаты более 40 проводившихся с помощью различной измерительной техники исследований, в ходе которых изучалось влияние ОА на минеральную плотность костной ткани (МПКТ) в различных областях скелета. Авторы большинства из этих работ выявили значимо более высокие показатели МПКТ у больных с ОА — по сравнению с контрольной группой. Однако имеются исследования, в ходе которых не было обнаружено повышения МПКТ и даже отмечалось ее снижение. Противоречия в полученных данных можно отнести за счет различий в выборе лиц для обследования, измерения МПКТ в разных областях скелета, использования различной измерительной техники и разных методов оценки результатов [2].
В 1995 г. было проведено первое большое одномоментное эпидемиологическое исследование [5], в ходе которого оценивалась ассоциация между рентгенологическими признаками коксартроза и МПКТ проксимального отдела бедра и позвоночника, измеренной с помощью двойной рентгеновской абсорбциометрии, у 4855 женщин от 65 лет и старше. Было обнаружено, что пожилые белые женщины со средней и тяжелой формами рентгенологически выраженного коксартроза имели более высокие показатели МПКТ по всем параметрам — по сравнению с женщинами без коксартроза, при этом отмечалась корреляция генерализованного увеличения МПКТ с двухсторонним коксартрозом и выраженным остеофитозом.
В ходе Роттердамского (Rotterdam) проспективного исследования (1996) впервые изучалась взаимосвязь между рентгенологическим ОА, оцененным по критериям Kellgren и Lawrence, МПКТ в области шейки бедра и ее динамикой, скорректированной по возрасту и индексу массы тела (ИМТ). Исследование, в котором приняли участие 1723 человека, находившихся под наблюдением в течение 2 лет, продемонстрировало значимую связь коксартроза с высокой МПКТ и нарастание МПКТ с прогрессированием болезни [6].
Кроме того, исследования, проводившиеся на женщинах-близнецах, подтвердили обратную зависимость между ОА и ОП в области проксимального отдела бедра. Выраженный остеофитоз в тазобедренном суставе ассоциировался с 5–6-процентным увеличением МПКТ в данном суставе [7].
При ОА коленных суставов также определялась повышенная МПКТ в проксимальном отделе бедра и позвоночнике — по сравнению с показателями, наблюдавшимися у лиц без ОА [8, 9]. При этом было показано достоверное увеличение МПКТ позвоночника и шейки бедра при увеличении стадии гонартроза с 1-й к 4-й. Кроме того, в ходе проспективного исследования удалось продемонстрировать, что более высокие показатели МПКТ повышают риск развития рентгенологического ОА коленных суставов [10]. У лиц с ОА коленных и тазобедренных суставов МПКТ была выше на 3–8% по сравнению со здоровыми участниками исследования [6].
При ОА кистей данные по МПКТ в различных областях скелета противоречивы, значимые отклонения МПКТ выявлялись не всегда, особенно при наличии их изолированного поражения.
По данным Л. И. Алексеевой и соавторов [11], у женщин с ОП поясничного отдела позвоночника частота ОА коленных суставов и узелковой формы оказалась ниже, чем у пациенток с нормальными показателями МПКТ (53,3 и 38,9%; 78,6 и 53,6% соответственно, p < 0,05). При ОП шейки бедра реже диагностировалась узелковая форма ОА по сравнению с женщинами с нормальной МПКТ (25,9 и 47,8% соответственно, p < 0,05). Таким образом, эти данные подтверждают гипотезу, согласно которой более высокие показатели МПКТ ассоциируются с ОА.
Интерпретация результатов денситометрии при ОА позвоночника часто затруднена из-за наличия остеофитов, сужения межпозвонковых дисков, склероза фасетных суставов. Так, по данным Peel и соавторов [12], у женщин с ОА позвоночника МПКТ поясничного отдела была повышена на 7,9%, в шейке бедра — на 6,4%, а во всем теле — на 8,4%. Кроме того, исследование маркеров костного обмена показало, что у женщин с ОА позвоночника в возрасте 50–85 лет снижаются уровни маркеров как костеобразования, так и резорбции, т. е. костный обмен оказывается понижен, а следовательно, и потери МПКТ меньше, чем у женщин того же возраста без ОА.
Другие исследования демонстрируют активизацию процессов костеобразования, что также объясняет повышенную МПКТ у лиц с ОА. Противоречивость полученных результатов связана, возможно, с исследованием разных стадий заболевания. Так, ранние стадии характеризуются быстрыми процессами формирования, а на поздних стадиях происходит замедление костного обмена в субхондральной части кости, что может рассматриваться как вторичный процесс по отношению к разрушению хряща и уменьшению статической нагрузки.
Социальная значимость ОП определяется его последствиями — переломами позвонков и костей периферического скелета, обусловливающими значительный рост заболеваемости, инвалидизации и смертности среди лиц пожилого возраста и, соответственно, большие материальные затраты в области здравоохранения. Поэтому особый интерес представляет вопрос: приводит ли повышенная МПКТ, связанная с наличием ОА, к снижению риска развития переломов? Два популяционных контролируемых исследования, посвященных изучению переломов шейки бедра [13, 14], показали, что ОА ассоциировался со снижением риска данного перелома. В ходе другого исследования удалось доказать, что выраженный ОА тазобедренных суставов негативно коррелировал с компрессионными переломами позвонков. С другой стороны, по некоторым данным, несмотря на 5-процентное увеличение МПКТ у лиц с коксартрозом, у таких пациентов значимо выше риск переломов по сравнению с группой контроля. Авторы предположили, что повышенный риск переломов у лиц с ОА тазобедренных суставов, вероятнее всего, был связан с увеличением у данных больных риска падений — из-за нарушения локомоторной функции этих суставов. Лица с ОА позвоночника, однако, имели меньший риск переломов, в то время как значимых ассоциаций между ОА коленных суставов и ОА кистей и переломами выявлено не было [15].
В дальнейшем наблюдение за выборкой пожилых женщин, осуществлявшееся в течение более 7 лет, показало, что несмотря на более высокую МПКТ у лиц с ОА тазобедренных суставов и ОА кистей риск переломов как позвоночника, так и внепозвоночных, включая перелом шейки бедра, у таких пациентов не снижается.
Возможные механизмы взаимосвязи между ОА и МПКТ
Во многих клинических исследованиях, в ходе которых была выявлена негативная связь между ОА и ОП, на формирование патологического процесса оказывали влияние ожирение, расовая принадлежность, избыточная физическая активность, т. е. факторы, которые тем или иным способом способствуют нарастанию или сохранению массы кости, но при этом увеличивают риск развития ОА. Например, ожирение — фактор риска ОА коленных суставов — ассоциируется с увеличенной МПКТ. Физическая нагрузка в молодом возрасте имеет большое значение для достижения пика костной массы, однако чрезмерная физическая нагрузка и избыточный вес предрасполагают к развитию ОА в более старшем возрасте. Как известно, кость в большей мере, чем хрящ, ослабляет нагрузку, испытываемую суставом; при повышенных нагрузках она становится более плотной, что создает предпосылки для развития ОА. Эпидемиологические исследования показали, что ОА встречается чаще у африканцев и выходцев из Африки, чем среди белых людей, а распространенность ОП, наоборот, оказывается выше среди европиоидов. Причины таких расовых различий неясны, но костная масса у чернокожих лиц выше, а костный обмен протекает медленнее, что приводит к более высокому среднему возрасту тканей скелета.
В основе ОА лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц. В последние годы появилась теория, согласно которой происходящие в субхондральной кости изменения могут инициировать деградацию хряща. Одна из гипотез заключается в способности субхондральной кости продуцировать большое количество провоспалительных цитокинов и факторов роста, которые могут проникать в вышележащий хрящ и приводить к деградации хрящевой ткани.
Сведений о нормальном ремоделировании и скорости обмена в субхондральной кости у человека накоплено мало — из-за трудности получения образцов здоровой кости. Показано, что скорость ремоделирования снижается в местах, подвергающихся нагрузке, поскольку высокие уровни растяжения кости сдерживают образование новых участков костного обмена. Более низкая скорость ремоделирования ведет к увеличению среднего возраста ткани в областях, несущих нагрузку, и накоплению в них минерала.
Одним из основных патогенетических механизмов развития первичного ОП является дефицит эстрогенов. Однако некоторые эпидемиологические данные свидетельствуют о возможном участии эстрогенов в развитии ОА. Так, ОА встречается с примерно одинаковой частотой у мужчин и женщин в возрасте до 50 лет, тогда как после наступления естественной или хирургической менопаузы отмечается рост заболеваемости среди женщин. Также имеется ассоциация ОА с избыточной массой тела и ожирением, которые приводят к повышенной продукции эндогенных эстрогенов. Эстрогены регулируют обмен костной ткани, а увеличение костной массы, возникшее в результате их избытка, создает дополнительную механическую нагрузку на хрящ во время силового воздействия на сустав. Кроме того, эстрогены могут вызывать развитие ОА через цитокины и факторы роста. Например, цитокины интерлейкин-1 (ИЛ-1) и фактор некроза опухоли-a повышают выработку ферментов, разрушающих матрикс хряща. Инсулиноподобный фактор роста-1 (ИФР-1) стимулирует костеобразование, усиливая пролиферацию костных клеток и их дифференцировку. Трансформирующий фактор роста-β (ТФР-β) способен приводить к повышению синтеза коллагена за счет его возможности стимулировать образование остеобластов из их предшественников [16]. Поскольку эстрогены увеличивают в костной ткани концентрации ИФР-1 и ТФР-β, повысившееся под влиянием этих факторов костеобразование может определять связь между избыточным весом, увеличенной минеральной плотности ткани субхондральной кости и развитием ОА.
Кроме того, было выдвинуто предположение, что повышенная плотность кости при ОА может достигаться за счет снижения уровня колониестимулирующего фактора роста-1 (КСФ-1), который стимулирует остеокластогенез и регулирует активность остеокластов. Отсутствие КСФ-1 приводит к развитию остеопетроза у мышей, а повышенное его содержание в сыворотке крови было обнаружено у лиц с ОП.
В последние годы появились данные о том, что витамин D принимает участие в метаболизме не только костной, но и хрящевой ткани. В частности, было показано, что витамин D стимулирует синтез протеогликана хондроцитами, модулирует активность металлопротеиназ, принимающих участие в разрушении хряща. Так, например, снижение уровня 24,25(ОН)2- и 1,25(ОН)2-витамина D ассоциируется с увеличением активности металлопротеиназ, а нормализация их уровня снижает активность этих ферментов in vitro. Следует также подчеркнуть, что на ранней стадии ОА витамин D-зависимое нарушение метаболизма хряща может сопровождаться ремоделированием и утолщением субхондральной костной ткани. Это приводит к снижению амортизационной способности субхондральной кости и ускорению дегенеративных изменений в хряще. Было продемонстрировано, что у больных с гонартрозом снижение потребления витамина D и низкий уровень 25(ОН) витамина D в сыворотке крови ассоциируется с 3-кратным увеличением риска прогрессирования рентгенологических признаков ОА [3].
Дефицит витамина D влечет за собой увеличение синтеза паратиреоидного гормона, что приводит к стимуляции активности остеокластов и усилению костной резорбции. Помимо влияния на костные клетки, в исследованиях in vitro было показано, что паратиреоидный гормон способен усиливать пролиферацию хондроцитов в пластинке роста, а также оказывать дозозависимое стимулирующее действие на синтез коллагена и протеогликанов.
Приведенные выше данные свидетельствуют о вкладе различных факторов в формирование костной ткани и развитие ОА. В последние годы возрос интерес к изучению роли генетических факторов в развитии ОА и ОП. Так, было выявлено, что до 80% пика костной массы детерминируется генетически. Наиболее изученным является ген рецептора витамина D (VDR). В настоящее время имеются данные об ассоциации его полиморфизма не только с ОП, но и с ОА, особенно в развитии остеофитов. Полиморфизм гена ТФР-β также ассоциируется с ОП и остеофитозом позвоночника. Наиболее вероятная причина «альтернативных отношений» между ОП и ОА заключается, по-видимому, в генном полиморфизме. Исследование выборки близнецов показало, что МПКТ и ОА детерминируются в основном генетическими факторами, вариабельность которых может определять ряд антропометрических характеристик, увеличение синтеза факторов роста остеобластами и локальное ускорение костного обмена в суставе [4].
Лечение ОП представляет непростую задачу: оно должно быть длительным, поскольку эффект от его применения может проявиться спустя много времени. Целью лечения является замедление, по возможности прекращение потери костной массы, предотвращение переломов костей, а также улучшение состояния больного, уменьшение болевого синдрома и в целом улучшение качества жизни пациентов. Патогенетическая терапия ОП включает препараты, замедляющие костную резорбцию — бисфосфонаты, кальцитонин, эстрогены.
В России зарегистрирован препарат алендронат (фосамакс), который относится к азотсодержащим бисфосфонатам. В многоцентровых рандомизированных, двойных слепых, плацебо-контролируемых исследованиях алендронат в дозе 10 мг/сут показал высокую эффективность: повышая МПКТ во всех областях измерения от 5,4 до 13,7%, он достоверно снижал частоту переломов в позвоночнике на 47%, бедре — на 51–56%, предплечье — на 48%, а у 64% больных уменьшалось прогрессирование деформаций позвонков. В исследовании эффективности алендроната в дозе 70 мг 1 раз в неделю в сравнении с ежедневным приемом 10 мг было показано, что прирост МПКТ составил 6,8 и 7,4% соответственно в позвоночнике, 4,1 и 4,3% соответственно в бедре. Вместе с тем четко показано, что переносимость алендроната в дозе 70 мг 1 раз в неделю эквивалентна приему 10 мг в день, а на биопсийном материале костной ткани не выявлено признаков остеомаляции при обеих дозах препарата. Противопоказаниями для терапии алендронатом являются гиперчувствительность к препарату, гипокальциемия, наличие заболеваний пищевода.
Алендронат показал постоянный терапевтический эффект в течение 10 лет лечения. После прекращения терапии алендронатом у больных не наблюдалось повышения потерь в плотности костной ткани по сравнению с плацебо.
Алендронат назначают по 70 мг 1 раз в неделю либо по 10 мг ежедневно длительно, в течение 3–5 лет, однако точная длительность не определена.
Положительные результаты получены и в экспериментальных работах с использованием бисфосфонатов при ОА. Так, в эксперименте на модели ОА у крыс с рассечением передней крестообразной связки подтвержден хондропротективный эффект алендроната, а также его моделирующее действие на субхондральную кость: снижение резорбции на ранних стадиях после операции и предотвращение последующего повышения костеобразования начиная с 10-й недели после операции. Кроме того, отмечены уменьшение сосудистой инвазии в зону кальцифицированного хряща и дозозависимое ингибирование роста остеофитов.
Кальцитонин лосося (миакальцик) — это еще один препарат, используемый для лечения ОП и профилактики переломов, выпускается в двух формах: ампулах для инъекций по 100 МЕ и флаконах в виде назального спрея по 200 МЕ в 1 -й дозе.
В соответствии с рекомендациями для интраназального применения препарат в дозе 200 МЕ в день может вводиться непрерывно в течение 3–5 лет с учетом его эффективности либо циклическими курсами (2–3 мес лечения, 2–3 мес перерыв).
Единственным абсолютным противопоказанием к применению препаратов кальцитонина лосося является индивидуальная гиперчувствительность к препарату или способу его введения. Наиболее частым побочным эффектом при применении назального спрея кальцитонина является раздражение слизистой оболочки носа. Реже наблюдаются малые носовые кровотечения и другие назальные симптомы. В большинстве случаев, эти побочные реакции выражены в легкой или среднетяжелой форме и не требуют отмены препарата. При парентеральном введении препаратов кальцитонина побочные эффекты наблюдаются чаще: тошнота или рвота, приливы жара к лицу и кожная сыпь в месте инъекции. Серьезные осложнения при применении назальной или парентеральной формы кальцитонина отмечаются менее чем у 1% больных.
В течение последних лет стали проводиться работы по изучению влияния кальцитонина на течение ОА, что связано с возможностью вмешательства в метаболизм субхондральной кости, а также наличием у него хондропротективного действия.
Важным компонентом в механизме действия кальцитонина является его способность оказывать анальгетическое действие за счет как прямого центрального, так и периферического действия.
Доказано положительное влияние заместительной гормональной терапии (ЗГТ) на риск переломов при постменопаузальном ОП. Применение ЗГТ не только предотвращает потери костной массы у женщин в постменопаузе, но и увеличивает МПКТ у 95% женщин. Прирост костной массы в поясничном отделе позвоночника в среднем составляет от 2 до 6% за 12 мес. Отмечено, что эффект ЗГТ выше у женщин с более низкой исходной МПКТ и у тех, кто имел дополнительный фактор риска развития ОП, например длительно курил. В этом направлении была проведена серия многоцентровых исследований в США, и в частности исследование WHI (Women’s Health Jnitiative, 2003 г.), включавшее более 16 600 женщин в постменопаузальном периоде, получавших на протяжении более 5 лет ЗГТ (8506 человек) и наблюдавшихся в группе плацебо (8102 человека). Снижение риска переломов бедра отмечалось у 34%, позвоночника — у 34% и общих переломов — у 24% в группе лечения. Вместе с тем в группе получавших ЗГТ имело место повышение риска коронарной болезни сердца, инсульта, рака молочной железы (максимальный риск получен между 4-м и 5-м годом исследования), тромбоэмболий. В связи с указанными побочными эффектами ЗГТ их длительное применение для лечения ОП ограничено, вопрос о назначении и длительности ЗГТ решается индивидуально для каждой пациентки в зависимости от противопоказаний и возможного риска осложнений.
Влияние ЗГТ на риск возникновения и течение ОА остается до конца не изученным. Так, данные эпидемиологических проспективных исследований показали влияние ЗГТ в отношении рентгенологического прогрессирования ОА, в то время как их эффективность при манифестном ОА коленных и тазобедренных суставов оказалась менее значима.
Полученные предварительные результаты по применению противоостеопоротических препаратов для лечения ОА указывают на необходимость дальнейших исследований по изучению механизмов действия этих препаратов и выработке схем их использования.
Таким образом, анализ работ, посвященных изучению ОА и ОП, показал, что при ОА крупных суставов отмечается увеличение МПКТ по всем параметрам, однако при других формах ОА эта связь с МПКТ менее выражена. Не было получено достоверных доказательств снижения риска переломов у больных с ОА. Проспективные исследования показали, что более высокая МПКТ повышает риск развития ОА коленных суставов, при этом механизмы, приводящие к прогрессированию ОА, могут быть различными. Наличие повышенных уровней факторов роста в кости предрасполагает к деградации хряща и предохраняет от потери МПКТ. Как и при ОП, развитие ОА зависит от целого набора генов, а ассоциация этих заболеваний с разными аллелями одних и тех же генов может служить одной из причин того, что сочетанное возникновение ОП и ОА встречается достаточно редко.
Дальнейшее изучение этих двух широко распространенных заболеваний позволит проводить профилактические мероприятия, направленные на снижение риска развития как самих заболеваний, так и их осложнений, которые, в свою очередь, приводят к снижению как качества, так и продолжительности жизни.
Литература
- Byer P. D., Contepomi C. A., Farkas T. A. A post mortem study of the hip joint. Including the prevalence of the features of the right side//Ann. Rheum. Dis. 1970; 29(1): 15-31.
- Dequeker J. Inverse relationship osteoarthritis-osteoporosis: what is the evidence? What are the consequences?//Br. J. Rheumatol. 1996; 35: 813-820.
- Насонов Е. Л. Остеопороз и остеоартроз: взаимоисключающие или взаимодополняющие болезни?//Consilium medicum. 2000. № 2(6). С. 248-250.
- Алексеева Л. И. Остеоартроз и остеопороз/руководство по остеопорозу/под ред. Л. И. Беневоленской. М.: Бином, 2003. С. 482-502.
- Nevitt M. C., Lane N. E., Scott J. C., Hochberg M. C., Pressman A. R., Genant H. K. et al. Radiographic osteoarthritis of the hip and bone mineral density. The Study of Osteoporoti Fractures. Research Group//Arthritis Rheum. 1995; 38(7): 907-916.
- Burger H., van Daele P. L., Odding E., Valkenburg H. A., Hofman A., Grobbee D. E. et al. Association of radiographically evident osteoarthritis with higher bone mineral density and increased bone loss with age. The Rotterdam Study//Arthritis Rheum. 1996; 39(1): 81-86.
- Antoniades L., Macgregor A J., Matson M., Spector T. D. A cotwin control study of the relationship between hip osteoarthritis and bone mineral density//Arthritis Rheum 2000; 43(7): 1450-1455
- Hannan M. T., Anderson J. J., Zhang Y., Levy D., Felson D. T. Bone mineral density and knee osteoarthritis in elderly men and women. The Framinghem Study//Arthritis Rheum 1993; 36(12): 1671-1680.
- Hart D. J., Mootoosamy I., Doyle D. V., Spector T. D. The relationship between osteoarthritis and osteoporosis in the general population: the Chigford Study//Ann. Rheum. Dis. 1994; 53(3): 158-162.
- Zhang Y., Hannan M T., Chaisson C. E., McAlindon T. E., Evans S. R., Aliabadi P. et al. Bone mineral density and risk of incident and progressive radiographic knee osteoarthritis in women: the Framingham Study//J. Rheumatol. 2000; 27(4): 1032-1037.
- Алексеева Л. И., Беневоленская Л. И., Михайлов Е. Е., Смирнов А. В. Распространенность остеоартроза коленных суставов и суставов кистей среди лиц с различными показателями плотности костной массы: Тезисы Третьего Российского симпозиума по остеопорозу. СПб., 2000. С. 78.
- Peel N. F. A., Barrington J. A., Blumsohn A. et al. Bone mineral density ans bone turnover in spinal osteoarthritis//Ann. Rheum. Dis. 1995; 54: 867-871.
- Dequeker J., Johnell O. Osteoarthritis protects against femoral neck fracture: MEDOS study experience//Bone. 1993; 14: 51-56.
- Cumming R. G., Klineberg R. J. Epidemiological study of the relation between arthritis of the hip and hip fractures//Ann. Rheum. Dis. 1993; 52: 707-710.
- Arden N. K., Nevitt M. C., Lane N. E., Gore L. R., Hochberg M. C., Scott J. C. et al. Osteoarthritis and risk of falls, rates of bone loss, and osteoporotic fractures. Study of Osteoporotic Fractures Research Group//Arthritis. Rheum. 1999; 42(7): 1378-1385.
- Mansell J. P., Bailey A. J. Abnormal cancellous bone collagen metabolism in osteoarthritis//J. Clin. Invest. 1998; 101(8): 1596-1603.
Н. В. Торопцова, кандидат медицинских наук Институт ревматологии, Москва
Признаки заболевания
Болезнь может проявляться следующими признаками:
- реагирование суставов на погодные колебания;
- ночные судороги;
- расслаивание ногтевых пластин.
Если не обращать внимания на эти симптомы, то заболевание постепенно перейдет ко второй стадии и будет характеризоваться:
- регулярными болями;
- спазмами во время ходьбы;
- воспалительными процессами с отечностью коленной области;
- болью при прощупывании коленей.
При запущенной степени болезни:
- колено фактически не будет гнуться;
- суставы увеличиваются в размерах.
Как диагностировать
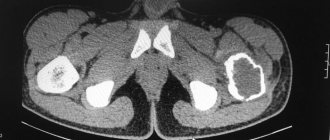
При первом посещении врач осмотрит и прощупает коленный сустав, чтобы определить причину болезни. Специалист может назначить прохождение следующих процедур:
- Рентген. Снимки позволяют определить наличие остеофитов, необратимые процессы в хрящах.
- Абсорбциометрия. Исследование колена с помощью двух рентген-лучей, выявляющих плотность костей и площадь опасных изменений.
- Биохимия крови. Позволяет определить сбои в обмене кальция, гормонов женской репродуктивной системы.
Иногда специалист отправляет пациента на прохождение МРТ для того, чтобы выявить характер изменений в костях.
Способы лечения
Лечение остеопороза коленного сустава занимает продолжительное время. После постановки диагноза врач назначит определенные медикаменты. Анальгетики снимают болевые ощущения. Кроме того, назначают нестероидные противовоспалительные лекарства. Они убирают спазмы и избавляют от очага воспаления. Хондропротекторы позволяют восстановить хрящевую ткань. Иногда назначаются внутрисуставные уколы. Правильно составленный рацион помогает в борьбе с заболеванием.
Консервативные методы лечения
На начальных этапах высокой эффективностью обладает медикаментозное лечение. Обычно назначают прием таких препаратов:
- обезболивающие и противовоспалительные (Диклофенак, Ибупрофен);
- кальцийсодержащие средства;
- фитоэстрогены (Диоскорея) для нормализации гормонального фона;
- бисфосфонаты (Бондронат, Золедронат) – тормозят выведение из организма кальция.
Специалист может назначить прием витаминов и уколов гиалуроновой кислотой. Вещество обладает смягчающим эффектом и способно восстановить работоспособность коленного сустава.
Народные средства
Народные средства эффективны на начальной стадии развития болезни. Назначаются в качества дополнения к основному курсу лечения:
- Компресс. 3 ложки яблочного уксуса перемешивают с одной ложкой меда. Наносят на ночь на пораженный участок и оборачивают лопухом, а затем тканью.
- Настой. Проварить в 200 мл воды одну ложку брусничных листьев. Подождать, пока остынет, и выпить в течение дня.
Остеопороз. Не дайте ему ни единого шанса!
Лекарственная терапия остеопороза в последние годы вышла на достаточно высокий уровень благодаря усилиям фармакологических компаний, ведущих активные изыскания в этой области. Выбор препаратов настолько велик, что объёмы статьи не позволяют рассказать обо всех лекарственных средствах, но один из них, тем не менее, упомянуть стоит – назальный аэрозоль Миакальцик. Систематическое употребление этого препарата препятствует разрушению костей, повышает плотность костной ткани и уменьшает риск возникновения переломов. Как уже было сказано выше, препараты кальция при остеопорозе нужно употреблять далеко не всегда. В первую очередь, необходимо принимать лекарства, помогающие этот кальций усвоить или подавить процесс вывода кальция из костей. Разработка новых препаратов для борьбы с остеопорозом ведётся постоянно, на фармакологическом рынке регулярно появляются новые лекарства, но, тем не менее, ничто не заменит здорового, активного образа жизни, правильного питания и занятий спортом. Итак, если вам уже за 50, вас беспокоят незначительные боли в спине и имеется предрасположенность к развитию остеопороза, не откладывайте визит к врачу, позаботьтесь о своем здоровье заранее. Обратившись в наш Центр, вы всегда можете рассчитывать на консультацию высококвалифицированного врача травматолога-ортопеда, необходимые исследования и получение грамотного лечения остеопороза. Скажите остеопорозу – нет!
Профилактика остеопороза коленного сустава
Профилактику заболевания нужно начинать в юном возрасте. Рекомендуется придерживаться следующих норм:
- вести активный образ жизни (велосипед, бег, гимнастика);
- придерживаться правильного питания (еда с необходимым содержанием кальция и минералов);
- отказаться от вредных привычек.
Необходимо регулярно проходить диагностику плотности костей. Наблюдение возрастных пациентов у врача позволит исключить риск переломов. Остеопороз коленного сустава – часто встречающееся заболевание. Побороть его одними лекарственными средствами не получится. Своевременное обращение к специалисту позволяет предупредить разрушение костей. Изменение образа жизни и правильное питание – залог эффективного лечения остеопороза.
Можно ли минимизировать риски
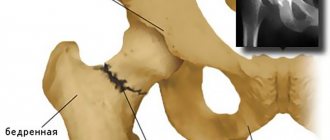
Да, это возможно. Чтобы избежать расшатывания протеза после операции, его фиксируют с помощью костного цемента. А для профилактики послеоперационной резорбции костной ткани больным назначают ряд препаратов. Такой подход позволяет свести к минимуму риск переломов и послеоперационной нестабильности компонентов эндопротеза.
Перелом вертлужной впадины показан синей стрелкой.
Эндопротезирование колен в Чехии: гарантии, цены, реабилитация, отзывы и статистика.
Узнать подробнее
Малоинвазивное эндопротезирование в Чехии: врачи, реабилитация, сроки и цены.
Узнать подробнее