Структура ФункцииПричиныСимптомыЛечениеПрепараты
Хрящевая ткань присутствует во многих органах, но наибольшим нагрузкам она подвергается в суставах. Хрящ покрывает уязвимые участки костей в суставах и обеспечивает амортизацию, а также устойчивость к нагрузкам, благодаря чему мы даже не задумываемся, какие испытания выпадают на долю суставов в жизни обычного человека, не говоря уже о категориях людей, подвергающих свой организм чрезмерным нагрузкам. К сожалению, хрящ со временем может разрушаться в силу различных причин, что приводит к ограничению движений в суставах, болям и дискомфорту. Поэтому так важно вовремя предпринимать необходимые меры для восстановления хрящевой ткани суставов.
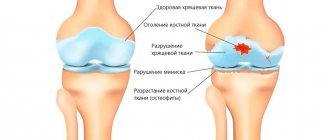
Структура хрящевой ткани
Хрящ — это разновидность соединительной ткани, и в организме существует три его вида:
- Гиалиновый (стекловидный) — имеет голубоватый цвет, с высоким содержанием тонких волокон коллагена, покрывает суставные поверхности костей;
- Эластический (сетчатый) — отличается повышенной упругостью и гибкостью, в нем преобладают волокна эластина, он формирует мелкие бронхи, ушные раковины;
- Волокнистый — соединяет сухожилия и связки с гиалиновым хрящом суставной поверхности.
Как и любая ткань, хрящевая состоит из клеток и межклеточного вещества (матрикса), доля последнего в ней значительно преобладает. Матрикс содержит много воды, которая не сжимается, не растягивается, при этом свободно циркулирует в межклеточном пространстве. Именно вода обеспечивает высокую упругость хрящевой ткани, распределяя нагрузки и амортизируя. Еще один важный компонент матрикса — белковые волокна: коллагеновые и эластические. В гиалиновом хряще суставных поверхностей преобладает коллаген, обеспечивающий высокую прочность. Его крупные молекулы, закрученные в тройную спираль, устойчивы к любым деформациям и быстро возвращаются в исходное состояние. Также матрикс содержит глюкозаминогликаны, протеогликаны, гиалуроновую кислоту, которые удерживают воду и участвуют в обменных процессах.
Клетки хряща — хондроциты и их молодые формы хондробласты — играют не менее важную роль: синтезируют все компоненты матрикса и суставной жидкости. Хондроцитов очень мало, всего 1-5%, но именно на них лежит задача по обновлению и восстановлению хряща.
Одно из главных отличий хрящевой ткани – отсутствие сосудов. Как следствие, хрящи должны получать питание альтернативным способом. Синовиальная, или суставная, жидкость снижает трение между суставными поверхностями и обеспечивает питание хрящевой ткани. Поэтому доставку питательных веществ и выведение продуктов распада обеспечивает синовиальная жидкость.
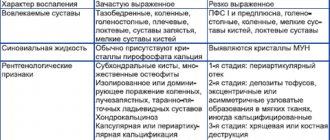
Влияние нестероидных противовоспалительных препаратов на метаболизм суставного хряща
ОА занимает первое место по распространенности среди других ревматических болезней и четко коррелирует с возрастом [1]. Рентгенологические симптомы этого заболевания встречаются у 50% населения Европы старше 65 лет, клинические – у 12,5%, а среди лиц старше 80 лет определяются почти у всех пациентов [2]. Для ОА характерно отсутствие корреляции между клинической симптоматикой, данными рентгенографии суставов, магнитно-резонансной и компьютерной томографии, ультразвуковой симптоматикой и макроскопической картиной, полученной при проведении артроскопии. Полагают, что лечение и вторичную профилактику ОА следует проводить только у лиц с наличием клинической картины заболевания, а именно боли и нарушения функции пораженных суставов. При этом заболевании поражаются в первую очередь «нагрузочные» суставы, что значительно ухудшает качество жизни больных и является серьезной социально-экономической проблемой. Наиболее значимыми клиническими проявлениями ОА являются боли в суставах и ограничение их подвижности. Боль в суставах представляет собой наиболее яркий признак этого заболевания, а динамика ее интенсивности и продолжительности служит наиболее важным показателем эффективности проводимой терапии. Боль носит механический характер, усиливаясь при физической нагрузке или к концу дня. Но боль при этом заболевании может быть и воспалительного типа, что обычно наблюдается при развитии вторичного артрита (синовита). Причины ее развития чрезвычайно многообразны и обусловлены заинтересованностью в патологическом процессе кости (периостит, субхондральные переломы, повышение внутрикостного давления), синовиальной оболочки (воспаление, раздражение чувствительных нервных окончаний остеофитами) и периартикулярных тканей (мышечный спазм, нестабильность сустава). Причиной боли могут быть и другие факторы, например, снижение сопротивляемости субхондральной кости к нагрузке, неравномерное распределение нагрузки на различные отделы суставов, дегенеративные изменения в периартикулярных тканях, нарушения кровообращения суставов. Лечение ОА включает в себя большой комплекс немедикаментозных и медикаментозных методов. Основой фармакотерапии ОА являются неопиоидные и опиоидные анальгетики (парацетамол, трамадол), системные нестероидные противовоспалительные препараты (НПВП), локальная терапия (НПВП, капсаицин, различные пластыри с противоболевой и антивоспалительной активностью, аппликации диметилсульфоксида). Важной составляющей программы лечения ОА являются симптоматические лекарственные средства медленного действия и, в первую очередь, глюкозамин сульфат или гидрохлорид и хондроитин сульфат (хотя мнение об их эффективности неоднозначно), а также внутрисуставные инъекции пролонгированных кристаллических глюкокортикоидов и препаратов гиалуроновой кислоты. Существует большой арсенал и альтернативных методов лечения, однако их доказательная база оставляет желать лучшего. Чем обоснована целесообразность назначения при ОА НПВП? Хотя ОА рассматривается в качестве основного дегенеративного заболевания суставов, в последнее время появились убедительные данные, позволяющие считать его заболеванием, в патогенезе которого важная, а возможно и определяющая, роль принадлежит персистирующему воспалению в тканях сустава с развитием рецидивирующего (вторичного) синовита, хондрита, остеита и периартрита. Персистирующее воспаление в тканях сустава способствует прогрессированию морфологических изменений, в т.ч. структурных изменений гиалинового хряща с его дегенерацией и уменьшением объема [3]. Интересно, что на Европейском конгрессе ревматологов в 2012 г. в Берлине (Германия) обсуждалась целесообразность назначения при этом заболевании низких доз преднизолона, метотрексата и применение моноклональных антител к фактору некроза опухоли-α (ФНО-α). Что лежит в основе воспаления при ОА? В настоящее время получены веские доказательства, подтверждающие влияние провоспалительных медиаторов на метаболизм клеток гиалинового хряща и прогрессирование ОА. Среди медиаторов, ответственных за его прогрессирование, ключевое значение имеет интерлейкин-1β (ИЛ-1β), который экспрессируется в пораженном ОА хряще и стимулирует выработку матриксных металлопротеиназ (ММPs) [4]. Известно, что в реализации прогрессирования патологических изменений при первичном ОА решающую роль играет гиперпродукция хондроцитами и другими клетками ММPs, включая коллагеназы (ММP-1, -8, -13), аггреканазы (ADAM-TS4 и -TS5), стромелизина-1 (ММP-3) и желатиназы (ММP-2, -9) [5]. ИЛ-1β тормозит экспрессию ингибиторов ММPs, синтез коллагена и протеогликанов, способствует синтезу активатора плазминогена и в то же время стимулирует синтез и высвобождение некоторых эйкозаноидов, включая простагландины (РGE) и лейкотриены. Он определяет уровень катаболического процесса при ОА и стимулирует продукцию других провоспалительных цитокинов (ИЛ-6, -8). Ведущая роль этого цитокина в развитии воспаления в тканях сустава подтверждается тем обстоятельством, что инъекции ИЛ-Ra способствуют разрешению клинических проявлений ОА [6]. В развитии ОА участвуют и другие медиаторы воспаления, в частности ФНО-α (TNF-α), ИЛ-17, ИЛ-18, онкостатин М (OSM), фактор ингибиции лейкемии (LIF) [4]. Cодержание ФНО-α существенно ниже при ОА, чем при ревматоидном артрите, но достоверно выше, чем у здоровых лиц. OSM, член семейства ИЛ-6, играет определенную роль в воспалении. В эксперименте показано, что он способствует высвобождению из ткани хряща протеогликанов, стромелизина-1 и коллагена. ОSM усиливает активность других провоспалительных медиаторов, включая ИЛ-6. В свою очередь, ИЛ-6 индуцирует синтез тканевого ингибитора ММРs. ИЛ-18 обнаруживают в биоптатах гиалинового хряща и синовиальной оболочки, полученных от больных ОА. Другие медиаторы воспаления также принимают участие в патогенезе ОА. Остеоартрозный хрящ экспрессирует высокие значения оксида азота (NO), которые выявляются в сыворотке крови и синовиальной жидкости. In vitro получены веские доказательства, что этот медиатор и его окисленные метаболиты обладают антивоспалительным и катаболическим действием [7]. NO ингибирует синтез макромолекул матрикса хряща и снижает экспрессию ИЛ-1Ra хондроцитами, участвует в синтезе PGE2, способствует апоптозу хондроцитов, снижает интенсивность анаболического процесса. С другой стороны, PGЕ2 способствует повреждению тканей сустава, потенцируя другие медиаторы воспаления, влияет непосредственно на ремоделирование хряща, продукцию MMPs, остеокластическую костную резорбцию и ангиогенез [8]. Все вышеприведенное обосновывает назначение противовоспалительной терапии при ОА. Складывается впечатление, что и положительный эффект симптом-модифицирующих препаратов медленного действия, ранее называвшихся хондропротекторами, прежде всего связан с угнетением персистирующего воспаления в тканях сустава и, в первую очередь, в гиалиновом хряще. В терапии ОА основными симптом-модифицирующими препаратами быстрого действия являются простые анальгетики и НПВП. Последние занимают лидирующее положение, активно подавляют боль и нормализуют функцию пораженных суставов (табл. 1). Они показаны при наличии вторичного (реактивного) артрита или периартрита, например при синдроме «гусиной лапки», а также при выраженных болях, которые не удается купировать простыми или опиоидными анальгетиками. Биологическая активность НПВП обусловлена различными по своему патогенезу механизмами, многие из которых не связаны с ингибицией РGE. Так, они подавляют функцию нейтрофилов и взаимодействие лейкоцитов с эндотелием сосудов, угнетают активацию NF-kB (фактора транскрипции), который является регулятором синтеза провоспалительных цитокинов, подавляют пролиферацию некоторых клеток и индуцируют их апоптоз, угнетают активность ММPs [9]. НПВП характеризуются различными механизмами воздействия на гиалиновый хряща [10, 11], но в преобладающем большинстве они угнетают его метаболизм. Так, cалицилаты, ибупрофен и напроксен ингибируют синтез основных компонентов матрикса хряща, включая синтез протеогликанов, гликозаминогликанов (ГАГ) и гиалуроната, а также увеличивают их высвобождение. Индометацин ингибирует гликозилтрансферазу, которая участвует в синтезе полисахаридных цепей протеогликанов, а также нарушает скорость инкорпорирования в них сульфатов. Напроксен достоверно уменьшает содержание протеогликанов и влияет на активность металлопротеиназ в суставном хряще, как это свойственно и нимесулиду. Негативное влияние НПВП на хрящ осуществляется также за счет нарушения окислительного фосфорилирования в митохондриях, активации цАМФ-зависимой киназы А, нарушения белок-белковых взаимодействий на уровне клеточной мембраны. Преобладающее большинство НПВП ингибируют NO-индуцированный апоптоз, причем независимо от ингибиции СОХ2 и продукции РGE2. Следует подчеркнуть, что представленные выше данные о влиянии НПВП на метаболизм суставного хряща были получены в основном в эксперименте на модели культуры ткани суставного хряща, и это следует учитывать при оценке полученных результатов. Действие НПВП на метаболические процессы в хондроцитах в каждом конкретном случае связано с их метаболической активностью, протестированной дозой исследуемого препарата, возрастом донора, стадией ОА и степенью повреждения хряща. Интересные данные представил D.A. Кalbhen [12]. Автор, используя методы гистологии, рентгенологической и стереоэлектронной микроскопии, а также биохимические тесты, показал, что салицилаты, индометацин, фенилбутазон, напроксен, ибупрофен, дексаметазон, введенные внутрисуставно, вызывают дегенеративные изменения в суставном хряще и субхондральной кости у крыс и кур. Большое число экспериментальных и клинических наблюдений позволило сделать вывод, что НПВП в большинстве случаев тормозят метаболическую активность хондробластов и хондроцитов, снижают синтез протеогликанов, коллагена II типа и гиалуроновой кислоты, способствуют преждевременной гибели хондроцитов, усиливают дегенерацию хряща и ведут к прогрессированию ОА. Представленные данные дали основание экспертам European Group for the Respect and of Ethics and Exellence in Science (GREES) сделать заключение о том, что пока нет достаточно убедительных данных, свидетельствующих о благоприятном действии на хрящевую ткань широко применяющихся НПВП (диклофенак, напроксен) и селективных ингибиторов циклооксигеназы-2 (ЦОГ-2) [13]. По мнению экспертов этой группы, «идеальный» НПВП не должен негативно влиять на здоровый контралатеральный хрящ и в то же время должен стимулировать синтез хрящевой ткани, замедлять резорбцию хряща и ингибировать синтез катаболических цитокинов. По влиянию на метаболизм гиалинового хряща НПВП можно классифицировать препараты, обладающие хондронегативным, хондронейтральным и хондропротективным действием. Хондронегативным влиянием на хрящ обладают индометацин, пироксикам, напроксен и некоторые другие традиционные НПВП, хондронейтральным – ибупрофен, диклофенак, хондропротективным – ацеклофенак, кетопрофен и мелоксикам. Ацеклофенак (Аэртал) зарекомендовал себя как препарат, обладающий высокой антивоспалительной активностью и хорошей переносимостью. Он является производным фенилацетиловой кислоты (2-[2,6 – дихлорфенил) амино] фенилацетоуксусная кислота) и по своей структуре близок к диклофенаку. Препарат не обладает кумулятивной активностью, а его фармакокинетика не зависит от возраста пациентов, что имеет значение при лечении больных с ОА. Антивоспалительное действие ацеклофенака, как и других НПВП, реализуется путем подавления синтеза медиаторов воспаления и прежде всего РGE2. Показано, что у больных ОА с проявлениями вторичного артрита ацеклофенак, по сравнению с диклофенаком, в большей степени снижает уровень РGE2 в синовиальной жидкости, селективно подавляя экспрессию ЦОГ-2. Его терапевтическое действие также связано с ингибированием провоспалительных цитокинов (ИЛ-1, ФНО-a) и повышением уровня синтеза ИЛ-1Ra (антагониста рецепторов к ИЛ-1), снижением экспрессии молекул адгезии, антиоксидантными свойствами ацеклофенака, реализуется влиянием на свободные радикалы, подавлением продукции NO в хондроцитах здоровых и больных ОА, торможением пролиферации синовиоцитов [14–16]. Как известно, при ОА наблюдается диссонанс между процессами синтеза и деградации хряща, что является одним из характерных проявлений его патогенеза. При изучении образцов хрящевой ткани, полученных при эндопротезировании тазобедренных суставов от больных ОА и лиц без данной патологии, оценивали влияние диклофенака и напроксена на синтез ГАГ. При ОА базальный синтез ГАГ был ниже, чем в образцах нормальной ткани, а степень уменьшения их продукции коррелировала с выраженностью патологического процесса. Ацеклофенак (0,4–10 мкг/мл) значительно увеличивал выработку ГАГ в пораженной ОА хрящевой ткани, в то время как диклофенак в таком же диапазоне концентраций не вызывал никакого эффекта, а напроксен существенно угнетал синтез ГАГ в хрящевой ткани пациентов с ОА (рис. 1). Особенностью фармакологической активности ацеклофенака и его основного метаболита – 4′-гидроксиацеклофенака является преимущественно подавление ЦОГ-2 и, в меньшей степени, ЦОГ-1 [17]. Другой его метаболит – диклофенак угнетает как ЦОГ-1, так и ЦОГ-2. Это и объясняет не только его выраженный антивоспалительный потенциал, но и высокую безопасность. При приеме ацеклофенака соотношение ЦОГ-2 к ЦОГ-1 выше, чем при приеме стандартных НПВП, таких как пироксикам, индометацин, теноксикам и кетопрофен. Преимущественное ингибирование ЦОГ-2 показано, в частности, в культуре нормальных и пораженных ОА хондроцитов при их инкубировании с ацеклофенаком [18]. Рациональность использования ацеклофенака у больных ОА находит свое объяснение не только благодаря его антивоспалительному и анальгетическому свойствам, но и особенностям влияния на метаболизм основного вещества гиалинового хряща (табл. 2). Ацеклофенак стимулирует хондроциты к выработке межклеточного вещества хряща – протеогликанов, ГАГ и коллагена, необходимых для полноценной функции хряща. Он также стимулирует синтез ГАГ в хряще, полученном от больных ОА, в то время как диклофенак и напроксен не обладают такими свойствами. Кроме того, он тормозит преждевременную гибель хондроцитов. В эксперименте ацеклофенак демонстрирует хондропротективные свойства, супрессируя ИЛ-1 – опосредованную продукцию MMPs, подавляет экспрессию ИЛ-6 хондроцитами. Он посредством своего основного метаболита 4-гидроксиацеклофенака подавляет проколлагеназу/проММР–1 и простромелизин/проММР-3. По своей антивоспалительной активности ацеклофенак при основных воспалительных заболеваниях суставов и позвоночника эквивалентен диклофенаку, пироксикаму, индометацину и теноксикаму. Симптом-модифицирующие его свойства были изучены в нескольких двойных слепых контролируемых исследованиях. Эффективность ацеклофенака в плане подавления основных проявлений ОА, а именно уменьшения интенсивности боли в суставах и нормализации функциональной способности пораженных суставов, существенно выше по сравнению с плацебо и эквивалентна эффективности диклофенака, пироксикама и напроксена. При сравнительной оценке ацеклофенака и диклофенака у 397 больных с гонартрозом достоверная положительная динамика наблюдалась в 2-х группах спустя 12 нед. от начала лечения. Однонаправленность изменений касалась не только интенсивности болей или функции суставов, но и глобальной активности болезни [19]. Но все же боль в суставе по оценке пациента при лечении ацеклофенаком уменьшилась более значительно, чем при лечении диклофенаком (снижение на 71 и 59% соответственно). Симптоматическое действие ацеклофенака при ОА сравнивали и с действием других НПВП. В мультицентровом двойном слепом рандомизированном исследовании изучали эффективность ацеклофенака (200 мг/сут) и напроксена (1000 мг/сут) у 374 больных [20]. В обеих группах к концу 12 нед. наблюдались достоверное снижение интенсивности боли в покое, боли при движении или пальпации сустава, а также разрешение экссудативных явлений в коленных суставах и улучшение их функции. Анализ динамики основных показателей патологического процесса не выявил достоверного различия между группами больных, хотя быстрее положительная динамика отмечалась у больных, которые лечились ацеклофенаком. В другом исследовании ацеклофенак сравнивали с пироксикамом у больных гонартрозом [21]. По суммарной оценке эффективность этих 2-х препаратов была практически одинаковой, но если ацеклофенак демонстрировал существенное уменьшение боли и нормализацию функции коленного сустава спустя 2 нед. от начала терапии, то пироксикам – только к концу 1-го мес. Рациональность использования ацеклофенака в терапии ОА определяется не только его позитивным действием на метаболизм хрящевой ткани и выраженным антивоспалительным действием, но и его хорошей переносимостью. Это представляется особенно важным, учитывая, что ОА болеют в основном лица пожилого и старческого возраста, которые хуже переносят НПВП, чем лица молодого возраста. Имеют значение и большое количество коморбидных состояний у данной категории пациентов, а также вероятность полипрагмазии и рациональность сочетания отдельных лекарственных препаратов, которыми пациенты регулярно пользуются. О хорошей переносимости Аэртала свидетельствуют результаты большого 12-месячного проспективного открытого многоцентрового исследования SAMM (Safety Assessment of Marketed Medicines), в котором оценивалась безопасность ацеклофенака и диклофенака у больных с ревматическими заболеваниями [22]. Это исследование основано на изучении 10 142 больных, причем у преобладающего большинства (91,4%) имелся ОА. Больные 1-й группы (7890 человек) принимали 200 мг/сут ацеклофенака, 2-й группы (2252 человека) – 150 мг/сут диклофенака. Средняя продолжительность приема лекарств в обеих группах была примерно одинаковой и составила для Аэртала 168,1 дня, для диклофенака – 170 дней. Общее число нежелательных явлений (НЯ) было достоверно ниже у больных, принимающих ацеклофенак, по сравнению с больными, которые лечились диклофенаком (р<0,001), что в равной степени относится и к числу больных, прекративших прием препарата из-за его непереносимости. У больных 1-й группы было меньше желудочно-кишечных реакций, чем у больных 2-й группы, причем частота развития тошноты, боли в животе и диареи, приведших к прекращению лечения, была соответственно на 46, 65 и 41% ниже в группе ацеклофенака, чем в группе диклофенака. Метаанализ результатов 13 двойных слепых рандомизированных исследований безопасности ацеклофенака, в которых приняли участие 3574 больных с ОА, ревматоидным артритом или анкилозирующим спондилоартритом, продемонстрировал лучший профиль безопасности этого препарата по сравнению с таковым классических НПВП, включая диклофенак, индометацин, напроксен, пироксикам и теноксикам [23]. При лечении ацеклофенаком НЯ встречались в 1,38 раза реже, чем у группы больных, лечившихся традиционными НПВП (р<0,001), при этом отмена терапии в связи с токсичностью ацеклофенака была также достоверно реже, чем у больных группы сравнения. Заслуживает внимания мультицентровое исследование по анализу кровотечений из желудка и двенадцатиперстной кишки, в т.ч. и при приеме НПВП [24]. В результате проведенного исследования оказалось, что 38% всех случаев кровотечений из верхних отделов пищеварительного тракта у лиц старше 18 лет были связаны с приемом НПВП, что составляет 152 случая на 1 млн населения в год. Наиболее высокий риск кровотечения был при приеме кеторолака – 24,7. При приеме рофекоксиба он составлял 7,2, мелоксикама – 5,7, декскетопрофена – 4,9, нимесулида – 3,2, целекоксиба – 0,3 и ацеклофенака – 1,4 (95% СI 0,6, 3,3). Авторы не подтвердили, что селективные ЦОГ-2 НПВП имеют меньший риск развития кровотечений, чем традиционные препараты, и отметили низкий риск этого осложнения у лиц, принимающих ацеклофенак. Таким образом, ацеклофенак (Аэртал) является НПВП, который по своей антивоспалительной и анальгезирующей активности не уступает стандартным лекарственным препаратам этого класса. Его применение целесообразно при ОА, что обусловлено способностью стимулировать клетки хряща к выработке полноценных протеогликанов, ГАГ, гиалуроновой кислоты и тормозить апоптоз хондроцитов, что является особенно важным в свете современных представлений об ОА как заболевании, которое развивается вследствие преждевременной гибели хондроцитов на самых ранних этапах его развития. Преимущественное влияние ацеклофенака на ЦОГ-2 обеспечивает его хорошую переносимость и высокую безопасность. Позитивные свойства этого препарата повышают уровень комплаентности лечения по сравнению со стандартными НПВП.
Литература 1. Perrot S., Menkes C.J. Nonpharmacological approaches to pain in osteoarthritis. Available options // Drugs. 1996. Vol. 52. Р. 21–26. 2. Sangha O. Epidemiology of rheumatic disease // Rheumatology. 2000. 39 (Suppl. 2). Р. 3–12. 3. Van den Berg W.B. Pathophisiology of osteoarthritis // Joint Bone Spine. 2000. Vol. 67. Р. 555–556. 4. Martel-Pelletier J., Pelletier J.-P. Inflammatory factors involved in osteoarthritis. In: Osteoarthritis, Inflammation and Degradation: A Continuum. IOS Press. 2007. Р. 3–13. 5. HenrotinY., Reginster T. In vitro difference among nonsteroidal antiinflammatory drug in their activities related to osteoarthritis pathophysiology // Osteoarthritis Cartilage. 1999. Vol. 7. Р. 355–357. 6. Huskinsson E.C., Berry P., Gishen P. Effects of antiinflammatory drugs on the progression of osteoarthritis of the knee // J Rheumatol. 1995. Vol. 22. Р. 1941–1946. 7. Abramson S.B. Osteoarthritis and nitric oxide // Osteoarthritis and Cartilage. 2008. Vol. 16 (Suppl 2). Р. 15–20. 8. Herrero-Beaumont G., Rovati L.C. Use of crystalline sulfate in osteoarthritis // Future Rheumatology. 2006. Vol. 1 (4). Р. 397–414. 9. Насонова В.А., Насонов Е.Л. Рациональная фармакотерапия ревматических заболеваний. М.: Литтерра, 2003. 10. Ding C. Do NSAID affect the progression of osteoarthritis? // Inflammation. 2002. Vol. 26. Р. 139–142. 11. Mastbergen S.C., Biijlsma J.W., Lefeber F.P. Selective COX-2 inhibition is favorable to human early and latestage osteoarthritis cartilage: a human in vitro study // Osteoarthritis Cartilage. 2005. Vol. 13. Р. 519–526. 12. Kalbhen D.A. The influence of NSAIDs on morphology of articular cartilage // Scand J Rheumatol. 1988. Vol. 77 (Suppl). Р. 13–22. 13. Recommendations for the registration of drug used in the treatment of osteoarthritis // Ann Rheum Dis. 1996. Vol. 55. Р. 552–557. 14. Aceclofenac. Almirall Prodespharma S.A. Barselona, 2003. 120 p. 15. Grau M., Guash J., Montero J.l. et al. Pharmacology of the potent new non-steroidal inflammatory agent aceclofenac // Arzneimittelforschung. 1991. Vol. 41. Р. 1265–1276. 16. Murherjee P., Rachita C., Aisen P.S., Pasinetti G.M. Non-steroidal anti-inflammatory drugs protect against chondrocyte apoptotic death // Clin Eхp Rheumatol. 2001. Vol. 19 (Suppl. 22). Р. 7–11. 17. Henrotin Y., De Leval Х, Mathy-Hartet M et al. In vitro effects of aceclofenac and its metabolites on the production by chondrocytes of inflammatory mediators // Inflamm Res. 2001. Vol. 50. Р. 391–399. 18. Blanco F.J., Maneiro E., de Toro F.J. et al. Effect of NSAIDs on synthesis of IL-1 receptor by human articular chondrocytes // Lab Invest Rheumatol. 2000. THO 17. 19. Ward D.E., Veys E.M., Bowdler J.M., Roma J. Comparison of aceclofenac with diclofenac in the treatment of osteoarthris // Clin Rheumatol. 1995. Vol. 14. Р. 656–662. 20. Korsanoff D., Frerick H., Bowdler J., Montull E. Aceclofenac is well-tolerated alternative to naproхen in the treatment osteoarthritis // Clin Rheumatol. 1997. Vol. 16. Р. 32–38. 21. Perez Busquer M., Calero E., Rodriguez M. et al. Comparison of aceclofenac with рiroхicam in the treatment of osteoarthritis // Clin Rheumatol. 1997. Vol. 16. Р. 154–159. 22. Huskisson E., Irani M., Murray F. A large prospective open-label, multicentre SAMM study, comparing the safety of aceclofenac in patients with rheumatic disease // Eur J Rheumatol Inflamm. 2000. Vol. 7. Р. 1–7. 23. Peris F., Bird H.A., Serni U. et al. Treatment compliance and safety of aceclofenac versus NSAIDs in patients with common arthritis disorders: a meta-analysis // Eur J Rheumatol Inflamm. 1996. Vol. 16. Р. 37–45. 24. Laporte J.-R., Ibanez L., Vidal Х. et al. Upper gastrointestinal bleedng accociated with the use NSAIDs. Newer versus older agents // Drug Safety. 2004. Vol. 27 (6). Р. 411–420.
Причины разрушения хрящевой ткани
Хрящ в суставах подвергается значительным нагрузкам, и в определенных обстоятельствах он не выдерживает: начинает разрушаться. Особенно, если в организме происходят изменения, снижающие его регенеративные способности. В этом случае развивается остеоартрит — заболевание, вызванное дистрофическими изменениями или разрушением хрящевой и костной тканей суставов. Раньше использовалось еще одно название данного состояния — остеоартроз, подчеркивающее возрастной характер изменений. Но, так как на фоне разрушения костно-хрящевых структур неизбежно развиваются воспалительные процессы, и именно они вызывают характерные симптомы, сейчас преимущественно используется термин «остеоартрит», а согласно международной классификации болезней (МКБ-10) оба эти диагноза считаются синонимами. В отношении дистрофических изменений, связанных с разрушением хрящевой и костной тканей позвоночника, принято использовать термин «остеохондроз».
Причины разрушения хрящевой ткани разнообразны: